Эффективность и переносимость эторикоксиба (Аркоксии) при ревматических заболеваниях
- Аннотация
- Статья
- Ссылки

![Рис. 4. Частота перфораций, изъязвлений и кровотечений из верхнего отдела ЖКТ при приеме эторикоксиба и неселективных НПВП [9]](/upload/resize_cache/iblock/a75/195_350_1/arkoxia5.jpg)
Нестероидные противовоспалительные препараты (НПВП) широко используются в ревматологии в лечении широкого спектра воспалительных и дегенеративных заболеваний суставов и позвоночника, включая ревматоидный артрит, анкилозирующий спондилит и другие спондилоартриты, остеоартроз, межпозвонковый остеохондроз, микрокристаллические артропатии, диффузные заболевания соединительной ткани, болезни внесуставных мягких тканей, заболевания, сопровождающиеся болями в нижней части спины. Они являются облигатным компонентом терапии большинства заболеваний, находящихся в поле зрения врача-ревматолога, выступая при этом в качестве основных симптом-модифицирующих препаратов и средств выбора для стартовой терапии артритов и артрозов.
Наиболее частым показанием к применению этого класса фармакологических агентов являются как острые, так и хронические боли различного генеза. НПВП применяются в лечении посттравматических и послеоперационных болевых синдромов, особенно сопровождающихся воспалением, невропатиях различного происхождения, тяжелых приступах мигрени, олигоменорее, почечной и желчной колике, в онкологии для профилактики колоректального рака и возможного метастазирования, а также для профилактики тромбообразования [1]. Хронический болевой синдром является основной жалобой пациентов, обращающихся к неврологу и ревматологу. От 10 до 40% людей старше 55 лет принимают НПВП, причем 6% из них – более 9 месяцев в году. Эпидемиологические данные свидетельствуют о том, что как острый, так и хронический болевой синдром в большинстве случаев обусловлен поражением суставов, мышц, околосуставных тканей и позвоночника, причем острыми болевыми синдромами страдает один из 5 взрослых европейцев, а хроническими – один из 3. Боль существенно ухудшает качество жизни пациентов и приводит к значительным материальным, социальным и нравственным потерям. Данными эпидемиологического исследования установлено, что у взрослого населения среди острых болей длительностью до 10 дней в году лидируют головные боли (73%), боли в спине (56%), мышечные и суставные боли (56% и 51% соответственно), а от 10 до 100 дней в году – боли в суставах (10%) и боли в спине (9%), намного опережая другие причины болей такой же длительности.
Класс НПВП объединяет большое количество препаратов, которые различаются по выраженности антивоспалительной и анальгетической активности, путям введения препарата в организм, области применения, спектру нежелательных явлений и категории ингибиции циклооксигеназы (ЦОГ) – основного механизма действия этих фармакологических агентов. По характеру блокирования ЦОГ НПВП разделяют на селективные ингибиторы ЦОГ и селективные ингибиторы ЦОГ-2 [2]. Полагают, что НПВП в большей степени различаются между собой по своей переносимости, чем по эффективности.
Основным механизмом действия НПВП является ингибирование синтеза простагландинов, включая ПГЕ2, подавление экспрессии ЦОГ-1 и ЦОГ-2, ингибирование высвобождения внутриклеточной арахидоновой кислоты, подавление экспрессии ЦОГ-2 в задних рогах спинного мозга и ЦНС, угнетение синтеза лейкотриенов [3]. Кроме того, они ингибируют ИЛ-1β, ИЛ-6, ФНО-α, подавляют высвобождение лизосомальных ферментов, снижают экспрессию молекул адгезии (L-селектин, VCAM-1), подавляют продукцию оксида азота, демонстрируют свойства антиоксидантов, воздействуют на свободные радикалы, тормозят пролиферацию синовиоцитов. Некоторые НПВП стимулируют синтез протеогликанов и гиалуроновой кислоты, устраняют торможение синтеза глюкозаминогликанов ИЛ-1, угнетают экспрессию металлопротеиназ (ММП-1, ММП-3), что имеет определенное значение при лечении остеоартроза.
Разнообразная направленность биологического действия НПВП объясняет не только их противовоспалительное действие, но и большой спектр возможных нежелательных явлений (НЯ), которые развиваются на фоне их приема. Наиболее часто наблюдаются желудочно-кишечные нарушения, которые могут проявляться диспепсией, развитием эрозивного гастрита и дуоденита, образованием язв и их прободением, желудочными кровотечениями. Частота желудочно-кишечных НЯ коррелирует с возрастом больных, сопутствующими заболеваниями, характером принимаемой терапии. Смертность от НПВП-ассоциированных язв верхних отделов желудочно-кишечного тракта у лиц до 40 лет составляет 0,5%, от 70 до 75 лет – 3,5%, а после 80 лет – 5,6%. Кроме того, НПВП обладают нефро- и гепатотоксичностью, способствуют задержке жидкости в организме и развитию сердечной недостаточности, артериальной гипертонии, обладают дистрофогенным действием на миокард, воздействуют на метаболизм клеток мозга. Возможны гематологические нарушения вплоть до тяжелых цитопений, торможение агрегации тромбоцитов, аллергические реакции и бронхообструктивный синдром («аспириновая» астма), что связано с влиянием НПВП на продукцию лейкотриенов. В этом плане представляется чрезвычайно важным поиск такого НПВП, который наряду с выраженным противовоспалительным и анальгетическим действием обладал бы хорошей переносимостью как при краткосрочном, так и при длительном их применении. Внимания заслуживает препарат Аркоксиа (эторикоксиб), специфический ингибитор ЦОГ-2, который обладает гораздо более избирательным действием и, следовательно, в меньшей степени влияет на нормальные физиологические процессы. Использование селективных ингибиторов ЦОГ-2 в клинической практике позволяет значительно сократить количество НЯ со стороны ЖКТ и, следовательно, существенно расширяет возможности оказания эффективной медицинской помощи больным с ревматическими заболеваниями, поскольку, согласно Lanas, риск развития осложнений в верхних отделах ЖКТ на фоне приема НПВП увеличивается в среднем в 4 раза, язв – в 5 раз, а летальность составляет 15,3 на 100 000 пролеченных больных [4].
Эторикоксиб обладает высокой антивоспалительной и анальгетической активностью. Он хорошо всасывается из желудочно-кишечного тракта, при этом его биодоступность при пероральном приеме составляет около 100%, а максимальная концентрация в плазме (Сmax) достигается через 1 ч после приема. По сравнению с другими НПВП он действует быстрее (у диклофенака натрия Сmax составляет от 2 до 6 ч, ибупрофена и мелоксикама – от 1 до 6 ч, а у напроксена и нимесулида – от 2 до 4 ч). Период полувыведения эторикоксиба составляет около 22 ч, что обеспечивает его фармакологическое действие в течение 24 ч и позволяет его применять 1 раз в сутки [5, 6]. Благодаря низкой гастротоксичности и особенностям фармакокинетики эторикоксиб, в отличие от многих других НПВП, может приниматься вне зависимости от приема пищи.
Эторикоксиб представляет собой производное дипиридинила, содержащее (4-метилсульфонил)фенильную группу, связанную с центральным кольцом и обеспечивающую взаимодействие с ЦОГ-2 [7], которое приводит к снижению выработки веществ, опосредующих развитие и сохранение активности этого изофермента. Секреция соединений, поддерживающих нормальные физиологические процессы, в целом остается на достаточном уровне. В исследованиях цельной крови человека было показано, что эторикоксиб оказывает на ЦОГ-2 примерно в 106 раз более мощное действие, чем на ЦОГ-1, и имеет более выраженную ЦОГ-2-селективность, чем другие НПВП (табл. 1).
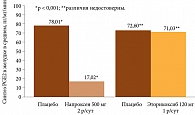
Эторикоксиб не влияет на синтез гастропротектора простагландина E2 (PGE2) и по этому показателю не отличается от плацебо, чем и объясняется его низкая гастротоксичность. В рандомизированном плацебоконтролируемом исследовании многократного приема с двумя видами терапии и плацебо изучали влияние эторикоксиба в дозе 120 мг/сут и напроксена 1000 мг/сут на синтез гастропротектора PGE2 ex vivo в биоптате желудка. Напроксен снижал синтез PGE2 в желудке примерно на 78% (р < 0,001 по сравнению с плацебо), что свидетельствовало о значительном ингибировании ЦОГ-1 (рис. 1). Напротив, эторикоксиб показал низкий уровень ингибирования ЦОГ-1, равный всего 2% (р < NS по сравнению с плацебо) [8, 9].
Клиническая эффективность эторикоксиба прослежена на примере основных нозологических форм, находящихся в поле зрения врача-ревматолога. Выраженное противовоспалительное действие этого НПВП отмечено у пациентов с ревматоидным артритом (РА). Эторикоксиб сравнивался с напроксеном в двух больших рандомизированных плацебоконтролируемых клинических исследованиях, в которых участвовали 1700 пациентов. Пациенты были распределены в группы эторикоксиба 60 и 90 мг/сут, напроксена 1000 мг/сут или плацебо. Длительность терапии составила 12 нед. Различия в эффективности лечения определялись путем изменения степени болевой чувствительности в суставах, выраженности экссудативных явлений и общей оценки эффективности пациентами и исследователем [10]. Результаты данных исследований показали, что в группе эторикоксиба эффективность терапии составила 52,6% и была почти в 1,5 раза выше, чем в группе напроксена, и в 2,5 раза выше, чем у пациентов, принимавших плацебо. Более того, было доказано, что на фоне приема высокой дозы эторикоксиба отмечается существенное снижение числа припухших суставов, то есть показателя, который в большей степени отражает противовоспалительное действие использованного препарата [11].
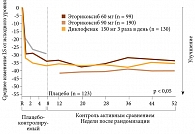
В долгосрочном исследовании по определению оптимального диапазона доз эторикоксиба у пациентов с РА было установлено, что суточная доза 90 мг способствует существенно более высокой эффективности лечения по сравнению с 60 мг. Что касается диклофенака 150 мг/сут, то он был эффективнее 60 мг эторикоксиба, но уступал по своему действию эторикоксибу 90 мг/сут (рис. 2) [10]. Полученное позитивное действие эторикоксиба, развившееся в первые 12 нед. терапии, сохранялось весь 52-недельный период наблюдения. В этом исследовании доза эторикоксиба 90 мг один раз в день была определена как рекомендованная доза для лечения РА.
Еще более значимый лечебный эффект эторикоксиб показал при анкилозирующем спондилите (АС). Известно, что НПВП являются лекарствами первой линии и облигатным компонентом комбинированной терапии АС. Они быстро снижают интенсивность боли, а также продолжительность и выраженность утренней ригидности, а положительный эффект в первые 48 ч их приема рассматривается в качестве одного из диагностических критериев этого заболевания. Ранее полагали, что если больной не отвечает на терапию НПВП, то вероятность диагноза АС составляет всего 3%. По данным A. Wanders и соавт., НПВП при регулярном применении способствуют снижению темпов рентгенологического прогрессирования АС в 4 раза по сравнению с плацебо [12]. Эти данные имеют большое значение, так как базисных противовоспалительных препаратов, направленных на снижение прогрессирования АС, в настоящее время нет, кроме сульфасалазина, который действует только на проявления периферического артрита, но не спондилита. Эторикоксиб при этом заболевании способствует хорошему клиническому ответу у 70% пациентов [13]. Эффективность эторикоксиба 90 и 120 мг/сут в плане снижения интенсивности боли в спине оказалась одинаковой и была достоверно выше по сравнению с приемом 1000 мг напроксена как в первые 6 нед., так и в последующие 52 нед. терапии.
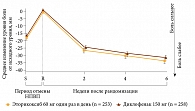
Эффективность эторикоксиба при остеоартрозе (ОА) изучена в многочисленных контролированных исследованиях с участием более чем 4400 пациентов с гонартрозом, коксартрозом и ОА суставов кистей [14]. В частности, эторикоксиб 30 мг/сут оказался не менее эффективным, чем ибупрофен 2400 мг/сут, по показателю снижения боли по шкале WOMAC. Применение эторикоксиба 60 мг один раз в день и диклофенака 50 мг 3 раза в день обеспечивало эффективное и устойчивое уменьшение боли по шкале WOMAC при ОА в течение 6 нед. исследования, причем ее снижение наблюдалось при применении обоих препаратов уже на 2-й нед. и сохранялось в течение всего периода лечения (рис. 3). Максимальный эффект наблюдался на 6-й нед. К окончанию исследования величина ВАШ снизилась по сравнению с исходной на 31,3 мм в группе эторикоксиба и на 30,9 мм в группе диклофенака [15]. При лечении остеоартроза важным обстоятельством является тот факт, что у больных пожилого возраста (65 лет и старше) фармакокинетика эторикоксиба подобна фармакокинетике у лиц молодого возраста.
Эторикоксиб применяется для купирования острой и хронической боли. Его быстрое (уже через 20 мин) начало действия и максимальная концентрация в воспаленной ткани позволяют использовать данный препарат для оказания немедленной помощи с наибольшей частотой реализации обезболивающего эффекта с первой попытки. Достоинства эторикоксиба в качестве препарата для лечения хронической боли заключаются в отсутствии привыкания при длительном приеме, сохранении эффективности на протяжении всего периода лечения, безопасном профиле и возможности калибровки индивидуальной дозы.
Данный селективный НПВП показал высокую эффективность при остром приступе подагры, который, как правило, характеризуется ярко выраженным болевым синдромом и значительной воспалительной реакцией. При исследовании 150 больных с нарушением пуринового обмена и острым приступом подагрического артрита пациенты были разделены на две группы. Основная группа лечилась эторикоксибом 120 мг/сут, пациенты контрольной группы получали индометацин 150 мг/сут. Эффективность двух препаратов в плане купирования острых болей оказалась одинаковой [16]. Однако индометацин, как известно, обладает особенно большим диапазоном НЯ, из-за чего в настоящее время в клинической практике используется крайне редко.
Анальгетический эффект эторикоксиба используется и в стоматологии. После удаления зуба существенное уменьшение интенсивности боли через 8 ч после приема эторикоксиба наблюдалось у 20,9% пациентов, тогда как после приема других препаратов, которые широко применяются в лечении болей различного генеза, этот процент был ниже: для напроксена он составил 21,3%, для кодеина с парацетамолом – только у 11,5% (общее количество пациентов 201) [17].
Эторикоксиб характеризуется высокой безопасностью. Он имеет как общие особенности по переносимости с другими коксибами, что в первую очередь относится к гастроинтестинальной токсичности, так и отличительные черты. Последнее касается прежде всего его кардиоваскулярной безопасности.
Эторикоксиб статистически значимо снижал частоту отмены терапии из-за НЯ со стороны ЖКТ. Была проанализирована частота возникновения серьезных осложнений (перфораций, язв и кровотечений) у пациентов, получавших эторикоксиб в дозах 60, 90 или 120 мг/сут (общее число пациентов 3142) или неселективные НПВС, в частности, напроксен 1000 мг/сут, диклофенак 150 мг/сут или ибупрофен 2400 мг/сут (общее число пациентов 1828), в рамках объединенного анализа 10 клинических исследований у пациентов с ОА, РА и хронической болью в нижней части спины. В анализ включали серьезные НЯ, которые возникали во время терапии или в течение 14 дней после окончания лечения. Частота подтвержденных явлений оказалась равна 1,16/100 пациенто-лет у пациентов, получавших эторикоксиб, и 3,05/100 пациенто-лет у больных, получавших неселективные НПВП (рис. 4) [9]. Эторикоксиб в дозе ≥ 60 мг снижал риск перфораций, язв и кровотечений ЖКТ приблизительно на 55% по сравнению с неселективными НПВП (р < 0,001).
На фоне терапии эторикоксибом наблюдалась статистически значимая меньшая скрытая потеря крови по сравнению с ибупрофеном, меньшая частота язв и эрозий ЖКТ по сравнению с напроксеном и ибупрофеном, а также была ниже относительная частота применения сопутствующих препаратов, влияющих на ЖКТ, и случаев отмены терапии из-за симптомов со стороны ЖКТ и нежелательных явлений.
Подобно другим специфическим ингибиторам ЦОГ-2, эторикоксиб не влияет на функцию тромбоцитов. В метаанализе рандомизированных контролированных исследований, в которых приняли участие 4585 пациентов, сравнивались эторикоксиб и плацебо. Риск тромботических кардиоваскулярных осложнений в двух изучаемых группах оказался почти равным и составил 1,11% в группе эторикоксиба и 1,0% – плацебо [18]. Но все же эти данные свидетельствуют о том, что у лиц с нестабильной стенокардией или очаговой дистрофией миокарда от назначения эторикоксиба следует воздержаться. Следует с осторожностью применять его и у больных с артериальной гипертонией. Так, в 10 плацебоконтролируемых исследованиях длительностью от 6 до 12 нед. из программы клинической разработки одно или более НЯ, связанных с артериальной гипертензией, выявлены у 3,9, 4,2 и 4,7% пациентов, получавших эторикоксиб в дозах 60, 90 и 120 мг 1 р/сут соответственно. Частота таких явлений в группе плацебо была 2,6%, в группе напроксена 1000 мг/сут – 3,5% и в группе ибупрофена 2400 мг/сут – 7,1% [7, 8]. Как и другие препараты, ингибирующие синтез простагландинов, эторикоксиб может привести к задержке жидкости, отекам, а соответственно, и к артериальной гипертензии у некоторых пациентов.
Взаимодействие между эторикоксибом и ацетилсалициловой кислотой (АСК) исследовали по агрегации тромбоцитов ex vivo и образованию TXB2 в сыворотке крови при действии 1,6 мМ арахидоновой кислоты и 1 мкг/мл коллагена. В двойном слепом рандомизированном плацебоконтролируемом исследовании с параллельными группами здоровые добровольцы получали плацебо (n = 14) или эторикоксиб в дозе 120 мг/сут (n = 13) в течение 12 дней. С 1-го по 5-й день эторикоксиб или плацебо назначали без АСК. С 6-го по 12-й день все участники принимали АСК в низкой дозе (81 мг 1 раз в сутки). В анализах сыворотки, взятых на 6-й день исследования, не обнаружено влияния эторикоксиба на агрегацию тромбоцитов. На 12-й день также не обнаружено влияния эторикоксиба на способность АСК 81 мг/сут ингибировать агрегацию тромбоцитов.
Высокая безопасность эторикоксиба прослежена в программе MEDAL, основанной на изучении 34 000 пациентов с РА и ОА. Эта программа была первой клинической программой, созданной для сравнения безопасности в отношении тромботических сердечно-сосудистых событий селективного ингибитора ЦОГ-2 (эторикоксиба) и традиционного НПВП (диклофенака). Пациенты имели широкий спектр сердечно-сосудистого риска и получали НПВП в течение 3,5 лет (в среднем 18 мес.). При лечении эторикоксибом и диклофенаком была показана сравнимая частота тромботических событий. В анализе популяции «по протоколу» частота рассмотренных Экспертным комитетом и подтвержденных тромботических сердечно-сосудистых событий (первичная конечная точка) для эторикоксиба была такой же, как для диклофенака [19, 20]. Отношение рисков для эторикоксиба по сравнению с диклофенаком составляло 0,95 (95% ДИ 0,81–1,11). Верхняя граница, равная 1,11, была ниже, чем определенная заранее граница, равная 1,3.
В этом же исследовании оценивалась гастроинтестинальная токсичность. Частота подтвержденных клинических событий со стороны верхних отделов ЖКТ в группе эторикоксиба была значительно ниже (0,67 событий на 100 пациенто-лет), чем в группе диклофенака (0,97 событий на 100 пациенто-лет) с отношением рисков, равным 0,69 (95% ДИ 0,57–0,83) (р = 0,0001). Эторикоксиб в дозах 60 и 90 мг показал лучшую ЖКТ-переносимость и безопасность, определяемую по частоте серьезных НЯ (перфораций, язв и кровотечений), по сравнению с диклофенаком в дозе 150 мг. В то же время частота отмены терапии из-за желудочно-кишечных и печеночных событий была значительно ниже при лечении эторикоксибом в дозах 60 и 90 мг, чем при лечении диклофенаком в дозе 150 мг.
Таким образом, эторикоксиб (Аркоксиа) является селективным ингибитором ЦОГ-2. Он рекомендуется для лечения остеоартроза, ревматоидного артрита, анкилозирующего спондилита и других спондилоартритов/спондилоартропатий, болей в нижней части спины, острого приступа подагры и других заболеваний, сопровождающихся болью и/или воспалением. Ежедневная доза препарата при остеоартрозе составляет 60 мг, при ревматоидном артрите и анкилозирующем спондилите – 90 мг, а при остром подагрическом артрите – 120 мг. Дозы выше рекомендуемых применять не следует, так как они обычно не приводят к повышению эффективности препарата.
Противопоказаниями к приему эторикоксиба являются гиперчувствительность к препарату, активная пептическая язва или гастроинтестинальное кровотечение, печеночная недостаточность (более 9 баллов по шкале Чайлд – Пью), почечная недостаточность с клиренсом креатинина менее 30 мл/мин, воспалительные заболевания кишечника, тяжелая застойная сердечная недостаточность. Его не следует назначать пациентам с бронхообструктивным синдромом, острым ринитом, полипозом носа, ангионевротическим отеком или уртикарной сыпью, развившимися после приема ацетилсалициловой кислоты или других НПВП. Применения этого препарата следует избегать при беременности и лактации, а также у детей и подростков до 16 лет.
Приведенные данные позволяют дать высокую оценку эторикоксибу (препарат Аркоксиа) при ревматических заболеваниях, что основывается на результатах многочисленных тщательно контролированных клинических исследований, проведенных с участием большого числа пациентов. Доказаны высокая эффективность и хорошая переносимость препарата при основных воспалительных и дегенеративных заболеваниях суставов и позвоночника. Позитивными особенностями данного селективного ингибитора ЦОГ-2 являются удобство применения (1 раз в сутки) и возможность его сочетания с низкими дозами аспирина, что повышает комплаентность терапии. Его анальгезирующий и антивоспалительный эффекты сравнимы с аналогичными эффектами при применении напроксена или ибупрофена, а также высоких доз диклофенака – препарата, являющегося «золотым стандартом» НПВП. Имеющиеся данные убедительно доказывают, что эторикоксиб является альтернативой в лечении многих воспалительных и дегенеративных ревматических заболеваний и существенно расширяет возможности врача в отношении индивидуального подбора НПВП. Этот препарат показан пациентам с риском возникновения желудочно-кишечных и кардиоваскулярных нежелательных явлений.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.