Применение эверолимуса при высокодифференцированных нейроэндокринных опухолях. Опыт отделения химиотерапии ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН
- Аннотация
- Статья
- Ссылки




Введение
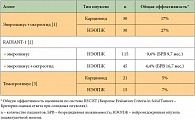
С появлением таргетных препаратов для лечения злокачественных опухолей начались исследования этой группы лекарств и у пациентов с нейроэндокринными опухолями (НЭО). На сегодняшний день в Российской Федерации и в мире зарегистрировано два таргетных препарата для лечения НЭО – Сутент (сунитиниб) и Афинитор (эверолимус). Эти препараты действуют на различные мишени в нейроэндокринных опухолевых клетках. Известно, что ключевую роль в поддержании жизнеспособности нейроэндокринных клеток играют рецепторы с тирозинкиназной активностью VEGFR (vascular endothelial growth factor receptor – рецептор фактора роста эндотелия сосудов) и PDGFR (platelet derived growth factor receptor – рецептор тромбоцитарного фактора роста) (мишень для сунитиниба), а также внутриклеточный протеинкиназный комплекс mTOR (мишень для эверолимуса). В клинической практике сунитиниб применяется также для лечения гастроинтестинальных стромальных опухолей при резистентности к иматинибу и при почечно-клеточном раке. Эверолимус помимо НЭО применяется для лечения почечно-клеточного рака и рака молочной железы. Протеинкиназный комплекс mTOR выполняет функцию центрального регулятора в опухолевой клетке, контролирующего метаболизм, пролиферацию и опухолевый ангиогенез. Важность этого комплекса в нейроэндокринных опухолевых клетках как противоопухолевой мишени была доказана в клинических исследованиях II фазы, сведения о которых представлены в таблице 1 [1–3].
Наиболее показательным среди указанных исследований было рандомизированное исследование RADIANT-1 (RAD001 (Everolimus) in Advanced Neuroendocrine Tumors – Эверолимус при поздних стадиях нейроэндокринных опухолей). Добавление эверолимуса к октреотиду лар (Сандостатин Лар) способствовало улучшению как непосредственной эффективности (контроль роста опухоли составил 84,4% в группе комбинированной терапии и 77% в группе монотерапии эверолимусом), так и отдаленных результатов лечения (безрецидивная выживаемость составила 16,7 и 9,7 месяца соответственно).
Изучение эверолимуса при нейроэндокринных опухолях было продолжено в рамках исследования III фазы. В рандомизированном исследовании RADIANT-2 была показана эффективность эверолимуса в комбинации с октреотидом депо в сравнении с монотерапией октреотидом депо у больных с высокодифференцированными нейроэндокринными опухолями различных локализаций. Наблюдалось снижение риска прогрессирования заболевания на 23% в пользу эверолимуса (отношение рисков (ОР) 0,77; p = 0,026) [4]. Результаты анализа выживаемости без прогрессирования практически достигали границы статистической значимости с уровнем p = 0,0246 (границы статистической значимости не были достигнуты, предположительно, вследствие недостаточного количества событий и последующей утраты статистической мощности). На фоне терапии эверолимусом медиана продолжительности жизни без прогрессирования увеличилась на 5,1 месяца – с 11,3 месяца у пациентов, получавших плацебо в комбинации с октреотидом лар, до 16,4 месяца у пациентов, получавших эверолимус в комбинации с октреотидом лар.
После того как были получены результаты применения эверолимуса в комбинации с октреотидом, эверолимус был изучен при НЭО в качестве монотерапии в сравнении с плацебо. В исследовании, названном RADIANT-3, было показано статистически достоверное преимущество эверолимуса в сравнении с плацебо в отношении безрецидивной выживаемости и объективных эффектов у больных нейроэндокринными опухолями поджелудочной железы. Медиана безрецидивной выживаемости при лечении эверолимусом более чем в два раза превышала таковую при терапии плацебо – 11,4 месяца против 5,4 месяца [5].
В России не было опыта применения этого нового препарата в лечении НЭО. В отделении химиотерапии ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН впервые получены результаты применения эверолимуса в группе больных с НЭО, изучена непосредственная эффективность, отдаленные результаты и переносимость лечения эверолимусом.
Материалы и методы
Лечение эверолимусом в дозе 10 мг в день внутрь получал 21 больной с высокодифференцированными НЭО различных локализаций. В случае редукции дозы пациенты принимали эверолимус по 10 мг через день. По непосредственной эффективности, отдаленным результатам и токсичности оценены все больные. Средний возраст пациентов составил 53 года (25–71). Из 21 пациента было 16 женщин и 5 мужчин.
Общее состояние всех пациентов по шкале ECOG (Eastern Cooperative Oncology Group) соответствовало 1 баллу. У большинства больных первичная опухоль локализовалась в поджелудочной железе (табл. 2).
Большинство первичных опухолей – 12 (57%) – в соответствии с эмбриологической классификацией нейроэндокринных опухолей исходили из передних отделов первичной кишки (англ. foregut) (табл. 3).
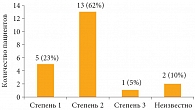
У большинства больных – 18 (86%) – были высокодифференцированные НЭО (степень дифференцировки 1 и 2) (рис. 1).
Отдаленные метастазы чаще всего локализовались в печени – у 18 больных (86%) (табл. 4).
Операция по удалению первичной опухоли выполнена у 9 пациентов (43%). Предшествующая химиотерапия преимущественно включала схемы XelOx (капецитабин и оксалиплатин), EP (цисплатин и этопозид), различные комбинации на основе аранозы, темодала, паклитаксела и фторпиримидинов. Девять пациентов получили не менее трех линий предшествующей химиотерапии, другие двенадцать пациентов ранее получили 1–2 линии химиотерапии или биотерапию аналогами соматостатина и интерфероном-альфа.
Результаты
Все больные были оценены по непосредственной эффективности. У 1 больного зарегистрирован частичный эффект (5%), у 14 больных (67%) отмечена стабилизация болезни, у 6 (28%) – прогрессирование, при том что обследование проводилось каждые 2 месяца.
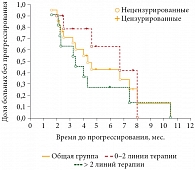
Медиана безрецидивной выживаемости в общей группе составила 4,3 месяца, в группе пациентов, ранее получивших 0–2 линии терапии, – 6,9 месяца и в группе пациентов, получивших более 2 линий химиотерапии, – 3,4 месяца (рис. 2).
Различие в безрецидивной выживаемости между группами пациентов, получивших 0–2 и более 2 линий терапии, оказалось статистически не значимым, вероятно, по причине малой выборки (р = 0,19).
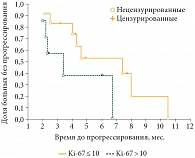
Безрецидивная выживаемость была также оценена в группе пациентов с опухолью GRADE 2 c Ki-67 ≤ 10 и > 10. Медиана безрецидивной выживаемости составила 6,9 месяца в группе с Ki-67 ≤ 10 и 2,7 месяца – в группе с Ki-67 > 10. Различия оказались статистически не значимыми (р = 0,07) (рис. 3).
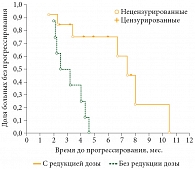
Безрецидивная выживаемость была проанализирована в зависимости от выраженности побочных эффектов. Этот параметр оценивали в группе пациентов, которым потребовалась редукция дозы, и пациентов, принимавших препарат в полной дозе без значимой токсичности. Медиана безрецидивной выживаемости в группе пациентов с редукцией дозы составила 7,17 месяца, а в группе пациентов без редукции – 2,85 месяца, причем различия оказались статистически достоверными (р = 0,007) (рис. 4).
Токсичность
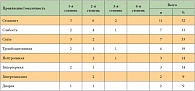
Наиболее частым осложнением терапии эверолимусом вне зависимости от степени выраженности стал стоматит – зарегистрирован у 11 больных. Следующими по частоте проявлениями были слабость и сыпь – у 7 больных (табл. 5).
Другие клинически значимые осложнения у отдельных больных включали пневмонию, носовое кровотечение, маточное кровотечение, боли в животе, гипогликемию, артериальную гипертонию, нестабильную стенокардию, частые ОРВИ, артралгии, периферические отеки.
Редукция дозы потребовалась у половины больных – 11 человек, причем наиболее часто редукция была связана со стоматитом – у 4 больных. Другие случаи редукции дозы эверолимуса были связаны с различными токсическими проявлениями, которые носили единичный характер и представлены в таблице 6.
После редукции дозы эверолимуса большинство больных переносили прием препарата без осложнений, отмечались лишь незначительные преходящие побочные эффекты в виде слабости и стоматита. Лишь у одного больного с инсулиномой поджелудочной железы, получавшего эверолимус 5 мг через день внутрь, после 18 дней приема развились выраженные периферические отеки 3-й степени, что послужило причиной полной отмены препарата. Однако следует отметить, что у этого больного были признаки печеночной недостаточности на фоне метастатического поражения печени и снижения белковосинтетической функции, сопровождающейся гипоальбуминемией.
Выводы
Эверолимус продемонстрировал достаточную эффективность в неблагоприятной группе больных с нейроэндокринными опухолями – бóльшая часть больных ранее получала многократные курсы химиотерапии и биотерапии. Предварительные данные свидетельствуют о том, что эверолимус предпочтительнее назначать на первых этапах лечения НЭО. У больных, получивших несколько линий химиотерапии и биотерапии, эффективность эверолимуса снижается. Токсические проявления адекватно корректировались редукцией дозы препарата при сохранении его эффективности. Клинически значимые токсические проявления, которые приводили к редукции дозы препарата, являлись предиктором эффективности препарата, так как медиана безрецидивной выживаемости у таких больных более чем в два раза превышала таковую у больных, получавших лечение без значимой токсичности, при этом различия оказались статистически достоверными. Планируется дальнейший набор пациентов для более точной оценки эффективности и переносимости эверолимуса у больных НЭО.
снижение эффективности отмечено у ранее леченных пациентов. Токсические проявления адекватно корректировались редукцией дозы препарата при сохранении его эффективности. " id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.