количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Практика
Принципы рациональной антибиотикотерапии у больных в урологическом стационаре
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №5
- Аннотация
- Статья
- Ссылки
При лечении пациентов с инфекцией мочевых путей немаловажную роль играет рациональное назначение антибиотиков. Необходимо учитывать существующие данные, которые указывают на связь неадекватной антибиотикотерапии с увеличением смертности из-за роста резистентности микроорганизмов.
Во всем мире отмечается рост резистентности возбудителей инфекции мочевых путей, в том числе за счет продуцирующих штаммов бета-лактамаз расширенного спектра. Уникальным препаратом с точки зрения высокой эффективности по отношению к Enterobacteriaceae (включая продуцентов бета-лактамаз расширенного спектра) является эртапенем (Инванз).
При лечении пациентов с инфекцией мочевых путей немаловажную роль играет рациональное назначение антибиотиков. Необходимо учитывать существующие данные, которые указывают на связь неадекватной антибиотикотерапии с увеличением смертности из-за роста резистентности микроорганизмов.
Во всем мире отмечается рост резистентности возбудителей инфекции мочевых путей, в том числе за счет продуцирующих штаммов бета-лактамаз расширенного спектра. Уникальным препаратом с точки зрения высокой эффективности по отношению к Enterobacteriaceae (включая продуцентов бета-лактамаз расширенного спектра) является эртапенем (Инванз).
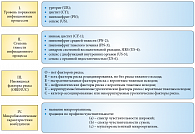
Рис. 1. Международная классификация ИМП
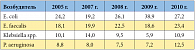
Таблица 1. Структура возбудителей ИМП в клинике урологии им. Р.М. Фронштейна Первого МГМУ им. И.М. Сеченова (2005–2010 гг.), %
Оптимальное лечение больного с инфекцией мочевых путей (ИМП), по нашему мнению, складывается из трех основных составляющих: правильной постановки диагноза, коррекции осложняющих факторов и собственно рациональной антибиотикотерапии.
Международный консультативный совет по урологическим заболеваниям (ISUD) разработал новую классификацию ИМП, которая позволяет в значительной степени индивидуализировать диагноз. Эта классификация была впервые опубликована в монографии Urogenital infections в 2010 г. [1], а затем – в клинических рекомендациях Европейской ассоциации урологов 2011 г. [2], которые находятся в открытом доступе на сайте www.uroweb.org. Новая классификация ИМП при постановке диагноза позволяет учитывать несколько ключевых факторов: уровень поражения инфекционным процессом, cтепень тяжести инфекционного процесса, имеющиеся факторы риска и микробиологические характеристики возбудителя (рис. 1). Таким образом, для больного в урологическом стационаре, в соответствии с новой классификацией, типичными представляются следующие диагнозы:
- PN-3U: Klebsiella pneumoniae (b) – пиелонефрит тяжелого течения с корригируемыми урологическими осложняющими факторами (например, обструкция камнем), вызванный Klebsiella pneumoniae с умеренной резистентностью к антибактериальным препаратам;
- US-5C: Enterococcus sp. (a) – тяжелый сепсис, вызванный Enterococcus sp. с широким спектром чувствительности, у больного с постоянным мочевым катетером.
По мнению экспертов – создателей классификации, ее использование в клинической практике дает возможность в большей степени индивидуализировать диагноз ИМП. В то же время клинические исследования, в которых группы пациентов будут формировать на основании новой классификации, позволят со временем более точно индивидуализировать диагностику и терапию ИМП.
Коррекция осложняющих факторов – краеугольный камень успешного лечения больных с ИМП. Так, при нарушенном оттоке мочи у больного с пиелонефритом обязательным является срочное дренирование верхних мочевых путей, при формировании абсцесса – его дренирование пункционным или открытым способом, при декомпенсированном сахарном диабете – нормализация уровня глюкозы крови и т.д. Подчеркнем, что без подобного «купирования» осложняющих факторов значимо снижается вероятность выздоровления/выживания пациента, а также повышается риск неполной эрадикации возбудителя, что, в свою очередь, ведет к рецидивированию инфекционного процесса и появлению резистентных штаммов.
Рациональная антибиотикотерапия является в нашем представлении комплексным понятием. Оптимальное лечение антибиотиками, в отличие от лечения препаратами большинства других групп, должно не только обеспечивать выздоровление/выживание пациента, но и как минимум не повы-шать вероятности возникновения и распространения резистентных микроорганизмов. У госпитализированных больных возбудители ИМП можно условно разделить на 2 большие группы: госпитальные и негоспитальные (амбулаторные) микроорганизмы. Как известно, характеристики этих возбудителей имеют существенные отличия. Приведем результаты мониторинга госпитальных возбудителей ИМП и их резистентности к антимикробным препаратам в клинике урологии им. Р.М. Фронштейна Первого МГМУ им. И.М. Сеченова. Ведущими возбудителями ИМП в клинике урологии в 2010 г. были Enterobacteriaceae (44%), Enterococcus (27,2%), неферментирующие грамотрицательные бактерии (13,6%), Staphylococcus (6,5%), грибы (7,1%) и прочие (1,6%). Динамика ведущих возбудителей ИМП в клинике урологии в процентном отношении представлена в таблице 1.
С 2009 по 2010 г. отмечено увеличение доли Enterobacteriaceae – продуцентов бета-лактамаз расширенного спектра (БЛРС) – с 23,7% до 44,4%. При этом в 2010 г. среди E. coli продуценты БЛРС выявлены у 34%, а среди Klebsiella spp. – у 65% микроорганизмов. В связи с высокой распространенностью БЛРС-продуцентов уровень резистентности всех Enterobacteriaceae - уропатогенов к цефалоспоринам составил 44,2–63,2%, а к фторхинолонам – 50–58,3%. Приемлемый уровень устойчивости Enterobacteriaceae отмечен к имипенему (1,3%) и фосфомицину (6,4%), пограничный – к амикацину (11,7%). Отметим, что у Enterobacteriaceae – продуцентов БЛРС уровень устойчивости к фторхинолонам достигал 96,9%. С 2005 по 2010 г. также отмечен рост высокорезистентной P. aeruginosa: устойчивость к карбапенемам, и в частности к меропенему, возросла с 0 до 38,9% и сохранялась высокой по отношению практически ко всем классам антибактериальных препаратов, включая фторхинолоны (около 70%), аминогликозиды (36–57%) и цефалоспорины IIIb и IV поколения (26,3%). Enterococcus в 2010 г. продемонстрировали отсутствие устойчивости к ванкомицину, пограничные уровни резистентности к ампициллину (14,6%) и нитрофурантоину (9,1%), при высокой устойчивости к фторхинолонам (63–65,2%) и рифампицину (65,2%). Таким образом, мониторинг госпитальных возбудителей ИМП в нашей клинике выявил:
- увеличение доли P. aeruginosa (с 8,8 до 12,5%);
- высокий процент Enterobacteriaceae с БЛРС (около 50%) с устойчивостью к цефалоспоринам;
- высокий процент Enterobacteriaceae с устойчивостью к фторхинолонам (более 50%);
- высокий процент устойчивости к фторхинолонам у Enterobacteriaceae – продуцентов БЛРС (около 90%);
- высокий процент P. aeruginosa, устойчивой к фторхинолонам (около 70%);
- рост устойчивости P. аeruginosa к карбапенемам (с 0 до 40%).
Характеристики амбулаторных возбудителей ИМП также представляют интерес для врача урологического стационара, поскольку вызванные ими инфекции тяжелого и осложненного течения в подавляющем большинстве случаев требуют обязательной госпитализации, а порой и хирургического лечения. К сожалению, в отношении амбулаторных возбудителей ИМП в московском регионе в настоящее время имеются только единичные современные исследования.
Наиболее интересным и показательным представляется исследование В.В. Рафальского, И.М. Рохликова и Л.С. Страчунского, проведенное в 2005 г., которое показало, что основным возбудителем амбулаторных инфекций в Москве по-прежнему остается E. coli (в 72,5% случаев) [3]. При этом E. сoli являлась возбудителем неосложненных инфекций у 80,9% больных, а при наличии осложняющих факторов (МКБ, сахарный диабет) E. сoli идентифицирована только у 53% пациентов. При осложненных инфекциях статистически значимо чаще выявлялись P. aeruginosa (4,5% vs 0%) и E. faecalis (9,1% vs 4,2%). Неосложненные инфекции нижних и верхних мочевых путей, вызванные E. сoli, характеризовались низкой резистентностью к фторхинолонам (6,3%), цефотаксиму (0%) и амоксициллину/клавуланату (6,3%). Немаловажно, что в ранее проведенных исследованиях (UTIAP 1 и UTIAP 2) устойчивость E. coli к фторхинолонам и ингибиторзащищенному амоксициллину не превышала 3%. У E. coli, вызвавшей ИМП с сопутствующими осложняющими факторами, устойчивость к антибактериальным препаратам была существенно выше и составила 16,3% для ципро-/норфлоксацина, 2,3% для цефотаксима и 14% для амоксициллина/клавуланата.
В настоящее время стала актуальной проблема распространения внебольничных БЛРС-продуцирующих штаммов E. coli (типа CTX-M). Важно осознавать, что обычные схемы лечения неосложненных ИМП оказываются неэффективными в случае, если возбудителем инфекции является БЛРС-продуцирующий микроорганизм, а это существенно повышает риски тяжелого и/или осложненного течения заболевания и госпитализации. Так, по данным C. Qi и соавт., с 2003 по 2008 г. в Чикаго отмечено увеличение доли БЛРС-продуцирующей E. сoli у амбулаторных урологических пациентов с 0,21% до 2,99%, то есть более чем на порядок [4]. В то же время данные опубликованного в 2007 г. метаанализа свидетельствуют о том, что относительный риск смертности у больных c бактериемией, вызванной БЛРС-продуцирующими штаммами Enterobacteriaceae (по отношению к бактериемии не-БЛРС-продуцентами), составляет 1,85, то есть, другими словами, умирают от БЛРС-продуцирующего возбудителя почти в 2 раза чаще [5].
В ряде исследований были установлены факторы риска инфицирования БЛРС-продуцентами. Так, D.L. Paterson и соавт. обнаружили корреляцию с предыдущим введением оксиимино-?-лактам содержащих антибиотиков (например, цефуроксима, цефотаксима, цефтриаксона, цефтазидима, азтреонама), связанным с бактериемией БЛРС-продуцентами [6]. По данным J. Rodriguez-Bano и соавт., вероятность инфицирования БЛРС-продуцентами выше у больных, ранее находившихся в лечебных учреждениях, подвергавшихся катетеризации, введению фторхинолонов или бета-лактамных антибиотиков, а также у пациентов с сахарным диабетом, с терминальными или тяжелыми сопутствующими заболеваниями [7].
Дальнейшие исследования J. Rodriguez-Bano и соавт. показали, что среди пациентов с БЛРС-продуцирующими возбудителями ИМП, получавших эмпирическую терапию карбапенемами, смертность была ниже, чем среди пациентов, исходно получавших цефалоспорины и фторхинолоны [8]. В настоящее время карбапенемы обладают почти 100%-ной эффективностью в отношении продуцентов БЛРС, что уже сейчас привело к широкому применению в стационарах различных препаратов этой группы у больных с ИМП. В то же время нельзя не отметить существенного роста распространенности в стационарах (по нашим данным, до 40%) P. аeruginosa с устойчивостью к ранее активным по отношению к ней карбапенемам (имипенему, меропенему и дорипенему). В двухлетнем плацебоконтролируемом исследовании пациентов (n = 2613), поступавших в 3 отделения ОРИТ Парижского госпиталя, E. Paramythiotou и соавт. установили, что множественная лекарственная устойчивость P. aeruginosa связана с чрезмерным использованием антибиотиков с антисинегнойной активностью, в частности ципрофлоксацина, имипенема, меропенема и др. [9]. Авторами был сделан вывод, что в случае необходимости терапии антибиотиками, активными в отношении грамотрицательных бактерий, должны использоваться препараты с ограниченной антисинегнойной активностью; это снизит вероятность появления P. aeruginosa со множественной лекарственной устойчивостью.
Уникальным препаратом с точки зрения высокой эффективности по отношению к Enterobacteriaceae (включая БЛРС-продуценты) и отсутствия при этом антисинегнойной активности является эртапенем (Инванз). D.A. Goff и J.E. Mangino в ходе своих исследований убедительно продемонстрировали отсутствие роста резистентности P. аeruginosa к имипенему на фоне рутинного использования в стационаре эртапенема на протяжении 5 лет [10].
Мы проанализировали результаты нашего первого опыта применения эртапенема (Инванза) у 10 пациенток (возраст 19–44 года) с острым необструктивным пиелонефритом тяжелого течения, имеющих факторы риска наличия БЛРС-продуцента. Всем пациенткам ранее проводилась антибиотикотерапия (в частности фторхинолонами), продолжительность лихорадки на момент госпитализации составляла от 2 до 7 дней. По данным комплексного обследования, включавшего УЗИ и мультиспиральную компьютерную томографию, у пациенток отсутствовали известные осложняющие факторы (мочекаменная болезнь, нарушенный отток мочи из почки, сахарный диабет, тяжелые сопутствующие заболевания и др.) и не было в анамнезе операций или манипуляций на мочевых путях. Все пациентки при поступлении и до назначения эртапенема (Инванза) сдавали мочу на бактериологическое исследование. Инванз назначался эмпирически в дозировке 1 г 1 раз в сутки на срок до 7 дней. Анализ результатов бактериологического исследования показал, что у 9 пациенток возбудителем пиелонефрита была E. coli, у 1 – Klebsiella pneumoniae. У одной пациентки выявлена БЛРС-продуцирующая E. coli, резистентная как к цефалоспоринам, так и ко фторхинолонам. Все идентифицированные возбудители были чувствительны к эртапенему. Терапия эртапенемом была эффективна у всех пациенток как по клиническим, так и по микробиологическим критериям (эрадикация микроорганизма достигнута в 100% наблюдений). При лечении препаратом не было отмечено никаких нежелательных явлений.
Наш скромный клинический опыт применения препарата эртапенем (Инванз) оказался, тем не менее, весьма показательным. Именно благодаря эффективности препарата в отношении БЛРС-продуцирующей E. coli у одной из пациенток с неосложненным пиелонефритом тяжелого течения нам удалось быстро купировать воспалительный процесс в почке, не повышая при этом вероятность развития резистентности нашей госпитальной флоры к карбапенемам. Очевидно, что стандартная терапия фторхинолонами или цефалоспоринами (без учета факторов риска наличия БЛРС-продуцента) у данной пациентки была бы неэффективна и как минимум привела бы к несвоевременному назначению адекватного антибактериального препарата.
Принимая во внимание приведенные выше данные, при выборе эмпирической антибиотикотерапии больным с ИМП в стационаре чрезвычайно важно, во-первых, оценить риск наличия БЛРС-продуцентов, а во-вторых, оценить вероятность инфицирования P. аeruginosa. При отсутствии факторов риска (предыдущий контакт с лечебными учреждениями, ранее проводимая антибиотикотерапия, пожилой возраст, серьезные сопутствующие заболевания) препаратами выбора для стартовой эмпирической терапии являются:
- цефалоспорины 3-го поколения;
- фторхинолоны;
- комбинация цефалоспорина 2-го поколения с аминогликозидом (амикацином).
При наличии у больного факторов риска инфицирования БЛРС-продуцентами, таких как контакты с лечебными учреждениями без проведения инвазивных процедур (уход на дому, недавняя госпитализация), недавно проводившаяся антибиотикотерапия (в особенности фторхинолонами или цефалоспоринами), пожилой возраст или значимые сопутствующие заболевания (например, сахарный диабет), препаратом выбора является карбапенем без антисинегнойной активности – эртапенем (Инванз). При наличии у больного факторов риска инфицирования P. аeruginosa, Acinetobacter (длительная госпитализация или инвазивные урологические процедуры, операции в анамнезе, отсутствие эффекта от антибактериальной терапии, тяжелое состояние пациента, наличие дренажей или катетеров, операции и/или пребывание в ОРИТ) препаратами выбора для эмпирической терапии являются карбапенемы 2-й группы – имипенем/циластатин (Тиенам) или меропенем (Меронем).
Выводы
Во всем мире, включая Россию, отмечается рост резистентности возбудителей ИМП за счет:
- продуцентов БЛРС (включая внебольничные инфекции);
- бактерий, резистентных к фторхинолонам;
- P. aeruginosa, устойчивой к карбапенемам.
Представленные данные указывают на связь неадекватной антибиотикотерапии инфекций с увеличением смертности из-за роста резистентности микроорганизмов, что необходимо учитывать при выборе препарата для эмпирической терапии ИМП. Такой подход позволяет не только рассчитывать на позитивные результаты лечения, но и предотвратить дальнейший рост резистентности возбудителей ИМП.
1. Guidelines on Urogenital infections / Naber K.G., Schaeffer A.J., Heyns C. et al., eds. European Association of Urology, 2010.
2. Guidelines on Urological Infections / Grabe M., Bjerklund-Johansen T.E., Botto H. et al., eds. European Association of Urology, 2011.
3. Рафальский В.В., Рохликов И.М., Страчунский Л.С. Клинико-микробиологическая характеристика внебольничных инфекций мочевых путей в Москве // Урология. 2007. № 5. С. 18–23.
4. Qi C., Pilla V., Yu J.H., Reed K. Changing prevalence of Escherichia coli with CTX-M-type extended-spectrum beta-lactamases in outpatient urinary E. coli between 2003 and 2008 // Diagn. Microbiol. Infect. Dis. 2010. Vol. 67. № 1. P. 87–91.
5. Schwaber M.J., Carmeli Y.J. Mortality and delay in effective therapy associated with extended-spectrum beta-lactamase production in Enterobacteriaceae bacteraemia: a systematic review and meta-analysis // Antimicrob. Chemother. 2007. Vol. 60. № 5. P. 913–920.
6. Paterson D.L., Ko W.C., Von Gottberg A. et al. International prospective study of Klebsiella pneumoniae bacteremia: Implications of extended-spectrum beta-lactamase production in nosocomial infections // Ann. Intern. Med. 2004. Vol. 140. № 1. P. 26–32.
7. Rodriguez-Bano J., Navarro M.D., Romero L. et al. Clinical and molecular epidemiology of extended-spectrum beta-lactamase-producing Escherichia coli as a cause of nosocomial infection or colonization: implications for control // Clin. Infect. Dis. 2006. Vol. 42. № 1. P. 37–45.
8. Rodríguez-Baño J., Picón E., Gijón P. et al. Community-onset bacteremia due to extended-spectrum beta-lactamase-producing Escherichia coli: risk factors and prognosis // Clin. Infect. Dis. 2010. Vol. 50. № 1. P. 40–48.
9. Paramythiotou E., Lucet J.C., Timsit J.F. et al. Acquisition of multidrug-resistant Pseudomonas aeruginosa in patients in intensive care units: Role of antibiotics with antipseudomonal activity // Clin. Infect. Dis. 2004. Vol. 38. № 5. P. 670–677.
10. Goff D.A., Mangino J. Ertapenem: no effect on gram-negative susceptibilities to imipenem // J. Infect. 2008. Vol. 57. № 2. P. 123–127.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
При лечении пациентов с инфекцией мочевых путей немаловажную роль играет рациональное назначение антибиотиков. Необходимо учитывать существующие данные, которые указывают на связь неадекватной антибиотикотерапии с увеличением смертности из-за роста резистентности микроорганизмов.
Во всем мире отмечается рост резистентности возбудителей инфекции мочевых путей, в том числе за счет продуцирующих штаммов бета-лактамаз расширенного спектра. Уникальным препаратом с точки зрения высокой эффективности по отношению к Enterobacteriaceae (включая продуцентов бета-лактамаз расширенного спектра) является эртапенем (Инванз).
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
