Первичный билиарный холангит с нормальным уровнем щелочной фосфатазы: клинический случай и обзор литературы
- Аннотация
- Статья
- Ссылки
- English
Введение
Первичный билиарный холангит (ПБХ) – это хроническое, медленно прогрессирующее аутоиммунное заболевание печени, характеризующееся негнойным деструктивным холангитом с поражением междольковых и септальных желчных протоков, которое при естественном течении приводит к билиарному циррозу [1, 2].
Этиология ПБХ до сих пор неизвестна. Патогенез носит сложный многофакторный характер и обусловлен иммуноопосредованным взаимодействием генетических и эпигенетических факторов. Последние могут играть роль триггера (ведущее место занимают лекарственные препараты и инфекции) [3], под воздействием которого происходит нарушение иммунной толерантности и развитие аутоиммунной агрессии против эпителия желчных протоков с участием антимитохондриальных аутоантител (АМА), расположенных на внутренней мембране митохондрий холангиоцитов [4].
АМА связываются с апикальной мембраной, на поверхности которой находятся белки HLA II класса [5], после чего происходят активация и повреждение Т-лимфоцитов, стимуляция продукции цитокинов [6], которые вызывают деструкцию эпителия желчных протоков [7, 8]. Описаны случаи выявления АМА у пациентов с острой печеночной недостаточностью, аутоиммунным гепатитом (АИГ) [9] и лекарственным повреждением печени [10], а также с аутоиммунными состояниями, не связанными с патологическими изменениями в печени, – системная красная волчанка, синдром Шегрена, антифосфолипидный синдром [11, 12].
Также может встречаться транзиторное повышение АМА при бактериальных и вирусных инфекциях (сифилис, острый и хронический миокардит) [13, 14]. У здоровых людей АМА могут выявляться с частотой до 1% [15, 16]. Описано девять паттернов антиген/антитело от M1 до M9. При этом высокоспецифичными для ПБХ являются АМА-М2, АМА-М4, АМА-М8, АМА-М9 [17–19]. Частота выявления АМА-М2 в сыворотке крови у больных ПБХ достигает 95% [20].
Тестами первого порядка для определения АМА-М2 являются непрямая реакция иммунофлюоресценции (НРИФ) на срезах печени/почек/желудка крыс (мышей) и НРИФ-HEp-2 (паттерн АС-21). Тестами второго порядка (подтверждающие тесты) являются иммуноферментный анализ, иммуноблот в составе профиля печеночных антител (liverblot) [21].
Согласно действующим рекомендациям, диагноз ПБХ основывается на наличии двух из трех следующих критериев:
- наличие антимитохондриальных антител (АМА-М2) или специфических антинуклеарных антител (АНА) – антител к растворимому ядерному белку (sp100) и интегральному мембранному гликопротеину (gp210);
- повышенный уровень щелочной фосфатазы (ЩФ);
- гистологические признаки ПБХ – наличие негнойного деструктивного холангита [22, 23].
Большинство пациентов с ПБХ с типичными проявлениями заболевания имеют повышенный уровень IgM в сыворотке крови.
Классический клинический фенотип ПБХ: женщина средних лет с изменением в биохимических показателях крови в виде повышения уровня ЩФ и/или гамма-глутамилтранспептидазы (ГГТП) и положительными АМА-М2.
Однако помимо этого типичного представления в клиническом спектре заболевания описываются такие варианты ПБХ, как АМА-М2-негативный ПБХ, аутоиммунный перекрестный синдром – ПБХ с признаками АИГ. Отдельного внимания заслуживает «изолированная АМА-М2-позитивность» [24–26]. Это состояние, которое определяется выявлением АМА-М2 в сыворотке крови в диагностическом титре при отсутствии клинических и лабораторных признаков холестаза [23, 27].
Клиническое наблюдение
Пациентка К., 50 лет, поступила в отделение заболеваний печени Московского клинического научно-практического центра им. А.С. Логинова в декабре 2022 г. с жалобами на умеренную общую слабость, тяжесть в правом подреберье.
Из анамнеза известно, что в августе 2022 г. перенесла COVID-19, по поводу которого принимала азитромицин, Арбидол, парацетамол. Спустя месяц отметила появление общей слабости.
При лабораторном обследовании в сентябре 2022 г. обнаружено увеличение скорости оседания эритроцитов до 20 мм/ч, умеренное повышение маркеров цитолиза (аланинаминотрансфераза (АЛТ) – до пяти, аспартатаминотрансфераза (АСТ) – до четырех верхних границ нормы (ВГН)). Синдром холестаза отсутствовал (уровень билирубина и ЩФ – в норме). HBsAg, anti-HCV не обнаружены. При исследовании антинуклеарных антител методом НРИФ на препаратах клеток HEp-2 (АНФ на Нер2) выявлен цитоплазматический тип свечения в титре 1:2560, повышение титра антимитохондриальных антител до 1:1280.
Больная отрицала прием алкоголя и вирусные гепатиты в анамнезе. По месту жительства была проведена терапия адеметионином в/в в дозе 400 мг № 7 – без эффекта.
Объективно (при поступлении): состояние удовлетворительное. Кожные покровы и видимые слизистые физиологической окраски. Периферических отеков нет. Сознание ясное. Неврологический статус – без особенностей. В легких дыхание везикулярное, проводится во все отделы, хрипов нет. Частота дыхания – 14 в минуту. Тоны сердца приглушены, ритм правильный. Артериальное давление – 122/66 мм рт. ст., частота сердечных сокращений – 68 уд/мин. Язык влажный, у края обложен белым налетом. Живот мягкий, безболезненный. Печень у края реберной дуги. Селезенка не пальпируется.
В процессе стационарного обследования: в клиническом анализе крови значимых отклонений не выявлено. В биохимических показателях сохранялся минимальный синдром цитолиза (АЛТ – три ВГН, АСТ – 2,5 ВГН), минимальный синдром холестаза (ГГТП – 1,5 ВГН, ЩФ в рамках референсных значений), признаков гепатодепрессии не выявлено (альбумин, протромбин – без отклонений от нормы), в иммунограмме без отклонений (IgG, IgM – норма). Выявлено повышение АМА-М2 до 16,2 Ед/мл, АНФ на Нер2: 1/640 – тип свечения цитоплазматический (cyt, AC 21).
По данным УЗИ органов гепатобилиарной системы, признаков гепатоспленомегалии, билиарной и портальной гипертензии не выявлено.
На основании полученных результатов проводили дифференциальную диагностику между лекарственным повреждением печени, дебютом первичного билиарного холангита и аутоиммунного гепатита.
С учетом отягощенного лекарственного анамнеза и незначительного повышения ГГТП наиболее вероятным представлялся диагноз лекарственного повреждения печени или лекарственно-индуцированного аутоиммунного гепатита.
Наличие антимитохондриальных антител было рассмотрено как эпифеномен, но все же это не позволяло полностью исключить наличие ПБХ.
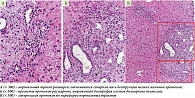
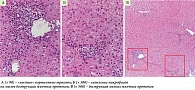
С целью морфологической верификации диагноза пациентке была проведена пункционная биопсия печени. При гистологическом исследовании биоптата: портальные тракты не расширены, некоторые из них слабо инфильтрированы лимфоцитами с небольшой примесью эозинофилов и макрофагов. В них наблюдается деструкция мелких желчных протоков. Между клетками эпителия протоков часто встречаются лимфоциты. Целостность пограничной пластинки не нарушена. В просветах расширенных синусоидов встречаются группы лимфоцитов. Мелкие внутридольковые смешанноклеточные инфильтраты без четких границ. Умеренно выраженная гиперплазия клеток ретикулоэндотелиальной системы. Индекс стеатоза – 0. Индекс Knodell – 4 (0–3–1–0). Заключение: первичный билиарный холангит на стадии негнойного деструктивного холангита. Очаговый портальный и лобулярный гепатит низкой степени активности (рис. 1 и 2).
Таким образом, на основании наличия АМА-М2 в высоком титре и данных морфологического исследования установлен клинический диагноз: «Первичный билиарный холангит, АМА-М2-позитивный вариант».
Назначен прием препарата урсодезоксихолевой кислоты (УДХК) из расчета 13 мг/кг в сутки на постоянной основе, профилактический прием витамина D и препаратов кальция.
На фоне проводимой терапии достигнуто купирование астенического синдрома, лабораторно через три месяца отмечена полная нормализация биохимических показателей в крови (АЛТ, АСТ, ГГТП, ЩФ – в пределах референсных значений). Было рекомендовано продолжить терапию УДХК в прежней дозе.
Обсуждение
Естественная история пациентов с изолированным повышением титра АМА остается плохо изученной, поскольку современные знания в этой области в значительной степени ограничены. Работы по изучению изолированного повышения АМА-М2 начаты в конце XX века, однако данные достаточно противоречивы, и на сегодняшний день нет доминирующей точки зрения о том, находятся ли пациенты с изолированным повышением АМА-М2 в группе риска по развитию ПБХ, может ли являться данное состояние ранней, начальной формой ПБХ или это лишь эпифеномен.
Ряд скрининговых обследований доноров крови и здоровых субъектов демонстрирует выявляемость АМА у 0,07–9,9% в зависимости от используемых технологий и диагностических пороговых значений, а также от типа, возрастной и гендерной структуры обследуемых групп [16, 28, 29].
Распространенность, клинические характеристики и исходы заболевания у пациентов с антимитохондриальными антителами, но без клинических признаков ПБХ в основном неизвестны. Так, в литературе имеются данные о существовании особого варианта течения ПБХ с «доклиническим дебютом» в виде длительного бессимптомного носительства АМА-М2 у пациентов с отсутствием клинических и лабораторных признаков холестаза, в то время как в ткани печени уже имеются гистологические изменения, характерные для ПБХ. В 1996 г. в Великобритании описали группу (n = 29) бессимптомных пациентов с нормальным уровнем печеночных ферментов, в которой гистологические признаки ПБХ были выявлены примерно в 40% случаев. Медиана наблюдения составила 18 лет. В течение этого периода у 76% пациентов развились симптомы ПБХ, а у 83% были устойчиво измененные биохимические показатели холестаза. Однако ни у одного из них не развилась портальная гипертензия или цирроз печени, и ни один пациент не умер от ПБХ. Авторы сообщают, что прогрессирование заболевания у этих больных было очень медленным [30].
Несмотря на то что это исследование было проведено более 20 лет назад в отдельном медицинском центре на ограниченной территории с участием малого количества пациентов, авторы данной работы пришли к выводу о том, что наличие АМА-М2 неизбежно связано с развитием ПБХ.
В 2004 г. было показано, что в Японии (на период публикации) насчитывалось около 336,5 тыс. АМА-положительных лиц в возрасте от 30 до 59 лет. Число пациентов с симптоматическим ПБХ составило 2459 человек. Авторы заключили, что частота ПБХ с лабораторными и клиническими признаками холестаза среди АМА-позитивных лиц составляет всего около 0,73% [31].
Описанные факты указывают на то, что AMA-позитивные лица без клинических проявлений ПБХ и лабораторных признаков холестаза представляют большую неоднородную группу, требующую дальнейшего тщательного изучения.
В 2017 г. проведено французское крупномасштабное проспективное исследование, в котором оценивали риск развития ПБХ у АМА-позитивных лиц без установленного диагноза. Были отобраны 229 АМА-позитивных пациентов с неустановленным диагнозом. Распространенность АМА-позитивных пациентов без признаков ПБХ составила 16,1 на 100 тыс. человек. При наблюдении 92 (40%) из 229 пациентов (период наблюдения после выявления АМА-М2 составил семь лет) развитие ПБХ было зарегистрировано только у 9 (10%) из 92 пациентов, а пятилетняя частота развития ПБХ составила 16%. Биопсия печени при обнаружении АМА была проведена только в 19% случаев (n = 29), и ни у одного из этих пациентов не было гистологических признаков, указывающих на ПБХ. Авторы указанного исследования сделали заключение о том, что нарушение иммунной толерантности к митохондриальным эпитопам, специфичным для ПБХ, не обязательно приводит к возникновению заболевания [32]. Эти данные подтверждают результаты недавнего одноцентрового австрийского исследования, которое показало, что только у шести из 59 пациентов с изолированным повышением АМА прогрессировал ПБХ в течение шести лет [33].
Вместе с тем в 2019 г. китайские исследователи показали, что у 80% пациентов с положительным тестом на AMA и нормальным уровнем ЩФ при морфологическом исследовании печени выявляются признаки ПБХ. Авторы также акцентируют внимание на более благоприятном течении и медленном прогрессировании ПБХ у этих пациентов [34]. Эти данные согласуются с результатами анализа базы данных когортного исследования по ПБХ, в котором был проведен поиск пациентов с положительными антителами АМА-М2, нормальным уровнем ЩФ, которым была проведена биопсия печени. Гистологические препараты были централизованно просмотрены экспертом – патологом печени, а сыворотки повторно протестированы на АМА-М2 и АНА. Сделано заключение о высокой (80%) доле АМА-позитивных пациентов с нормальным уровнем ЩФ при ПБХ. Авторы также отметили потенциальную роль ГГТП в качестве биомаркера у пациентов с ПБХ с нормальными исходными уровнями ЩФ. Отмечено также, что более высокие титры AMA, повышенный уровень IgM и ЩФ, приближающийся к верхней границе нормы, являлись предикторами гистологически подтвержденного ПБХ [35].
В 2007 г. в Греции проспективно проведен скрининг АМА в сыворотке 306 родственников первой степени родства, обследованы 350 пациентов с подтвержденным диагнозом ПБХ и 196 здоровых лиц, которые были сопоставимы по возрасту, полу, расе и месту жительства. Распространенность АМА у родственников первой степени родства пациентов с ПБХ и здоровых людей из контрольной группы составила 13,1 и 1% соответственно. Более высокая распространенность АМА была обнаружена у женщин (сестер (20,7%), матерей (15,1%) и дочерей (9,8%)), чем у мужчин (братьев (7,8%), отцов (3,7%) и сыновей (0%)). Идентификация и последующее тщательное динамическое наблюдение за родственниками первой степени родства пациентов с ПБХ позволили осуществить раннюю диагностику заболевания [36].
В целом среди общей когорты пациентов с положительными АМА, но нормальными показателями ЩФ и ГГТП без других признаков хронического повреждения печени в течение длительного периода наблюдения вероятность прогрессирования поражения печени невелика, и одной только АМА-позитивности недостаточно для диагностики ПБХ [37]. Следовательно, для таких пациентов рациональный подход состоит в регулярном биохимическом мониторинге и выполнении биопсии печени при появлении биохимических признаков холестаза (повышении ЩФ и/или ГГТП) для выявления ПБХ [27]. Для АМА-М2-позитивных пациентов, относящихся к группе риска (женщины среднего возраста или старше, родственники первой степени родства больных ПБХ), по мнению авторов статьи, выполнение биопсии печени для ранней диагностики целесообразно без периода длительного наблюдения.
Заключение
Подход к диагностике, лечению и наблюдению пациентов с выявляемым повышением АМА-М2, но без других лабораторных признаков или симптомов ПБХ является сложной задачей. В настоящее время нет достаточных клинических данных, чтобы рекомендовать профилактическое применение УДХК только для пациентов с АМА-позитивностью. Действующие рекомендации по диагностике ПБХ не охватывают все возможные варианты проявления ПБХ, что имеет большое значение для своевременного начала терапии и свидетельствует о необходимости коррекции.
Наше клиническое наблюдение демонстрирует диагностическое значение АМА у пациентов без холестаза, относящихся к группе повышенного риска развития ПБХ, и указывает на необходимость безотлагательного выполнения биопсии печени в подобных ситуациях.
Авторы заявляют об отсутствии конфликта интересов.
E.A. Sokolova, E.V. Vinnitskaya, PhD, S.N. Batskih, PhD, S.G. Khomeriki, PhD, T.Yu. Khaymenova, PhD
A.S. Loginov Moscow Clinical Scientific Center
Contact person: Elena V. Vinnitskaya, e.vinnitskaya@mknc.ru
Antimitochondrial autoantibodies of the M2 subclass (AMA-M2) in primary biliary cholangitis (PBCh) under conditions of cholestasis are considered as one of the main criteria for diagnosis that does not require morphological confirmation. However, the detection of AMA-M2 in asymptomatic patients causes ambiguity of interpretation. Along with the assumption that such patients may have preclinical stage of PBCh, there is an opinion about the "healthy carrier" of AMA-M2. The article presents the clinical observation of a patient with the high AMA-M2 titer without significant clinical manifestations, the normal level of alkaline phosphatase, with changes in liver tissue characteristic of PBCh, revealed by the results of histological examination. Clinical observation demonstrates the need for liver biopsy for early detection of PBCh in AMA-M2-positive patients belonging to the risk group.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.