Ранние ультразвуковые маркеры поздних преждевременных спонтанных родов
- Аннотация
- Статья
- Ссылки
- English
Цель – выявить ранние УЗ-маркеры ППСР.
Материал и методы. В одноцентровое наблюдательное исследование типа «случай – контроль» были включены 42 беременные, пришедшие на первичный прием в женскую консультацию № 12 Городской клинической больницы им. А.К. Ерамишанцева. Пациентки были поровну разделены на две группы: случай – ППСР (34,0–36,6 недели) и контроль – своевременные спонтанные роды (37,0–41,6 недели). Всем женщинам выполнены трансвагинальное ультразвуковое исследование ШМ (оценка структуры и цервикометрия) и цитологический скрининг. При статистическом анализе использованы U‑критерий Манна – Уитни, χ2 Пирсона/точный критерий Фишера (p < 0,05).
Результаты. Группы были сопоставимы по возрасту, индексу массы тела и паритету. Воспаление эндоцервикса, согласно результатам цитологического исследования микропрепарата ШМ, чаще встречалось у женщин с последующим ППСР: 61,9 против 19,0% (p = 0,011). УЗ‑признаки анатомо‑функциональных изменений ШМ регистрировались чаще при ППСР: 95,2 против 61,9% (p < 0,002). Наиболее значимыми были множественные кисты (≥ 5): 81,0 против 14,3% (p < 0,001), кисты эндоцервикса: 81,0 против 9,5% (p < 0,001), кисты перешейка: 66,7 против 0% (p < 0,001), кисты стромы: 81,0 против 23,8% (p < 0,001). Максимальный размер кист был выше при ППСР: 7,0 мм (Q1–Q3: 5,0–8,0) против 3,0 мм (0,0–5,0) (p < 0,001). Преждевременные роды в анамнезе встречались чаще при ППСР: 38,1 против 4,8% (p = 0,020). Показатели пренатального скрининга FMF/ASTRAIA высокого риска преждевременных родов (23,8 против 14,3%; p = 0,684) и длина ШМ в первом триместре (35,2 против 37,0 мм; p = 0,063; доля ≤ 30 мм: 38,1 против 19,0%; p = 0,306) статистически не различались.
Заключение. УЗ‑признаки хронического эндоцервицита и раннего ремоделирования ШМ в первом триместре, прежде всего множественные и крупные кисты с вовлечением эндоцервикса, перешейка и стромы, ассоциированы с риском ППСР. Их целенаправленный поиск при первом визите дополняет стандартный скрининг и может служить основой для патогенетически обоснованной тактики ведения беременности.
Цель – выявить ранние УЗ-маркеры ППСР.
Материал и методы. В одноцентровое наблюдательное исследование типа «случай – контроль» были включены 42 беременные, пришедшие на первичный прием в женскую консультацию № 12 Городской клинической больницы им. А.К. Ерамишанцева. Пациентки были поровну разделены на две группы: случай – ППСР (34,0–36,6 недели) и контроль – своевременные спонтанные роды (37,0–41,6 недели). Всем женщинам выполнены трансвагинальное ультразвуковое исследование ШМ (оценка структуры и цервикометрия) и цитологический скрининг. При статистическом анализе использованы U‑критерий Манна – Уитни, χ2 Пирсона/точный критерий Фишера (p < 0,05).
Результаты. Группы были сопоставимы по возрасту, индексу массы тела и паритету. Воспаление эндоцервикса, согласно результатам цитологического исследования микропрепарата ШМ, чаще встречалось у женщин с последующим ППСР: 61,9 против 19,0% (p = 0,011). УЗ‑признаки анатомо‑функциональных изменений ШМ регистрировались чаще при ППСР: 95,2 против 61,9% (p < 0,002). Наиболее значимыми были множественные кисты (≥ 5): 81,0 против 14,3% (p < 0,001), кисты эндоцервикса: 81,0 против 9,5% (p < 0,001), кисты перешейка: 66,7 против 0% (p < 0,001), кисты стромы: 81,0 против 23,8% (p < 0,001). Максимальный размер кист был выше при ППСР: 7,0 мм (Q1–Q3: 5,0–8,0) против 3,0 мм (0,0–5,0) (p < 0,001). Преждевременные роды в анамнезе встречались чаще при ППСР: 38,1 против 4,8% (p = 0,020). Показатели пренатального скрининга FMF/ASTRAIA высокого риска преждевременных родов (23,8 против 14,3%; p = 0,684) и длина ШМ в первом триместре (35,2 против 37,0 мм; p = 0,063; доля ≤ 30 мм: 38,1 против 19,0%; p = 0,306) статистически не различались.
Заключение. УЗ‑признаки хронического эндоцервицита и раннего ремоделирования ШМ в первом триместре, прежде всего множественные и крупные кисты с вовлечением эндоцервикса, перешейка и стромы, ассоциированы с риском ППСР. Их целенаправленный поиск при первом визите дополняет стандартный скрининг и может служить основой для патогенетически обоснованной тактики ведения беременности.




![Рис. 4. Схематичное изображение анатомо-функциональных изменений структуры шейки матки как УЗ-признаков хронического эндоцервицита [15]](/upload/resize_cache/iblock/791/rod2wdghlti4iciy84tchqjvx80471u3/195_350_1/Zyukina6.jpg)



Актуальность
Поздние преждевременные роды (34,0–36,6 недели гестации) представляют собой одну из наиболее актуальных проблем перинатологии, составляя до 70–80% всех случаев преждевременного родоразрешения, и ассоциированы с высоким риском пери- и постнатальных осложнений [1–6]. Ключевым фактором в патогенезе поздних преждевременных спонтанных родов (ППСР) является функциональная несостоятельность шейки матки (ШМ). Однако традиционные методы прогнозирования, например трансвагинальная цервикометрия во втором триместре, демонстрируют низкую чувствительность на ранних сроках гестации, что формирует диагностический пробел, когда превентивные мероприятия наиболее эффективны [7, 8]. В связи с этим научный фокус смещается в сторону поиска ранних, в том числе ультразвуковых, маркеров ремоделирования ШМ, идентифицируемых уже в первом триместре беременности [8, 9].
Особое внимание уделяется анатомо‑функциональной организации внутреннего зева ШМ – критической с точки зрения ее ремоделирования зоны, богатой гладкомышечными клетками, соединительной тканью и сосудистыми сплетениями, отвечающей за механическое удержание беременности [9]. Предполагается, что аномальное ремоделирование данного сегмента, включающее деградацию внеклеточного матрикса и локальное воспаление, инициируется задолго до клинических проявлений. Именно поэтому обнаружение признаков дестабилизации ремоделирования на ранних сроках гестации имеет стратегическое значение для прогнозирования ППСР.
Согласно опубликованным данным, ультразвуковое исследование (УЗИ) в первом триместре позволяет выявить морфологические маркеры, ассоциированные с последующим развитием ППСР: множественные эхонегативные (ретенционные) кисты желез ШМ; неоднородность эхоструктуры стромы; очаговые зоны гиперэхогенности, указывающие на структурные изменения соединительной ткани; признаки локального воспаления, включая утолщение слизистой оболочки, нечеткость и асимметрию контуров внутреннего зева [10–13].
Таким образом, УЗ-маркеры первого триместра рассматриваются в качестве не просто косвенных признаков, а ранних предикторов биологической нестабильности ШМ. Их своевременная диагностика делает возможным переход от тактики реактивного вмешательства (после выявления укорочения ШМ) к упреждающей, патогенетически обоснованной тактике ведения беременности.
Цель исследования, выполненного в формате «случай – контроль» (case – control), – выявить УЗ-маркеры ППСР в первом триместре беременности.
Материал и методы
Минимальный объем выборки был рассчитан исходя из клинически значимых различий в чувствительности существующего подхода (пренатального скрининга по FMF/ASTRAIA – 23%) и ожидаемой чувствительности предложенной методики прогнозирования (85%). При расчете использовались формулы Р. Лера и М. Бланда для относительных величин при уровне мощности исследования 90%. Согласно калькулятору Medstatistic.ru, минимальный размер выборки составил 15 женщин по формуле Лера, 9 женщин – по формуле Бланда.
В исследовании участвовали 42 женщины, которые были поровну (соотношение «случай – контроль» 1:1) разделены на две группы. Первую группу (случай) составили женщины с ППСР по завершении беременности, вторую (контроль) – женщины со своевременными спонтанными родами (ССР).
Критерии включения в первую группу:
- подтвержденный диагноз поздних преждевременных родов (ППР) на сроке 34,0–36,6 недели;
- спонтанный характер развития ППР (в результате развития регулярной родовой деятельности при целом плодном пузыре либо в результате преждевременного разрыва плодных оболочек (ПРПО) с последующим развитием спонтанной родовой деятельности).
Критерии включения во вторую группу:
- подтвержденный диагноз своевременных родов (ССР) на сроке 37,0–41,6 недели;
- спонтанный характер развития ССР (в результате развития регулярной родовой деятельности при целом плодном пузыре либо в результате ПРПО с последующим развитием спонтанной родовой деятельности).
Общими для двух групп критериями включения были:
- УЗ-признаки хронического эндоцервицита в первом триместре при первой явке в женскую консультацию (ЖК) № 12 Городской клинической больницы (ГКБ) им. А.К. Ерамишанцева;
- наличие снимков УЗИ ШМ в первом триместре при первой явке беременной в ЖК № 12 ГКБ им. А.К. Ерамишанцева;
- родоразрешение в родильном отделении № 1 ГБУЗ «ГКБ им. А.К. Ерамишанцева ДЗМ»;
- живорождение.
Критерии исключения:
- многоплодная беременность;
- индуцированные роды по медицинским показаниям со стороны матери и/или плода;
- состояние беременной и/или плода, требующее родоразрешения путем кесарева сечения до начала родовой деятельности (тяжелая преэклампсия, эклампсия, отказ женщины от родов через естественные родовые пути, дистресс-синдром плода);
- гестационный сахарный диабет;
- применение вспомогательных репродуктивных технологий;
- аномалии развития плода, несовместимые с жизнью;
- декомпенсация хронических экстрагенитальных заболеваний.
Выборка исследования была сплошной: включались только пациентки, удовлетворявшие всем критериям.
Статистический анализ выполнен в программной среде StatTech v. 4.8.1 (разработчик – ООО «Статтех», Россия). Количественные данные проверяли на нормальность распределения на основании критерия Шапиро – Уилка. В отсутствие нормального распределения количественные данные описывали с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные описывали с указанием абсолютных значений и процентных долей. Сравнение групп по количественному показателю, распределение которого отличалось от нормального, выполняли с помощью U-критерия Манна – Уитни, сравнение процентных долей при анализе четырехпольных таблиц сопряженности – с помощью критерия χ2 Пирсона (при значениях ожидаемого явления ≥ 10) или точного критерия Фишера (при значении ожидаемого явления < 10). Уровень значимости считали достоверным при р < 0,05.
Результаты
Женщины обеих групп были сопоставимы по возрасту и ростовесовым показателям (табл. 1). Медиана возраста в первой группе (ППСР) составила 32 года (Q1–Q3: 28–36), во второй (ССР) – 31 год (Q1–Q3: 27–35). Различия статистически незначимы (р = 0,638; U-критерий Манна – Уитни). Медианы индекса массы тела также были сопоставимы: 24,9 кг/м² (Q1–Q3: 22,5–27,0) в первой группе и 24,3 кг/м² (Q1–Q3: 23,0–26,0) – во второй (р = 0,641; U-критерий Манна – Уитни).
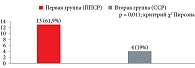
Распределение пациенток по паритету также показало отсутствие статистически значимых различий: первородящих в первой группе было 9 (42,9%), во второй – 11 (52,4%) (р = 0,565; точный критерий Фишера), повторнородящих – 12 (57,1%) и 10 (47,6%) соответственно (р = 0,564; точный критерий Фишера) (рис. 1).
Анализ репродуктивного анамнеза показал статистически значимые различия по ряду показателей. Преждевременные роды (ПР) в анамнезе выявлены у 8 (38,1%) женщин первой группы и у 1 (4,8%) женщины второй группы (р = 0,020). Оценка факторов, ассоциированных с отягощенным акушерско-гинекологическим анамнезом, показала достоверное преобладание этого показателя в первой группе – 81,0 против 19,0% (р < 0,001). Остальные параметры, такие как привычное невынашивание беременности, ПРПО и поздний самопроизвольный выкидыш, продемонстрировали различия, не достигшие статистической значимости (табл. 2).
Цитологическое исследование микропрепарата ШМ (рис. 2), выполненное при первой явке беременных в ЖК, показало статистически значимое преобладание признаков воспаления эндоцервикса (умеренного или выраженного) у женщин первой группы – 61,9%. Во второй группе этот показатель составил 19,0% (р = 0,011; критерий χ2 Пирсона).
При первой явке в ЖК всем 42 беременным было выполнено трансвагинальное УЗИ, в ходе которого оценивалась в том числе структура ШМ (рис. 3). Анатомо-функциональные изменения структуры ШМ выявлены у 20 (95,24%) женщин первой группы и у 13 (61,9%) – второй. Различия статистически значимы (р < 0,002; критерий χ2 Пирсона).
Схематически УЗ-признаки хронического эндоцервицита представлены на рис. 4 [14]. Аналогичным образом они выглядят на УЗ-снимке, сделанном при первой явке беременной в ЖК (рис. 5).
Данные УЗ-оценки структуры ШМ (табл. 3) продемонстрировали выраженные межгрупповые различия: разнообразие кист по их локализации и количеству фиксировалось значительно чаще у пациенток первой группы.
Так, множественные кисты (≥ 5) диагностированы у 81,0% пациенток первой и 14,3% пациенток второй группы (р < 0,001; критерий χ2 Пирсона), кисты эндоцервикса – у 81,0 и 9,5% (р < 0,001; критерий χ2 Пирсона), кисты стромы ШМ – у 81,0 и 23,8% (р < 0,001; критерий χ2 Пирсона), кисты перешейка – у 66,7 и 0% соответственно (р < 0,001; критерий χ2 Пирсона). Кисты субэктоцервикса диагностированы у 52,4% женщин первой группы и у 19,0% – второй (р = 0,052; критерий χ2 Пирсона). Различия по субэндоцервикальным кистам оказались статистически незначимы (р = 0,536; критерий χ2 Пирсона).
Максимальный размер выявленных кист, по данным УЗИ ШМ, также был статистически значимо выше в первой группе – 7,0 мм (Q1–Q3: 5,0–8,0). Во второй группе этот показатель составил 3,0 мм (Q1–Q3: 0,0–5,0) (р < 0,001; U-критерий Манна – Уитни).
Нормальная анатомо-функциональная структура ШМ по результатам УЗИ, выполненного при первой явке беременной в ЖК, представлена на рис. 6.
Пренатальный скрининг первого триместра прошли все 42 беременные. Высокий риск ПР на основании результатов пренатального скрининга первого триместра установлен у 5 (23,8%) беременных первой группы и у 3 (14,3%) – второй (р = 0,684; точный критерий Фишера).
Результаты цервикометрии показали, что длина сомкнутой части цервикального канала у пациенток первой группы варьировалась от 25,2 до 39,0 мм включительно (Me = 35,2; Q1–Q3: 30,0–37,0), у пациенток второй – от 28,0 до 42,0 мм включительно (Me = 37,0; Q1–Q3: 35,0–38,0). Различия между группами статистически незначимы (р = 0,063; критерий Манна – Уитни). При этом длина сомкнутой части цервикального канала ≤ 30,0 мм наблюдалась у 8 (38,1%) женщин первой группы и у 4 (19,0%) – второй (р = 0,306; точный критерий Фишера).
Исследуемые группы были также сопоставимы по способу родоразрешения: экстренная операция кесарева сечения выполнена 11 (52,4%) женщинам первой группы и 10 (47,6%) – второй (р = 0,084; критерий χ2 Пирсона).
Таким образом, у женщин первой группы достоверно чаще в анамнезе встречались ПР и ПРПО, отягощенный акушерско-гинекологический анамнез, воспалительные изменения ШМ и признаки ее ремоделирования. Указанные параметры могут рассматриваться как маркеры раннего прогнозирования ППСР.
Обсуждение
ППСР, составляя до 70–80% всех случаев преждевременного родоразрешения [1, 2], продолжают оставаться одной из наиболее сложных задач современной перинатологии. Согласно данным Всемирной организации здравоохранения (2023), даже при родоразрешении на сроке 34,0–36,6 недели у новорожденных сохраняется высокий риск респираторных расстройств, неврологических нарушений и осложненного постнатального развития [3–6]. В этой связи особую значимость приобретают методы раннего прогнозирования риска ППСР, направленные на предотвращение или минимизацию последствий.
Одним из ключевых патогенетических механизмов ППСР служит преждевременное ремоделирование ШМ, начинающееся задолго до клинически значимого укорочения [7–9]. Этот процесс многоэтапный и включает деструкцию внеклеточного матрикса (в частности, коллагена I и III), изменение пространственной ориентации коллагеновых волокон, пролиферативно-воспалительные изменения в эндоцервиксе, локальное нарушение эпителиально-стромального взаимодействия, приводящее к ослаблению барьерной функции [10–12].
Как показали исследования А. Cooley и соавт. (2023), уже на ранних сроках беременности под влиянием провоспалительных медиаторов, таких как интерлейкин 6 и фактор некроза опухоли альфа, происходят нарушения регенерации эпителия и деградация компонентов внеклеточного матрикса, критичные для стабильности ШМ [13]. При этом изменения в микросреде ШМ проявляются в виде эхографических феноменов: кист, неоднородности стромы, асимметрии контура внутреннего зева.
Особая роль отводится зоне внутреннего зева, богатой гладкомышечными клетками и структурным коллагеном, площадь которой начинает ремоделироваться раньше, чем появляются изменения длины цервикального канала [10–14]. Это подтверждается нашими результатами, согласно которым наиболее частыми эхографическими находками при ППСР были множественные кисты в области эндоцервикса, перешейка и стромы. Данные участки анатомически ближе всего к внутреннему зеву, что указывает на их ведущую роль в инициации ремоделирующих процессов.
Полученные нами результаты сопоставимы с данными Е. Hirayama и соавт. (2022), которые показали, что цервикальные новообразования, такие как кисты и полипы, сами по себе могут быть прогностически значимы: вероятность спонтанных ППСР и позднего выкидыша при их наличии возрастает в 2,4 раза [15]. Исследователи акцентируют внимание на локальной воспалительной активации и ее роли в перестройке тканей – факторе, который имел место в нашем исследовании у женщин с ППСР.
Особое внимание в обеих работах уделено морфологическим особенностям ШМ. В настоящем исследовании трансвагинальное УЗИ в первом триместре выявило признаки анатомо-функционального ремоделирования шейки у 95,2% женщин с ППСР и у 61,9% женщин с ССР. Множественные ретенционные кисты (≥ 5) диагностированы у 81% женщин с ППСР и у 14,3% с ССР. Установлены также значительные различия по локализации кист – в зоне эндоцервикса, перешейка и стромы ШМ. Однако в работе Е. Hirayama и соавт. [15] единственным морфологическим маркером служил полип ШМ, как правило визуализируемый при УЗИ или кольпоскопии, без анализа структуры и эхогенности стромы. При этом количественные и функциональные особенности образований (размер, плотность, количество) в исследовании не описаны. Несмотря на различный дизайн работ и размеры выборок, мы считаем, что наше исследование не только подтверждает, но и расширяет патогенетические механизмы преждевременного ремоделирования ШМ.
Наблюдаемая нами высокая частота признаков хронического эндоцервицита (выраженного воспаления эндоцервикса по цитологическим данным), множественных кистоподобных формирований и ремоделирования ШМ полностью вписывается в патогенетическую модель, представленную в современной литературе [13–15].
Кроме того, наши результаты подтверждают ограниченную прогностическую ценность изолированной цервикометрии в первом триместре [7, 8]. Несмотря на то что у женщин с ППСР длина ШМ не отличалась от таковой у женщин с ССР, признаки неспецифического морфофункционального ремоделирования в ходе УЗИ выявлялись значительно чаще, что подчеркивает необходимость интеграции качественной оценки структуры ШМ в рутинный скрининг.
Принципиально важно, что все ключевые УЗ-маркеры ППСР в нашем исследовании были выявлены уже в первом триместре (11,0–13,6 недели) в рамках стандартного скрининга, что, несомненно, открывает «диагностическое окно» для внедрения более персонифицированного подхода к ведению беременности на самых ранних этапах.
С практической точки зрения такие признаки, как множественные кисты, повышенная эхогенность и асимметрия стенок канала, могут рассматриваться как ранние морфологические индикаторы нарушения стабильности ШМ, особенно на фоне воспалительных изменений. Их наличие в совокупности с отягощенным анамнезом (ППР, ПРПО и поздний выкидыш) может служить основанием для проведения более тщательного мониторинга и превентивных мероприятий по снижению неблагоприятных акушерских и перинатальных исходов.
Заключение
Количественный и структурный подход, реализованный в настоящем исследовании, позволяет не только уточнить морфологические особенности ШМ в первом триместре беременности, но и выделить ряд прогностически значимых признаков, в частности характер и локализацию кистозных образований, их размеры, а также степень выраженности воспалительных изменений и структурную однородность цервикальной стромы. Совокупность указанных параметров при условии стандартизации методики их оценки может быть положена в основу усовершенствованной программы первичного скрининга с возможностью раннего выявления и маршрутизации пациенток группы риска ППСР. В перспективе это позволит снизить частоту неблагоприятных перинатальных исходов.
Авторы заявляют об отсутствии спонсорской поддержки и конфликта интересов.
Z.V. Zyukina, S.V. Apresyan, PhD, Prof., M.B. Khamoshina, PhD, Prof., I.N. Kostin, PhD, Prof., N.M. Startseva, PhD, Prof., L.B. Tamazova
Peoples' Friendship University of Russia
City Clinical Hospital named after A.K. Eramishantsev, Moscow
Contact person: Zoya V. Zyukina, zoya.zukina@yandex.ru
Actuality. Late spontaneous preterm birth (sPTB) at 34,0–36,6 weeks accounts for a substantial share of preterm deliveries and is associated with high rates of perinatal complications. One etiological pathway is premature cervical remodeling that often precedes clinical shortening. Traditional diagnostic tools, such as transvaginal cervicometry, show low sensitivity in the first trimester. This underscores the need to identify structural ultrasound markers of early cervical instability.
Purpose. To identify early ultrasound markers of late sPTB.
Material and methods. Single-center ‘case – control’ study; 42 pregnant women enrolled at their first visit to Antenatal Clinic No. 12, City Clinical Hospital named after A.K. Eramishantsev: 21 cases of late sPTB (34,0–36,6 weeks) and 21 controls with term spontaneous delivery (37,0–41,6 weeks). All participants underwent transvaginal cervical ultrasound (structural assessment and cervicometry) and cytological screening. Statistical analysis: Mann – Whitney U test, Pearson’s χ2 test/Fisher’s exact test (p < 0.05).
Results. The groups were comparable in age, BMI, and parity. Cytology-proven endocervical inflammation was more frequent among women who subsequently had late sPTB: 61.9 vs 19.0% (p = 0.011). Ultrasound signs of anatomical functional cervical alterations were more common in the sPTB group: 95.2 vs 61.9% (p < 0.002). The most informative findings were multiple cysts (≥ 5): 81.0 vs 14.3% (p < 0.001), endocervical cysts: 81.0 vs 9.5% (p < 0.001), isthmic cysts: 66.7 vs 0% (p < 0.001), stromal cysts: 81.0 vs 23.8% (p < 0.001). The maximum cyst diameter was greater in the sPTB group: 7.0 mm (Q1–Q3: 5.0–8.0) vs 3.0 mm (0.0–5.0) (p < 0.001). A history of preterm birth was also more frequent: 38.1 vs 4.8% (p = 0.020). The proportion classified as high risk for preterm birth by FMF/ASTRAIA first-trimester screening (23.8 vs 14.3%; p = 0.684) and first-trimester cervical length (35.2 vs 37.0 mm; p = 0.063; proportion ≤ 30 mm: 38.1 vs 19.0%; p = 0.306) did not differ significantly.
Conclusion. First-trimester ultrasound signs of chronic endocervicitis and early cervical remodeling, particularly multiple and larger cysts involving the endocervix, isthmus, and stroma, are associated with an increased risk of late sPTB. Targeted assessment for these markers at the first prenatal visit can complement standard screening and may underpin a pathophysiology-based approach to pregnancy management.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.