Распространенность и молекулярно-генетические характеристики Helicobacter pylori в Узбекистане
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведены клинические, биохимические, иммунологические, генетические и инструментальные исследования. Для диагностики Н. pylori использовали CLO-тест в биоптатах и 13С-уреазный дыхательный тест. Молекулярно-генетическими методами определены СagA- и VacA-статус, резистентность к кларитромицину (выявление точечных мутаций A2142G/C, A2143G в V-функциональном домене 23S рРНК-гена). Оценивали эффективность семидневной тройной терапии и 14-дневной тройной терапии, усиленной висмута трикалия дицитратом (ВТД).
Результаты. Установлено, что Узбекистан отностися к регионам с высокой степенью инфицированности населения Н. pylori (80%). 84% населения Узбекистана имеют смешанный IceA1-/IceA2-генотип СagA. При язвенной болезни превалирует патогенный штамм СagA+ VacA s1, VacA m2 и IceA 1,2, при хроническим гастрите (тип В), ассоциированном с Н. pylori, – штамм Сag+ VacA s1, VacA m2 и IceA 1. Уровень резистентности штаммов Н. pylori к кларитромицину достигает 13,3%. Пролонгирование эрадикационной терапии до 14 дней и добавление к ней ВТД позволяет повысить эффективность эрадикации Н. pylori до 95%.
Материал и методы. Проведены клинические, биохимические, иммунологические, генетические и инструментальные исследования. Для диагностики Н. pylori использовали CLO-тест в биоптатах и 13С-уреазный дыхательный тест. Молекулярно-генетическими методами определены СagA- и VacA-статус, резистентность к кларитромицину (выявление точечных мутаций A2142G/C, A2143G в V-функциональном домене 23S рРНК-гена). Оценивали эффективность семидневной тройной терапии и 14-дневной тройной терапии, усиленной висмута трикалия дицитратом (ВТД).
Результаты. Установлено, что Узбекистан отностися к регионам с высокой степенью инфицированности населения Н. pylori (80%). 84% населения Узбекистана имеют смешанный IceA1-/IceA2-генотип СagA. При язвенной болезни превалирует патогенный штамм СagA+ VacA s1, VacA m2 и IceA 1,2, при хроническим гастрите (тип В), ассоциированном с Н. pylori, – штамм Сag+ VacA s1, VacA m2 и IceA 1. Уровень резистентности штаммов Н. pylori к кларитромицину достигает 13,3%. Пролонгирование эрадикационной терапии до 14 дней и добавление к ней ВТД позволяет повысить эффективность эрадикации Н. pylori до 95%.


Исходя из современных представлений, Helicobacter pylori – не только одна из наиболее распространенных патогенных бактерий, но и один из ведущих агрессивных факторов патогенеза кислотозависимых заболеваний [1]. По данным опубликованного в 2017 г. систематического обзора, приблизительно 4,4 млрд человек во всем мире инфицированы Н. pylori. Распространенность H. pylori варьируется от 18,9% в Швейцарии (95%-ный доверительный интервал (ДИ) 13,1–24,7) до 87,7% в Нигерии (95% ДИ 83,1–92,2). Различия в распространенности H. pylori установлены не только между континентами и странами, но и между регионами одной страны [2]. Ряд исследователей отмечают повышение риска инфицирования среди врачей, особенно гастроэнтерологов и эндоскопистов. Частота инфицирования напрямую коррелирует с количеством выполненных процедур и увеличением стажа профессиональной деятельности [3, 4].
Лечение инфекции, обусловленной Н. pylori, – непростая задача, поскольку схемы, гарантирующие 100%-ную эффективность, отсутствуют. Ученые проявляют повышенный интерес к данной теме. Подтверждение тому – свыше 120 метаанализов контролируемых исследований эффективности эрадикационной терапии [5]. В середине 1990-х гг. эффективность терапии достигала 90%. Сегодня во многих регионах мира данный показатель редко превышает 60% [6, 7].
Согласно эпидемиологическим данным, выявлена прямая корреляционная связь между степенью инфицированности и общим экономическим развитием страны, уровнем жизни и образования, а также санитарно-гигиеническими условиями в месте проживания [8].
В настоящее время серьезной проблемой стала антибиотикорезистентность. В соответствии с Маастрихтским соглашением, критерием эффективности эрадикационных схем считается степень эрадикации не менее 80%. Если изначально стандартная семидневная тройная эрадикационная терапия отвечала предъявляемым требованиям, то со временем (менее пяти лет) ее эффективность снизилась до 65–75%. Причин несколько: резистентность Н. pylori к антибактериальным препаратам, низкая приверженность пациентов лечению, развитие побочных эффектов, связанных с приемом антибиотиков, проявляющихся нарушением функции желудочно-кишечного тракта (ЖКТ) и ухудшающих выполнение больными предписаний врача.
В ряде исследований анализировали связь бактериальных факторов вирулентности и генетических полиморфизмов хозяина с характером гастрита и риском других заболеваний, особенно язвенной болезни и рака желудка [9]. В одном из исследований у пациентов, инфицированных штаммами H. pylori, вырабатывающими вакуолизирующий цитотоксин (VacA s1), возрастал риск развития рака желудка (отношение шансов – 87). В этом аспекте внимание сосредоточено на трех генетических локусах бактерий: CagA, VacА и IceА. Однако информация, полученная в ходе исследований, весьма противоречива. В Португалии, Италии и Испании VacAsi и CagA Н. pylori ассоциированы с язвенной болезнью желудка и двенадцатиперстной кишки. В Англии и Франции подобная закономерность не прослеживается. В ряде английских работ показано доминирование у здоровых жителей нескольких стран CagA, VacА штаммов H. pylori. Проблема усугубляется тем, что свойства бактерий зависят от географических факторов [10]. При изучении Н. pylori у жителей 20 стран мира установлены определенные различия генотипов. Однако в регионах Центральной Азии, в частности в Узбекистане, подобные исследования не проводились.
Кроме того, наблюдается тенденция к неуклонному снижению эффективности эрадикации Н. pylori до 70% на фоне стандартной терапии первой линии, а в ряде стран – до 60%. Одна из причин – антибиотикорезистентность [11]. Основным антибиотиком, к которому выявлена резистентность, признан кларитромицин, предложенный для лечения данной инфекции в начале 1990-х гг.
В рекомендациях по эрадикации Н. pylori не предусматривалось использование кларитромицина в монорежиме, однако применение препарата в качестве единственного антибиотика в эрадикационных схемах способствовало появлению резистентных штаммов [12]. Во второй половине 1990-х гг. наметилась тенденция к быстрому росту числа таких штаммов. Если в некоторых странах Западной Европы резистентность к кларитромицину у нелеченых больных составляла всего 0–2% и не влияла на показатели эрадикации, то во многих центрах Европы она достигала 8–15% и более. В Азии и ряде европейских стран данный показатель составлял 60% [13].
Исследований резистентности Н. pylori к кларитромицину в Узбекистане не проводилось, что осложняло выбор эрадикационных схем.
Цель исследования – определить степень инфицированности населения Н. pylori, частоту выявления патогенных Cag+-штаммов и уровень антибиотикорезистентности в Узбекистане.
Материал и методы
Проведены клинические, биохимические, иммунологические, генетические и инструментальные исследования. Для выявления Н. pylori выполнены CLO-тест в биоптатах и 13С-уреазный дыхательный тест. Генетические исследования проводились в Институте биоорганической химии Академии наук Республики Узбекистан. Материалом для молекулярно-генетического исследования служила геномная ДНК H. pylori. Мутации определялись методом полимеразной цепной реакции (ПЦР) в режиме реального времени с использованием праймеров и зондов. Для определения резистентности к кларитромицину с помощью ПЦР выявляли точечные мутации A2142G/C, A2143G в V функциональном домене 23S рРНК гена, ответственного за формирование резистентности Н. pylori к кларитромицину.
Всем Н. pylori-позитивным больным назначали эрадикационную терапию. 40 пациентов первой группы получали стандартную тройную терапию – ингибитор протонной помпы (ИПП), амоксициллин и кларитромицин в течение семи дней, 40 больных второй группы – ИПП + амоксициллин + кларитромицин и висмута трикалия дицитрат (ВТД) в течение 14 дней. Контрольное обследование включало быстрый уреазный тест и 13С-уреазный дыхательный тест через четыре недели после окончания курса эрадикационной терапии.
Результаты и обсуждение
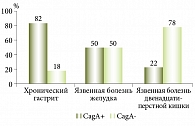
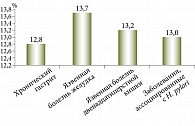
Установлено, что распространенность Н. pylori в Узбекистане в среднем превышает 80% в популяции (рис. 1). Сказанное означает, что Узбекистан относится к регионам с высокой степенью инфицированности H. pylori. Кроме того, обнаружены 1367 идентичных генов с европейским штаммом НР26695 и 1162 гена, идентичных генам африканского штамма J99. Эти гены составляют функциональное ядро генома H. pylori. Выявлены два кластера генов – зоны пластичности, где доля штаммоспецифичных генов составляет 79% для зоны пластичности НР0423 – НР0466 и 37% для зоны пластичности НР0982 – НР1028. Среди отдельных групп штаммовой гетерогенностью в большей степени отличались гены, отвечающие за метаболизм ДНК, и белки клеточной оболочки. Оценка географического распределения генотипов H. pylori показала, что во всех регионах превалирует СagA-положительный вариант (рис. 2). VacA s1m1 чаще регистрировался в Хорезмском регионе и Каракалпакстане, VacA s1m2 – в Намангане и Ташкенте. В Хорезме обнаружено большое количество (84%) смешанного IceA1/IceA2 генотипа. В остальных областях доминирует IceA1 аллель этого гена. Выявлены генотипы бактерии, ассоциированные с различными заболеваниями ЖКТ.
У больных гастритом превалирует штамм Сag+ VacA s1, VacA m2 и IceA 1, у пациентов с язвенной болезнью – штамм СagA+ VacA s1, VacA m2, IceA 1,2. Эти исследования позволяют адаптировать имеющиеся стандарты диагностики и лечения заболеваний, ассоциированных с Н. pylori, к условиям региона с высокой степенью инфицированности.
При определении резистентности Н. pylori к кларитромицину в режиме реального времени проведена ПЦР на обнаружение мутаций в генах A2142G/C, A2143G. Из 30 образцов в четырех выявлена A2142G/C-мутация (13,3%) (рис. 3). Мутация A2143G в исследованных образцах не обнаружена. Полученные показатели ниже предельного значения 15%, регламентированного Маастрихтским соглашением.
При проведении контрольных тестов после эрадикационной терапии установлено, что в группе пациентов, принимавших стандартную тройную терапию в течение семи дней, ее эффективность составила 72,5%, что значительно ниже необходимого порога удовлетворительного эффекта (таблица).
У больных, получавших тройную терапию, усиленную ВТД, в течение 14 дней, эрадикация отмечалась в 95% случаев. Полученные данные сопоставимы с результатами ранее опубликованных исследований, посвященных оценке эффективности схем с ВТД [14, 15].
По данным разных авторов, эффективность семидневной тройной терапии с использованием ИПП, амоксициллина и кларитромицина варьируется от 60 до 78%. Исходя из современных требований, допустимый нижний порог эффективности схем эрадикации – 90%.
Согласно результатам проведенных в нашем регионе исследований, эффективность тройной семидневной эрадикационной терапии – 72,5%. Пролонгирование эрадикационной терапии до 14 дней и добавление к ней ВТД способствуют повышению эффективности эрадикации до 95% (уреазный и дыхательный тесты).
Таким образом, Узбекистан относится к регионам с высокой степенью инфицированности населения H. pylori. При анализе патогенных свойств H. pylori установлено, что 84% населения Узбекистана имеют смешанный IceA1/IceA2 генотип СagA. У больных язвенной болезнью превалирует патогенный штамм СagA+ VacA s1, VacA m2, IceA 1,2. У больных хроническим гастритом типа В доминирует штамм Сag+ VacA s1, VacA m2 и IceA 1. Уровень резистентности штаммов Н. pylori к кларитромицину – 13,3%. Учитывая, что эффективность традиционной семидневной тройной терапии ниже 80%, целесообразно продлевать срок эрадикационной терапии до 14 дней и использовать препараты висмута.
Выводы
Узбекистан относится к регионам с высокой степенью инфицированности населения хеликобактерной инфекцией.
Среди пациентов с заболеваниями ЖКТ, ассоциированными с H. pylori, степень инфицированности с Cag-положительными штаммами до 80% обнаружена у больных хроническим атрофическим и неатрофическим гастритом.
Степень резистентности Н. pylori к кларитромицину в Узбекистане – 13,3%.
Эффективность семидневной тройной терапии в Узбекистане составляет в среднем 65%, что свидетельствует о нецелесообразности ее использования.
Удлинение сроков эрадикационной терапии до 14 дней и добавление к ней препаратов висмута позволяют повысить эффективность лечения до 95%.
M.M. Karimov, MD, PhD, Prof., G.N. Sobirova, MD, PhD, Z.Z. Saatov, PhD, Sh.Z. Islamova, S.T. Rustamova
Republican Specialized Scientific-Practical Medical Center for Therapy and Medical Rehabilitation, Tashkent, Uzbekistan
Contact person: Mirvasit M. Karimov, mirvasit61@rambler.ru
Objective – to determine Helicobacter pylori infection rate of the population, the frequency of detection of pathogenic Cag+ strains and antibiotic resistance in Uzbekistan.
Material and methods of research included clinical, biochemical, immunological, genetic, instrumental methods of research. CLO test in biopsies and 13C-urease breath test was used for diagnostics H. pylori. Cag A and Vac A status, resistance to clarithromycin (identifying point mutations A2142G/C, A2143G in the functional domain of the 23S rRNA gene) were determined by using molecular-genetic methods. The efficacy of triple 7-day therapy and 14-day triple bismuth tricalium dicitrate-enhanced (VTD) was evaluated.
Results. It was found that population of Uzbekistan belongs to the regions with a high degree of H. pylori infection (80%). In 84% of the population of Uzbekistan found mixed IceA1/IceA2 genotype GagA. It was noted that in peptic ulcer prevalent pathogenic strains are CagA+ VacAs1, VacAm2 and Ice 1,2. In patients with H. pylori-associated chronic gastritis (type B) dominate Сag+ VacA s1, VacA m2 and IceA 1 strains. The resistance of H. pylori strains to claritromycin is 13.3%. Prolongation of the period of eradication therapy to 14 days and the addition of VTD can improve the efficiency of H. pylori eradication up to 95%.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


