Как показал анализ структуры дерматитов сочетанной этиологии (ДСЭ), проведенный НИИ медицинской микологии им. П.Н. Кашкина в 2009 г., присоединение грибковой и бактериальной инфекции чаще наблюдалось при АтД (48% больных) и экземе (30%), реже при псориазе (20%) [3]. У 42% больных течение хронического дерматоза осложнялось присоединением пиококковой инфекции. Возбудителями гнойного процесса при ДСЭ являлись Staphylococcus aureus – 48% случаев, Streptococcus pyogenes – 24%, Corynebacterium minutissimum – 20%, Pseudomonas aeruginosa – 8%. Мицелий патогенных грибов был обнаружен в 45% случаев. Основные возбудители микозов у больных ДСЭ – дерматомицеты. Их выявляли в 45% случаев. У 31% пациентов обнаружили Candida spp., у 24% – Malassezia spp. Среди дерматомицетов доминировал Trichophyton rubrum – 76% случаев. T. mentagrophytes выявили у 16% больных, Epidermophyton floccosum – у 8%. У 13% была смешанная бактериально-грибковая инфекция.
Среди больных с осложненными дерматозами преобладали соматически отягощенные пациенты. У 25% из них были зарегистрированы эндокринопатии, в том числе сахарный диабет, у 37% – ожирение, у 5% – гипотиреоз. Заболевания сердечно-сосудистой системы были выявлены у 20% больных, метаболический синдром – у 18%, иммунодефицитные состояния – у 7% [3].
Атопический дерматит – наследственный иммуно-нейроэндокринный воспалительный хронический рецидивирующий дерматоз, проявляющийся интенсивным зудом, ксерозом, симпатергической реакцией кожи (белый дермографизм), преимущественно эритематозно-лихеноидными высыпаниями, в сочетании с другими признаками атопии. У больных АтД нарушена барьерная функция кожи, что создает благоприятные условия для роста и развития бактериальной и грибковой микрофлоры.
Длительное аллергическое воспаление кожи приводит к негативным последствиям, в частности к развитию инфекционных осложнений. Постоянное механическое воздействие на кожу из-за сильного зуда – одна из причин высвобождения клетками эпидермиса большого количества провоспалительных цитокинов – фактора некроза опухоли альфа и интерлейкина-1-бета [2, 4]. В результате образуется порочный круг: интенсивный зуд способствует усилению воспаления кожи, а воспаление – повреждению рогового слоя и водно-жировой пленки с увеличением трансэпидермальных потерь воды, приводящих к сухости, шелушению и зуду. Многочисленные расчесы нарушают целостность структуры кожи, открывая тем самым входные ворота для инфекции.
Микробиоценоз кожи больных АтД по сравнению с таковым здоровых лиц характеризуется повышением общего числа микроорганизмов. Кроме того, имеют место особенности, касающиеся разновидностей микрофлоры и характера ответной реакции организма. Чаще в воспалительном процессе участвуют S. aureus, грибы рода Malassezia, а также дрожжеподобные грибы рода Candida.
Более чем у 90% пациентов в хронических очагах поражения кожи выявляется S. aureus. На участках экссудации и мокнутия количество микроорганизмов может достигать 1×107 на 1 см2. Токсины, секретируемые S. aureus (энтеротоксины А и В, токсин-1 синдрома токсического шока), являются суперантигенами, стимулирующими одновременно несколько звеньев иммунного ответа [4, 5]. Они связываются с бета-цепью Т-клеточного рецептора TCR и молекулой главного комплекса гистосовместимости II класса HLA-II и активируют семейство клонов Т-лимфоцитов с такой бета-цепью TCR, что приводит к повышенной продукции провоспалительных цитокинов и усиливает реакцию аллергического воспаления [5].
Особую роль в патогенезе АтД играет грибковая флора. У 39% больных АтД с поверхности кожи высевали нелипофильные дрожжи. Преобладали грибы рода Candida (49%). Реже высевали грибы рода Rhodotorula (25%) и Cryptococcus (14%) [6]. У пациентов с АтД плотность колоний C. albicans как на пораженных, так и на интактных участках кожи выше, чем у здоровых лиц.
В настоящее время доказано участие в патогенезе АтД грибов рода Candida в качестве не только патогенов, но и источников классических аллергенов, инициирующих иммунный ответ по IgE-зависимому типу аллергических реакций. Частота выявления сенсибилизации к Сandida варьирует от 16 до 85% [6]. Частота обнаружения IgE-антител к Сandida выше у взрослых пациентов, а также у больных с тяжелыми формами АтД.
При АтД с преимущественной локализацией в области богатых сальными железами участков кожи (лицо, верхняя половина спины и груди, шея, волосистая часть головы) на фоне хронического воспаления кожи создаются благоприятные условия для развития инфекции, вызванной грибами рода Malassezia. Клиническая картина поражения кожи при АтД, ассоциированном с Malassezia-инфекцией, представлена желтовато-коричневатыми шелушащимися пятнами и папулами, начинающимися от устьев волосяных фолликулов, постепенно увеличивающихся в размерах и сливающихся друг с другом. После разрешения высыпаний остаются участки гипопигментации, чередующиеся с гиперпигментацией. Помимо Malassezia furfur – патогена, вызывающего характерные клинические проявления, в воспалении при АтД определенную роль может играть IgE-зависимая аллергическая реакция к антигенам данного микроорганизма. Сенсибилизация к антигенам Malassezia подтверждена в результате выявления IgE-антител к антигенам Malassezia. Данные исследований показали присутствие IgE-антител к Malassezia у 20–100% больных с АтД. Показано, что у 68% взрослых пациентов с тяжелым течением АтД выявляются специфические IgE-антитела к Malassezia. Сенсибилизация к Malassezia у больных с АтД поддерживает Th2-тип иммунного ответа [7].
Экзема – хроническое воспалительное заболевание кожи нервно-аллергического характера, возникающее в ответ на воздействие внешних или внутренних раздражителей, отличающееся полиморфизмом сыпи, зудом и длительным рецидивирующим течением. У пациентов, страдающих экземой, выделяют ряд факторов, способствующих развитию бактериальной и грибковой флоры на поверхности кожи. Прежде всего это экссудация на поверхность кожи белков плазмы, наличие входных ворот для инфекции, изменение рН на поверхности кожи, изменение липидного состава рогового слоя, изменение местного иммунного ответа [8]. Кроме того, у таких больных обнаружена повышенная обсемененность кожи бактериальной флорой, которая при благоприятных условиях (размножение и повышение вирулентности) способствует развитию гнойничковых заболеваний, а также, выступая в роли источника бактериальных суперантигенов, поддерживает аллергическое воспаление. У больных истинной экземой в 80% случаев с поверхности очагов поражения высевали S. aureus и в 14% – S. haemolyticus [9]. У ряда больных бактериальная инфекция сочеталась с грибковой.
Осложнять течение заболеваний негрибкового происхождения могут грибы-недерматофиты. Развиваясь на фоне хронических кожных заболеваний, возбудители оппортунистических микозов становятся дополнительным мощным аллергизирующим фактором, часто приводящим к хронизации процесса, торпидности к традиционной терапии. Нередко больные длительно и безуспешно используют мази на основе ГКС, которые только усугубляют патологический процесс.
При исследовании микрофлоры кожи пациентов с хроническими дерматозами при контактном способе посева в очагах поражения у 40,7% больных экземой были выявлены грибы-недерматофиты. Причем чаще встречались дрожжеподобные грибы родов Candida (44,4–49%) и Rhodotorula (27,8–25%). Кроме того, в 44,3% случаев грибы-недерматофиты выявляли в соскобах с ногтевых пластинок рук и в 30% случаев – с ногтевых пластинок стоп [6].
Приведенные данные свидетельствуют о высокой частоте кандидоносительства у большинства больных хронической экземой. У них отмечается выраженная сенсибилизация к грибам рода Candida, что подтверждается положительными аллергическими кожными пробами (у 55,4% больных) и высоким содержанием в крови антигенсвязывающих лейкоцитов (в 7 раз выше, чем у практически здоровых лиц), выявленных к грибковому антигену рода Candida [6]. Это позволяет говорить об особой роли грибов рода Candida в развитии аллергизации организма с соответствующими клиническими проявлениями.
Псориаз крупных складок (инверсный, или интертригинозный) – псориатическое поражение крупных складок. Развивается обычно у детей и пожилых людей, особенно страдающих сахарным диабетом. Очаги резко очерчены, их поверхность гладкая, насыщенного красного цвета, иногда слегка влажная, мацерированная. Клинические проявления напоминают таковые при кандидозе складок, опрелости и дерматофитиях. Шелушение, как правило, не выражено или отсутствует, а в глубине кожной складки образуются трещины. Благодаря оптимальной температуре и влажности в складках кожи развиваются микроорганизмы. У здоровых лиц в аксиллярных складках в 70% образцов выделяют Propionibacterium acnes и в 5–10% – S. aureus. Кожу паховых складок в 10% случаев колонизирует S. aureus, нередко C. albicans [10].
Нарушение эпидермального барьера кожи в очагах псориаза, мацерация, повышенная влажность создают благоприятные условия для активизации флоры в крупных складках и присоединения к основному дерматозу бактериально-грибкового инфицирования [11].
Обычно интертригинозный псориаз сопровождается кандидозом. Наличие сахарного диабета у больных инверсным псориазом также способствует развитию инфекционно-воспалительных заболеваний, особенно при неудовлетворительном контроле гликемии. У таких больных микроорганизмов на поверхности кожи в 2,5 раза больше, чем у здоровых лиц, а бактерицидная активность кожи ниже в среднем на 20%. Это снижение прямо коррелирует с тяжестью течения диабета. Особенно часто активизируются дрожжеподобные грибы C. albicans и другая недерматофитная инфекция. Причем в нормальной популяции грибковые поражения кожи, вызванные C. albicans, не превышают 20%, тогда как у соматически отягощенных пациентов этот показатель достигает 80–90% [12].
Лечение осложненных дерматозов предполагает назначение комбинированной терапии с использованием нескольких препаратов разных фармакологических групп: топических ГКС, антибиотиков и антимикотиков. Применение комбинированных препаратов в терапии хронических дерматозов, осложненных вторичной инфекцией, позволяет одновременно подавлять аллергическое воспаление и устранять бактериально-грибковую флору, поддерживающую аллергический процесс [13].
При выборе конкретного комбинированного ГКС необходимо учитывать множество факторов, в том числе возраст больного, локализацию кожного процесса, предшествовавшую наружную терапию, длительность лечения, наличие сопутствующих заболеваний. Назначение наиболее часто используемых в клинической практике фторсодержащих комбинированных ГКС, особенно при длительном применении, неминуемо приводит к развитию побочных эффектов, а нередко и к тахифилаксии. Особенно тщательно к выбору наружного ГКС следует подходить в случае, когда речь идет о детях, а также когда высыпания локализованы на участках кожи, высокочувствительных к стероидам: лице, шее, складках, молочных железах, половых органах [14].
Нерациональный выбор противоинфекционного препарата способствует дальнейшему распространению инфекции, прогрессированию процесса и возрастанию количества резистентных штаммов дерматомицетов и пиококков к лекарственным средствам. Современная стратегия наружной терапии предполагает не только быстрое подавление воспалительной реакции кожи, но и полную элиминацию возбудителя инфекции. Выбранный препарат должен обладать широким спектром антигрибковой, антибактериальной активности, высокой биодоступностью. Однако крайне важно, чтобы подавляющее большинство штаммов клинически значимых дерматомицетов и пиококков имело высокую чувствительность к препарату. Исследования, проведенные в России, по изучению чувствительности нозокомиальных штаммов S. aureus к длительно используемым в клинической практике антибиотикам выявили резистентность к гентамицину у 31% выделенных штаммов и к тетрациклину – у 37%. То есть более чем у трети пациентов при применении таких препаратов эффект антимикробной терапии отсутствовал [15].
Высокоэффективным средством в лечении осложненных дерматозов является мазь и крем Пимафукорт. В состав препарата входят три компонента: гидрокортизон – 1%, натамицин – 1% и неомицин – 0,35%.
Пимафукорт можно применять у беременных, новорожденных (у данных пациентов не рекомендуется использовать окклюзионные повязки, а также следует максимально ограничивать площадь нанесения препарата на кожу и длительность терапии) и пожилых. Его можно наносить на чувствительные к стероидам участки кожи.
Основное преимущество Пимафукорта – высокая безопасность благодаря входящему в состав препарата «мягкому» природному кортикостероиду гидрокортизону (I класс активности по Европейской классификации – слабый).
Натамицин относится к группе полиеновых антимикотиков. Он оказывает фунгицидное действие благодаря необратимой связи с эргостерином клеточной мембраны гриба, вызывая разрыв клеточной оболочки с последующим цитолизом и полным разрушением клеток грибов и гифов. Натамицин оказывает быстрое и активное фунгицидное действие на многие патогенные для человека грибы, активен в отношении дрожжевых и дрожжеподобных грибов рода Malassezia, дерматофитов и плесневых грибов, высокоактивен в отношении грибов рода Candida. Основное преимущество этого наружного антимикотика заключается в сохранении стабильного фунгицидного действия в широком диапазоне рH кожи – от 4,5 до 9,0. Кроме того, резистентность к нему отсутствует даже при длительном применении. Не отмечено и первичной резистентности. При применении натамицина не возникает аллергических реакций, что связано с незначительной тропностью препарата к белкам и преимущественным связыванием с липидами.
Неомицин – антибиотик группы аминогликозидов – активен в отношении широкого спектра грамотрицательных бактерий и стафилококков, обладает низким уровнем всасывания через неповрежденную кожу.
Сочетание натамицина и неомицина делает Пимафукорт универсальным в терапии различных вариантов грибковой и бактериально-грибковой инфекции кожи, а также в тех случаях, когда терапию назначают до идентификации возбудителя.
Высокая эффективность Пимафукорта при АтД была доказана в многочисленных исследованиях [4, 13, 16]. Больные со среднетяжелым течением АтД, осложненным поверхностной стафилодермией и сопутствующей Candida-инфекцией, получали мазь Пимафукорт 2 раза в день в течение 14 дней. В процессе терапии было зарегистрировано уменьшение площади поражения и тяжести течения АтД, значительное снижение абсолютных значений индекса SCORAD (SCORing Atopic Dermatitis – комплексная оценка симптомов и проявлений атопического дерматита) с 38 до 6, улучшение качества жизни больных (снижение дерматологического индекса качества жизни с 19,9 до 3,2) [16].
В процессе терапии Пимафукортом значительно уменьшилась обсемененность бактериальной и грибковой флорой кожи больных АтД, что было подтверждено результатами бактериологического и бактериоскопического исследований. До лечения обсемененность S. aureus была выявлена у 100% пациентов, по окончании терапии – у 10%, грибы рода Candida – у 62,5 и 4% больных соответственно [16].
В сравнительных исследованиях с однокомпонентными топическими ГКС была показана более высокая эффективность препарата Пимафукорт в терапии АтД, осложненного стафилококковой инфекцией [4].
Нами было проведено собственное исследование с участием больных истинной экземой с присоединением вторичной инфекции препаратом Пимафукорт. Все пациенты имели сопутствующее заболевание – сахарный диабет 2 типа. Комплексное лечение проводили антигистаминными препаратами, десенсибилизирующими средствами, в качестве средства наружной терапии использовали крем Пимафукорт 3 раза в день. Средний индекс EASI (Eczema Area and Severity Index – распространенность и тяжесть сыпи при экземе) до начала терапии составил 15,3 ± 1,4. Положительная динамика процесса отмечалась на первой неделе лечения: снижались гиперемия, шелушение, мокнутие, исчезал зуд. Средний индекс EASI снизился в процессе лечения до 1,3 ± 0,9. В конце второй недели терапии у 97% больных констатировали регресс заболевания.
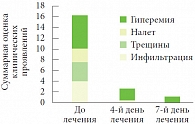
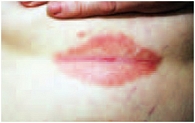
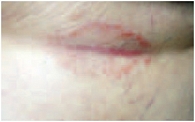
Кроме того, мы применяли препарат Пимафукорт у больных псориазом, страдающих сахарным диабетом. Комплексное лечение включало десенсибилизацию, гепатопротекторы, витаминотерапию, применение сосудистых препаратов, анксиолитиков. В качестве наружного средства на очаги в крупных складках наносили крем Пимафукорт 3 раза в день, на очаги на гладкой коже – однокомпонентный топический ГКС. Процесс был представлен бляшками ярко-розового цвета, мацерированными, с трещинами и белым налетом на поверхности (рис. 1). Симптомы заболевания в складках кожи оценивали по 5-балльной шкале. До лечения гиперемия оценивалась в 5 баллов, инфильтрация – в 3, трещины и беловатый налет – в 2 балла. Положительная динамика патологического процесса в складках отмечалась на второй – четвертый день лечения и характеризовалась значительным уменьшением гиперемии, инфильтрации, исчезновением мокнутия, беловатого налета и эпителизацией трещин (рис. 2). Регресс высыпаний в складках констатировали в 100% случаев через 7–10 дней терапии (рис. 3).
Таким образом, важным условием успешного лечения осложненных дерматозов является рациональное использование топических комбинированных препаратов. В терапии АтД, истинной экземы с присоединением вторичной инфекции, а также псориаза крупных складок целесообразно использовать трехкомпонентный препарат Пимафукорт. Его эффективность при лечении данных заболеваний варьировала от 95 до 100%, причем положительный эффект регистрировали в максимально короткие сроки. С учетом безопасности всех компонентов препарата его можно рекомендовать к использованию в любых возрастных группах, при различных локализациях патологического процесса. Широкая антибактериальная и антигрибковая активность делает Пимафукорт универсальным в терапии различных вариантов микотической, бактериальной и смешанной инфекций кожи, а также в случаях, когда терапию назначают до идентификации возбудителя.