Рациональные подходы к диагностике и терапии анкилозирующего спондилоартрита
- Аннотация
- Статья
- Ссылки
- English
Важное значение при ранней диагностике спондилоартрита отводится таким показателям, как боль в спине воспалительного характера, HLA B27-позитивность, а также выявлению сакроилеита по данным рентгенографии костей таза или магнитно-резонансной томографии илеосакральных сочленений в режиме STIR/T2 с подавлением жира.
Для медикаментозного лечения АС активно используются нестероидные противовоспалительные препараты (НПВП), анальгетики, глюкокортикостероиды, сульфасалазин, ингибиторы фактора некроза опухоли альфа и интерлейкина 17. Из группы НПВП целесообразным является применение нимесулида (Нимесил), сочетающего высокую эффективность и относительную безопасность (по сравнению с традиционными препаратами данной группы) в отношении риска развития серьезных осложнений со стороны желудочно-кишечного тракта и сердечно-сосудистой системы.
Важное значение при ранней диагностике спондилоартрита отводится таким показателям, как боль в спине воспалительного характера, HLA B27-позитивность, а также выявлению сакроилеита по данным рентгенографии костей таза или магнитно-резонансной томографии илеосакральных сочленений в режиме STIR/T2 с подавлением жира.
Для медикаментозного лечения АС активно используются нестероидные противовоспалительные препараты (НПВП), анальгетики, глюкокортикостероиды, сульфасалазин, ингибиторы фактора некроза опухоли альфа и интерлейкина 17. Из группы НПВП целесообразным является применение нимесулида (Нимесил), сочетающего высокую эффективность и относительную безопасность (по сравнению с традиционными препаратами данной группы) в отношении риска развития серьезных осложнений со стороны желудочно-кишечного тракта и сердечно-сосудистой системы.
Анкилозирующий спондилоартрит (АС), или болезнь Бехтерева, – хроническое системное заболевание, характеризующееся воспалительным поражением суставов позвоночника, околопозвоночных тканей и крестцово-подвздошных сочленений с анкилозированием межпозвоночных суставов и развитием кальцификации спинальных связок. Его распространенность в разных странах варьирует от 0,5 до 2%. Заболевание развивается главным образом у мужчин в возрасте 15–30 лет. Соотношение заболевших мужчин и женщин составляет в среднем 9:1 [1].
Этиология АС неизвестна. Однако большое значение в его развитии придается генетическим факторам, в частности антигену гистосовместимости HLA B27. Он обнаруживается у 90–95% больных, примерно у 20–30% их родственников и лишь у 7–8% лиц в общей популяции. Обсуждается также роль инфекционных факторов. В частности, получены данные об участии некоторых штаммов Klebsiella и других видов энтеробактерий в развитии периферического артрита у пациентов с АС.
Существует несколько гипотез, объясняющих связь между носительством антигена гистосовместимости HLA B27 и АС. Согласно гипотезе антигенной мимикрии рецепторное сходство антигена HLA B27 и микробного антигена может способствовать его длительной персистенции и стимулировать развитие аутоиммунного процесса [2].
Анкилозирующий спондилоартрит, как правило, развивается постепенно, в подростковом или молодом возрасте (15–30 лет). Основным симптомом заболевания считается сакроилеит – двустороннее воспаление крестцово-подвздошных суставов. Для сакроилеита характерны жалобы на воспалительные боли в крестце, ягодицах, по задней поверхности бедер, напоминающие пояснично-крестцовый радикулит. Боль чаще двусторонняя, носит постоянный характер, усиливается во второй половине ночи. Нередко отмечается атрофия ягодичных мышц, их напряжение. Второй по значимости ранний симптом АС – боль и скованность в пояснице. Отмечается также тугоподвижность в поясничном отделе позвоночника. Объективно выявляются сглаженность или полное исчезновение поясничного лордоза.
Поражение грудного отдела позвоночника характеризуется болями, часто иррадиирующими по ходу ребер. Вследствие образования анкилозов грудинно-реберных сочленений резко уменьшается экскурсия грудной клетки.
При поражении шейного отдела позвоночника основной жалобой может быть резкое ограничение движений вплоть до неподвижности, а также боль при движении головой. Пациент не способен достать подбородком грудину. При прогрессировании болезни исчезают физиологические изгибы позвоночника, формируется поза просителя – выраженный кифоз грудного отдела позвоночника и гиперлордоз шейного отдела позвоночника.
Часто у пациентов с АС в процесс вовлекаются периферические суставы. При АС поражаются тазобедренные (коксит) и плечевые суставы. Процесс начинается постепенно, носит симметричный характер, как правило заканчивается анкилозированием.
Нередко в дебюте заболевания в патологический процесс вовлекаются суставы нижних конечностей по типу моно- или олигоартрита.
Ярким клиническим проявлением АС служат энтезопатии – преимущественно в местах прикрепления к пяточной кости пяточного сухожилия и подошвенный апоневроз.
У пациентов с АС наблюдаются также внескелетные симптомы. У 10–30% – поражение глаз, в частности ирит, иридоциклит. Поражение глаз может быть первым проявлением заболевания, предшествовать симптомам сакроилеита и нередко носит рецидивирующий характер.
Нарушения сердечно-сосудистой системы при АС отмечаются в 20–22% случаев. К таковым относятся аортит, миокардит, перикардит и миокардиодистрофия. Описаны случаи тяжелого перикардита с прогрессирующей недостаточностью кровообращения, полная атриовентрикулярная блокада с синдромом Морганьи – Адамса – Стокса. При длительном течении АС с высокой клинико-лабораторной активностью может формироваться недостаточность аортального клапана.
Специфичным поражением легких при АС считается развитие апикального пневмофиброза, который встречается в 3–4% случаев и требует дифференциальной диагностики с туберкулезными изменениями.
Почки поражаются у 5–31% больных. Чаще развивается амилоидоз, как правило через много лет от начала заболевания. Реже – IgА-нефропатия. Причиной мочевого синдрома, проявляющегося протеинурией и микрогематурией, может стать длительный прием нестероидных противовоспалительных препаратов (НПВП) с развитием лекарственной нефропатии.
В связи с выраженным остеопорозом незначительные травмы могут привести к переломам шейных позвонков с развитием квадриплегии. Вследствие небольшой травмы при деструкции поперечной связки атланта развиваются атлантоаксиальные подвывихи – 2–3%. Более редким осложнением считается синдром конского хвоста вследствие хронического эпидурита с импотенцией и недержанием мочи [3].
Диагностика
В диагностике АС особое внимание уделяется оценке подвижности в разных отделах позвоночника: в шейном (проба «подбородок – грудина»), грудном (проба Отта). Для определения подвижности реберно-позвоночных суставов измеряют дыхательную экскурсию грудной клетки (норма 5–6 см). Подвижность в поясничном отделе позвоночника оценивают с помощью теста Шобера [4].
Для определения активности АС используют BASDAI (Bath Ankylosing Spondilitis Disease Activity Index). Значения BASDAI, превышающие 40 баллов, свидетельствуют о высокой активности заболевания. В 2009 г. Европейской антиревматической лигой предложен индекс ASDAS (Ankylosing Spondilitis Disease Activity Score), который учитывает не только клинические проявления АС, но и такие лабораторные показатели активности заболевания, как С-реактивный белок (СРБ) и скорость оседания эритроцитов (СОЭ). Если показатели ASDAS < 1,3 балла, активность АС низкая, от 1,3 до 2,1 балла – умеренная, от 2,1 до 3,5 балла – высокая, > 3,5 балла – очень высокая [5].
Признаком воспалительного поражения суставов и позвоночника при АС считается высокий уровень СОЭ, СРБ и циркулирующих иммунных комплексов. Ревматоидный фактор обычно не обнаруживается.
Важная роль в диагностике отводится рентгенологическому исследованию. Наиболее ранние изменения отмечаются в крестцово-подвздошных сочленениях – признаки сакроилеита. Однако на ранней стадии заболевания рентгенологические изменения в позвоночнике могут отсутствовать, поэтому целесообразно выполнять магнитно-резонансную томографию (МРТ) крестцово-подвздошных сочленений в режиме STIR (Short Tau Inversion Recovery) и T2 с подавлением жира. Проведение МРТ показано для выявления ранних изменений в тазобедренных суставах и илеосакральных сочленениях. Она позволяет диагностировать синовит, капсулит, деструкции головки бедра, эрозии, склеротические изменения, анкилоз.
При обнаружении сакроилеита рекомендовано установить соответствие клинической картины по модифицированным Нью-Йоркским критериям АС:
- боль и скованность в нижней части спины (в течение не менее трех месяцев), уменьшающиеся после физических упражнений;
- ограничение движений в поясничном отделе позвоночника в сагиттальной и фронтальной плоскостях;
- ограничение дыхательных экскурсий грудной клетки по сравнению с показателями у здоровых лиц;
- сакроилеит (двусторонний второй стадии и более или односторонний третьей и четвертой стадий), диагностированный при проведении рентгенологического исследования.
При наличии четвертого (рентгенологического) критерия и хотя бы одного из первых трех (клинических) диагноз считается достоверным [3, 6].
Согласно положениям Международного общества по изучению спондилоартритов для пациентов с болью в спине продолжительностью три месяца и более и возрастом начала заболевания менее 45 лет классификационными критериями аксиального спондилоартрита являются сакроилеит, подтвержденный результатами МРТ (активное (острое) воспаление, характерное при спондилоартрите) или рентгенографии (достоверный сакроилеит по модифицированным Нью-Йоркским критериям), плюс один признак и более спондилоартрита или наличие антигена HLA B27 плюс два и более признака спондилоартрита. К признакам последнего относятся воспалительная боль в спине, артрит, энтезит (пяточный), увеит, дактилит, псориаз, болезнь Крона/язвенный колит, хороший ответ на НПВП, отягощенный семейный анамнез по заболеванию, наличие антигена HLA B27, повышенный уровень СРБ [6].
Лечение
Основные цели лечения АС – максимальное улучшение качества жизни посредством купирования и снижения боли, уменьшение скованности и утомляемости, улучшение/стабилизация функциональных возможностей, предотвращение/замедление структурных повреждений [6].
Ведущее место в лечении АС занимает кинезиотерапия. Данная терапия направлена на сохранение подвижности позвоночника, его разгрузку, активацию диафрагмального дыхания.
Лечебная физкультура должна проводиться с осторожностью. Она начинается с малых объемов движений, периодичность занятий – два-три раза в день. Необходимо избегать подъема тяжестей, прыжков, бега. Больным показаны прогулки на лыжах, плавание в бассейне. Необходимо также обучать их техникам релаксации.
К лекарственным средствам, которые активно используются при АС, относятся НПВП, анальгетики, глюкокортикостероиды, базисные противовоспалительные препараты, ингибиторы фактора некроза опухоли aльфа (ФНО-альфа) и интерлейкина (ИЛ) 17.
Препаратами первой линии признаны НПВП. Они должны назначаться сразу после постановки диагноза, независимо от стадии заболевания. У пациентов с персистирующей активностью АС терапия НПВП должна быть длительной. АС, пожалуй, является единственным ревматическим заболеванием, при котором длительный прием препаратов данной группы патогенетически обоснован, высокоэффективен и не имеет альтернативы, кроме ингибиторов ФНО-альфа. Непрерывный прием НПВП замедляет прогрессирование болезни, в то время как прием «по требованию» на прогрессирование практически не влияет. При назначении НПВП необходимо учитывать наличие сердечно-сосудистых патологий, патологий желудочно-кишечного тракта и почек [7].
При длительном применении хороший противовоспалительный и обезболивающий эффект достигается в случае назначения диклофенака натрия (препарат Вольтарен в дозе 100 мг/сут) и индометацина (75–150 мг/сут).
К сожалению, высокий терапевтический потенциал НПВП ограничивается риском развития класс-специфических нежелательных реакций, связанных с подавлением активности физиологического изомера циклооксигеназы (ЦОГ) 1. Наибольшее клиническое значение имеет развитие патологии желудочно-кишечного тракта (НПВП-гастропатия).
Существенно снизить риск развития язв, желудочно-кишечного кровотечения, перфорации, а также нарушения проходимости можно благодаря использованию селективных ЦОГ-2-ингибиторов.
В России применяются такие селективные НПВП, как целекоксиб, эторикоксиб, мелоксикам и нимесулид. Именно эти препараты, согласно существующим в России рекомендациям по рациональному использованию НПВП, должны использоваться у больных с высоким риском развития осложнений со стороны желудочно-кишечного тракта. К этой категории относятся пациенты с язвенным анамнезом (особенно с язвами, осложненными кровотечением или перфорацией), пожилого возраста (65 лет и старше), а также пациенты, получающие в качестве сопутствующей терапии низкие дозы ацетилсалициловой кислоты, антикоагулянты или глюкокортикостероиды.
Нимесулид (Нимесил) синтезирован в биохимической лаборатории ЗМ (подразделение Riker Laboratories) доктором G. Moore и лицензирован в 1980 г. швейцарской фирмой Helsinn Healthcare SA. Впервые на фармакологическом рынке нимесулид появился в 1985 г. в Италии, где по-прежнему остается наиболее популярным рецептурным НПВП.
Нимесулид представляет собой N-(4-Нитро-2-феноксифенил) метансульфонамид. При приеме внутрь быстро и практически полностью абсорбируется независимо от приема пищи, связывается с альбумином на 99%. При применении 100 мг максимальная концентрация в плазме крови достигается через 1,22–2,75 часа. Молекула нимесулида в отличие от других молекул НПВП обладает слабыми кислотными свойствами, как следствие, характеризуется низким потенциалом в отношении контактного повреждения слизистой оболочки верхних отделов желудочно-кишечного тракта. В то же время это свойство позволяет препарату легко проникать и накапливаться в очагах воспаления в более высокой концентрации, чем в плазме крови. Выведение нимесулида происходит как с мочой, так и с калом. Нимесулид обладает наименьшим периодом полувыведения – 1,8–4,7 часа [8, 9].
В Италии проведено исследование частоты сообщений о серьезных нежелательных эффектах, связанных с назначением различных НПВП. Проанализировано 10 608 сообщений, поступивших с 1988 по 2000 г. Установлено, что нимесулид вызывал осложнения со стороны желудочно-кишечного тракта в два раза реже, чем другие НПВП: 10,4% случаев против 21,2% при приеме диклофенака, 21,7% – кетопрофена, 18,6% – пироксикама [10].
В Научно-исследовательском институте ревматологии им. В.А. Насоновой проведено исследование безопасности нимесулида у больных с высоким риском развития осложнений со стороны желудочно-кишечного тракта [8]. Согласно плану исследования нимесулид (Нимесил) в дозе 200 мг назначался 20 больным, получавшим до начала исследования лечение по поводу язвы или множественных (более 10) эрозий желудка и/или двенадцатиперстной кишки, возникших на фоне приема других НПВП. Контрольная группа состояла из 20 пациентов, которым после заживления НПВП-гастропатии назначался диклофенак в дозе 100 мг (ректальные свечи).
Через два месяца наблюдения рецидив язвы зафиксирован у трети больных (33,3%), получавших диклофенак, и лишь у одного больного (5,6%), получавшего нимесулид (р < 0,05).
Данные, которые позволили бы сделать вывод о значительном повышении риска сердечно-сосудистых осложнений при использовании нимесулида, не получены.
Масштабное популяционное исследование, проведенное в Финляндии (33 309 эпизодов острого инфаркта миокарда, контрольная группа – 138 949 лиц без указанной патологии), показало, что на фоне приема нимесулида риск сердечно-сосудистых катастроф не выше, чем на фоне приема мелоксикама, набуметона и этодолака, коксибов и неселективных НПВП [11].
Анализ связи между развитием гепатотоксических реакций и приемом конкретных препаратов из группы НПВП продемонстрировал, что частота указанных осложнений при использовании нимесулида составила 35,3 на 100 тыс. пациенто-лет, что оказалось ниже, чем при использовании диклофенака – 39,2, кеторолака – 66,8 и ибупрофена – 44,6 на 100 тыс. пациенто-лет [12, 13].
Приведенные выше данные свидетельствуют о целесообразности использования нимесулида (Нимесила) в лечении АС. Препарат показал как высокую эффективность, так и относительную безопасность (по сравнению с традиционными НПВП) в отношении риска развития серьезных осложнений со стороны желудочно-кишечного тракта и сердечно-сосудистой системы [14].
В качестве дополнительного краткосрочного лечения при неэффективности или плохой переносимости/противопоказаниях для назначения НПВП могут быть использованы анальгетики, такие как парацетамол (500 мг четыре раза в сутки с интервалом до 3 часов) и трамадол (50 мг до четырех раз в сутки).
Системное применение глюкокортикостероидов как при аксиальной форме АС, так и при наличии периферического артрита не рекомендуется. Локальное введение глюкокортикостероидов показано при периферическом артрите, сакроилеите и энтезитах. Местное лечение препаратами данной группы высокоэффективно при остром иридоциклите.
В случае устойчивого, торпидного течения АС с высокой иммунологической активностью быстрый и положительный эффект может оказать пульс-терапия метилпреднизолоном (Солу-Медрол, Метипред) 500–1000 мг в течение одного – трех дней.
Базисная противовоспалительная терапия направлена на уменьшение проявлений иммунокомплексного механизма воспаления. Препаратами выбора при поражении периферических суставов считаются салазопроизводные – сульфасалазин. Лечебная доза этих препаратов составляет 2–3 г/сут. Для достижения эффекта они назначаются не менее чем на четыре – шесть месяцев. Затем переходят на поддерживающую дозу (0,5–1 г/сут), которая при хорошей эффективности принимается практически постоянно.
Влияние метотрексата, лефлуномида и сульфасалазина на замедление поражения позвоночника не доказано.
В случае высокой активности АС (BASDAI более 40 баллов) и в отсутствие эффекта от применения НПВП, сульфасалазина, глюкокортикостероидов назначаются ингибиторы ФНО-альфа (инфликсимаб, адалимумаб, этанерцепт, голимумаб) и ИЛ-17 (секукинумаб). Инфликсимаб при АС применяют в дозе 5 мг/кг массы тела в виде внутривенных инъекций. Через две и шесть недель после первого введения проводятся повторные инфузии в той же дозе, затем введения повторяются каждые восемь недель. Адалимумаб вводится подкожно в дозе 40 мг один раз в две недели. Этанерцепт также вводится подкожно в дозе 50 мг один раз в неделю. Голимумаб вводится подкожно в дозе 50 мг один раз в месяц. До начала и на протяжении всего периода лечения необходимо проводить рентгенографию легких и делать пробы Манту для исключения туберкулезной инфекции.
Отмечена высокая эффективность секукинумаба при АС – как у пациентов, ранее не получавших биологических агентов, так и у пациентов, для которых предшествующая терапия ингибиторами ФНО-альфа была неэффективной или плохо переносилась. Секукинумаб вводится подкожно по 300 мг один раз в две-три недели, начиная с восьмой недели – один раз в месяц. Препарат можно применять при беременности и в период лактации.
Для снятия мышечного спазма назначают миорелаксанты: толперизон – 100–150 мг/сут, тизанидин – 4–6 мг/сут.
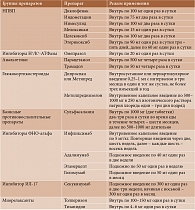
В таблице представлены рекомендуемые схемы фармакотерапии анкилозирующего спондилита [1].
При анкилозах тазобедренных суставов с функциональной недостаточностью третьей стадии проводится протезирование.
Заключение
Применение современных методов диагностики позволяет своевременно поставить диагноз АС и начать лечение, что способствует улучшению прогноза.
I.B. Belyayeva, V.I. Mazurov
North-Western State Medical University named after I.I. Mechnikov
Contact person: Irina Borisovna Belyayeva, belib@mail.ru
Ankylosing spondylitis (AS) is characterized by inflammatory injury of spinal joints paravertebral tissues and sacroiliac joints with ankylosing of invertebral joints and development of calcified spinal chords.
Such parameters as inflammatory back pain, HLA B27 positive marker, and revealed sacroileitis based on pelvic X-ray scan or sacroiliac joint MRI in STIR/T2 mode with fat suppression a great important in early diagnostics of spondylarthritis. Non-steroidal anti-inflammatory drugs (NSAIDs), analgesics, glucocorticosteroids, sulfasalazine, inhibitors of Tumor Necrosis Factor-alpha and Interleukin-17 are extensively used for AS medical treatment. Among NSAIDs, it is rational to use nimesulide (Nimesil) that combines high efficacy and relative safety (compared to routine drugs from this group) regarding a risk of developing serious complications in GI-tract and cardiovascular system.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.