Секукинумаб в лечении псориаза и псориатического артрита
- Аннотация
- Статья
- Ссылки
- English
Как правило, ПсА дебютирует через 7–12 лет от начала кожного процесса и приходится на возраст от 30 до 50 лет. Для ПсА характерно поражение периферических суставов, а также осевого скелета в виде аксиального спондилоартрита (аксСпА), который в 25–70% случаев проявляется сакроилиитом и/или спондилитом. АксСпА существенно ухудшает прогноз ПсА в частности и псориаза в целом, что связано как с большей распространенностью кожного процесса, так и с более тяжелым поражением суставов, большим количеством энтезитов и риском мутиляции. Установлено, что практически у половины пациентов аксСпА приводит к раннему развитию деструктивных изменений, которые могут стать причиной инвалидизации.
Решающая роль в своевременном выявлении ПсА принадлежит дерматологам, проводящим скрининг на наличие патологии. Однако процент недиагностированных случаев по-прежнему остается высоким.
В настоящее время для лечения ПсА используются нестероидные противовоспалительные препараты, базисные противовоспалительные препараты, генно-инженерные биологические препараты и внутрисуставные глюкокортикоиды.
Особый интерес представляют данные об эффективности ингибиторов интерлейкина 17, в частности секукинумаба, при ПсА и аксСпА.
В отделении дерматовенерологии Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского изучались эффективность и безопасность секукинумаба в лечении 22 взрослых пациентов со среднетяжелым и тяжелым псориазом, в том числе в сочетании с ПсА и аксСпА.
Как правило, ПсА дебютирует через 7–12 лет от начала кожного процесса и приходится на возраст от 30 до 50 лет. Для ПсА характерно поражение периферических суставов, а также осевого скелета в виде аксиального спондилоартрита (аксСпА), который в 25–70% случаев проявляется сакроилиитом и/или спондилитом. АксСпА существенно ухудшает прогноз ПсА в частности и псориаза в целом, что связано как с большей распространенностью кожного процесса, так и с более тяжелым поражением суставов, большим количеством энтезитов и риском мутиляции. Установлено, что практически у половины пациентов аксСпА приводит к раннему развитию деструктивных изменений, которые могут стать причиной инвалидизации.
Решающая роль в своевременном выявлении ПсА принадлежит дерматологам, проводящим скрининг на наличие патологии. Однако процент недиагностированных случаев по-прежнему остается высоким.
В настоящее время для лечения ПсА используются нестероидные противовоспалительные препараты, базисные противовоспалительные препараты, генно-инженерные биологические препараты и внутрисуставные глюкокортикоиды.
Особый интерес представляют данные об эффективности ингибиторов интерлейкина 17, в частности секукинумаба, при ПсА и аксСпА.
В отделении дерматовенерологии Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского изучались эффективность и безопасность секукинумаба в лечении 22 взрослых пациентов со среднетяжелым и тяжелым псориазом, в том числе в сочетании с ПсА и аксСпА.



Введение
Псориаз – хроническое воспалительное заболевание кожи мультифакториальной природы [1, 2], в 25–30% случаев сопровождающееся псориатическим артритом (ПсА) [3].
Псориатический артрит является гетерогенным, хроническим, прогрессирующим, воспалительным, серонегативным заболеванием суставов, позвоночника и связочного аппарата [4]. Риск развития ПсА повышается пропорционально длительности [5, 6] и распространенности кожного процесса, а также наличию поражения волосистой части головы, перианальной области, ногтей и увеита [7].
Согласно данным А.В. Gottlieb и соавт., в 75–84% случаев ПсА развивается через 7–12 лет от начала кожного процесса, преимущественно в возрасте 30–50 лет [8].
Для данной патологии характерно поражение периферических суставов (эрозии суставов, энтезиты, дактилиты и т.д.) и осевого скелета (аксиальный спондилоартрит (аксСпА), который в 25–70% случаев проявляется сакроилиитом и/или спондилитом) [9–11].
Аксиальный спондилоартрит чаще поражает мужчин [12]. В 80% случаев аксСпА проявляется утренней скованностью продолжительностью от 30 минут и болью в спине и/или шее, усиливающейся при длительном покое, особенно во второй половине ночи, и уменьшающейся при физической активности [12, 13]. Сакроилиит характеризуется летучими болями в пояснично-крестцовом сочленении и области ягодиц [14].
В 50% случаев аксСпА приводит к ранним деструктивным изменениям опорно-двигательного аппарата [15], которые могут стать причиной инвалидизации [16]. Так, V. Chandran и соавт. установили, что через пять и десять лет от начала аксСпА у 37 и 52% пациентов отмечалось развитие сакроилиита второй степени, сопровождавшееся нарушением подвижности шейного отдела позвоночника и утратой способности наклонять туловище [17].
Диагностика аксСпА основана на результатах клинического и рентгенологического исследований. У пациентов выявляются воспалительные и структурные изменения осевого скелета, в том числе сакроилиит, спондилит, синдесмофиты, оссификаты [13]. Маркером поражения осевого скелета и более тяжелого течения ПсА считается антиген HLA-B27 [18].
Для своевременного выявления ПсА показано проведение скрининга [13]. Тем не менее на сегодняшний день частота недиагностированных случаев достаточно велика. Согласно данным литературы, в 15,5% случаев артрит был диагностирован с задержкой на два – пять лет [19].
При диагностике аксСпА необходимо обращать внимание на наличие сакроилиита, в 73% случаев протекающего асимметрично [20, 21] и требующего рентгенологического обследования. Сакроилиит может сочетаться с периферическим артритом, в частности с энтезитом и дактилитом [13]. M. Haroon и соавт. указали на связь между асимметричным сакроилиитом при аксСпА и более высокой частотой эрозивных изменений периферических суставов [21].
Согласно данным V. Chandran и соавт., к факторам риска развития ассоциированного с ПсА поражения осевого скелета относятся распространенный характер псориаза, его дебют в молодом возрасте, тяжелый периферический артрит, наличие антигена HLA-B27 и повышение скорости оседания эритроцитов (СОЭ) [18]. Ученые также отметили связь рентгенологических изменений периферических суставов с повышенным риском развития аксиального ПсА [18].
Ряд авторов указывают на повышение риска развития аксСпА вследствие заболеваний, не связанных с псориатическим поражением костно-суставной системы. Прежде всего речь идет о воспалительных заболеваниях кишечника и увеите [22]. Так, воспалительные заболевания кишечника были обнаружены у 11% больных аксСпА и 2% пациентов с периферическим ПсА [23], увеит – у 33% и 6–7% соответственно. При этом у лиц с аксСпА мужского пола и более молодого возраста (до 34 лет) при наличии антигена HLA-B27 наблюдалась большая частота встречаемости увеита [24].
Аксиальный спондилоартрит существенно ухудшает прогноз ПсА в частности и псориаза в целом как в связи с большей распространенностью кожного процесса, так и в связи с более тяжелым поражением суставов (больше количество энтезитов и риск мутиляции) [25].
При аксСпА, так же как при псориазе, этиологический фактор воспаления в целом неизвестен. Важная роль в его патогенезе принадлежит активации Т-клеточного иммунитета в коже и синовиальных оболочках с последующей гиперпродукцией и дисбалансом цитокинов, таких как факторы некроза опухоли (ФНО) α и β, интерлейкины (ИЛ) 12, 23 и 17 [26].
Поскольку ПсА является междисциплинарной проблемой, его лечение осуществляется дерматологами и ревматологами. Согласно клиническим рекомендациям по лечению ПсА, разработанным Российским обществом дерматовенерологов и косметологов совместно с Ассоциацией ревматологов России в 2020 г., целями фармакотерапии служат достижение ремиссии или минимальной активности основных клинических проявлений заболевания, замедление или предупреждение рентгенологического прогрессирования, увеличение продолжительности и качества жизни пациентов, снижение риска развития коморбидных состояний [27].
В настоящее время при ПсА применяются нестероидные противовоспалительные препараты, базисные противовоспалительные препараты, генно-инженерные биологические препараты (ГИБП) и внутрисуставные глюкокортикоиды.
В России зарегистрирован целый ряд ГИБП для лечения ПсА. К ним относятся ингибиторы ФНО-α инфликсимаб, адалимумаб, этанерцепт, голимумаб и др., моноклональные антитела к ИЛ 12/23 устекинумаб и к ИЛ-17А секукинумаб.
Инфликсимаб и адалимумаб оказались более эффективными, чем этанерцепт, при ПсА с сопутствующей воспалительной патологией кишечника и рецидивирующим иритом [28], этанерцепт был менее эффективным при наличии кожных высыпаний [29], устекинумаб – недостаточно эффективным при аксСпА [30].
D. Baeten и соавт. установили, что ингибиторы ИЛ-17 могут быть эффективны при лечении аксиального ПсА [31], в том числе аксСпА [31, 32]. X. Baraliakos и соавт. в рамках многоцентрового плацебо-контролируемого двойного слепого исследования фазы IIIb также отметили высокую эффективность секукинумаба у пациентов с осевыми проявлениями ПсА [33].
Целью настоящего исследования стала оценка эффективности и безопасности секукинумаба (Козэнтикс) при псориазе и ПсА, в том числе с сопутствующим аксСпА.
Материал и методы
В отделении дерматовенерологии Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского (МОНИКИ) под наблюдением находилось 22 пациента со среднетяжелым и тяжелым псориазом, получавших курсовое лечение секукинумабом (препаратом Козэнтикс) от 28 до 52 недель. Среди них было 11 мужчин (50%) и 11 женщин (50%). Возраст пациентов варьировался от 20 до 66 лет, в среднем 43,7 ± 14,1 года. У 13 (59,1%) диагностирован вульгарный псориаз, у двух (9,1%) – экссудативный, еще у двух (9,1%) – генерализованный пустулезный, у пяти (22,7%) – псориатическая эритродермия. Псориатическая ониходистрофия имела место у 20 (90,9%) пациентов. Длительность болезни варьировалась от года до 48 лет.
Псориатическим артритом страдали 18 (81,8%) больных. Длительность ПсА – от года до 26 лет. Периферический ПсА выявлен у 17 (77,3%) больных. У трех (13,6%) обнаружены дактилиты, у 11 (50%) – энтезиты.
Аксиальный спондилоартрит установлен у 12 (54,6%) лиц: у десяти (83,3%) – сакроилиит, у пяти (41,7%) – спондилит.
В каждом случае заболевание носило торпидный характер.
Из 22 больных 18 (81,8%) ранее получали курсы терапии метотрексатом, неотигазоном, системную глюкокортикоидную и ПУВА-терапию. У 12 (54,6%) был гормонозависимый псориаз.
Ранее применяемая системная терапия базисными противовоспалительными препаратами и системными глюкокортикоидами была недостаточно эффективна у 16 (72,7%) пациентов. У двух (9,1%) больных метотрексат был отменен в связи с развитием лекарственно-индуцированного гепатита. ГИБП ранее получали три (13,6%) пациента: два – нетакимаб, один – иксекизумаб. В двух случаях прекращение приема препаратов было связано с нарушением пациентами графика их введения (увеличение межинъекционного интервала до трех и пяти месяцев) и последующим развитием генерализованного пустулезного псориаза и аксСпА, в одном – с невозможностью дальнейшего самостоятельного приобретения препарата ввиду высокой стоимости.
Лечение секукинумабом (Козэнтикс) проводилось по следующей схеме: инициация – четыре инъекции в дозе 300 мг/нед подкожно, далее – по одной инъекции в дозе 300 мг один раз в четыре недели.
Монотерапию препаратом Козэнтикс получали 12 (54,5%). Шесть (27,3%) больных сочетали Козэнтикс с метотрексатом, один (4,6%) – с лефлуномидом. Назначение трем (13,6%) пациентам преднизолона было обусловлено генерализованным пустулезным псориазом и эритродермией.
Тяжесть заболевания и эффективность лечения оценивались с помощью PASI (индекс оценки площади поражения и тяжести псориаза), BASDAI (Батский индекс активности анкилозирующего спондилита), DLQI (дерматологический индекс качества жизни) при первичном осмотре и на 12-й, 16-й и 28-й неделях терапии.
Результаты
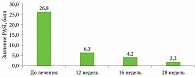
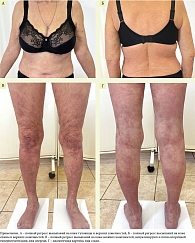
Перед началом лечения значения PASI варьировались от 10,0 до 58,2 балла, в среднем – 26,8 ± 14,1 балла. Полный или практически полный регресс высыпаний (PASI 98–100) к 28-й неделе лечения отмечен в 19 (86,4%) случаях: в одном (5,3%) случае – на пятой неделе, в пяти (26,3%) – на восьмой, в 13 (68,4%) – на 15-й. В трех (13,6%) случаях к 28-й неделе терапии был достигнут PASI 75 (рис. 1 и 2).
Снижение величины PASI к 28-й неделе терапии свидетельствовало о высокой эффективности секукинумаба при тяжелом и среднетяжелом псориазе (p < 0,01).
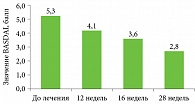
Значения BASDAI у 18 больных ПсА перед началом лечения варьировались от 1,4 до 8,0 балла, в среднем – 5,4 ± 2,3 балла. Умеренная активность поражения позвоночника (BASDAI более 1,3, но менее 2,1 балла) отмечена у трех пациентов, высокая (BASDAI более 2,1, но менее 3,5 балла) – у двух, очень высокая (BASDAI более 3,5 балла) – у 13 больных (рис. 3 и 4).
На протяжении 28 недель терапии секукинумабом наметилась выраженная тенденция к снижению величины BASDAI (p = 0,05). В результате количество пациентов с высокой и очень высокой активностью патологического процесса снизилось с 15 до 9, с низкой активностью заболевания увеличилось с ноля до пяти (см. рис. 3 и 4).
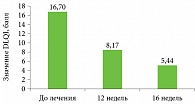
Значения DLQI оценивались у всех 22 получавших секукинумаб. До начала терапии они варьировались от 5 до 30 баллов, в среднем – 19,0 ± 6,2 балла. У одного пациента заболевание оказывало незначительное влияние на качество жизни (DLQI – 5 баллов), у 1 – умеренно (DLQI – 9 баллов), у 11 – очень сильно (DLQI – 11–20 баллов), а у девяти – чрезвычайно сильно (21–30 баллов) (рис. 5 и 6).
На фоне терапии зафиксировано достоверное снижение DLQI (p < 0,01). Количество пациентов с чрезвычайно сильным влиянием заболевания на качество жизни сократилось с 11 до одного. Не ощущали влияния болезни на качество жизнь 16 лиц (DLQI – 0–1 балл) (см. рис. 5 и 6).
Далее приведен клинический пример высокой эффективности секукинумаба.
Больная Ш., 61 год. Длительность заболевания составляет около 25 лет, когда на фоне течения рассеянного энцефаломиелита пациентка отметила появление множественных розоватых шелушащихся и склонных к слиянию высыпаний в области волосистой части головы и конечностей и дерматологом по месту жительства был впервые диагностирован вульгарный псориаз, по поводу которого назначена наружная терапия с кратковременным улучшением. Через 11 лет от начала болезни на фоне нервного стресса кожный процесс принял упорный характер, появилась боль в суставах кистей и стоп, в связи с чем пациентке вводили внутримышечно инъекции метотрексата в дозе 10 мг/нед в течение двух месяцев с незначительным эффектом. Применение трех курсов метотрексата в дозе 10–15 мг/нед также не привело к улучшению, боли в суставах усилились. Кроме того, появились постоянная боль в левом тазобедренном суставе, затрудняющая ходьбу, утренняя скованность в суставах кистей и стоп продолжительностью до одного часа, деформация суставов кистей, боль в спине, усиливающаяся во второй половине ночи, и утренняя скованность в спине продолжительностью до одного часа. В связи с этим в течение последних семи лет ежедневно принимала Найз в дозе 50–100 мг/сут.
В феврале 2021 г. из-за выраженного нарушения функции левого тазобедренного сустава и болевого синдрома было проведено эндопротезирование.
В начале лета 2021 г. из-за обострения кожно-суставного процесса пациентка Ш. была госпитализирована в отделение дерматовенерологии МОНИКИ.
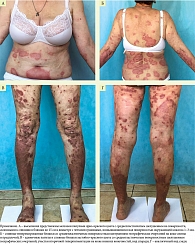
При осмотре кожный процесс распространенный, подостровоспалительный, расположенный в области туловища, конечностей и волосистой части головы. Высыпания мономорфные, представлены папулами и бляшками ярко-розового цвета диаметром от 0,5 до 15,0 см с серо-белыми чешуйками на поверхности округлой и неправильной формы с четкими границами и периферическим венчиком гиперемии (рис. 7).
Псориатическая триада положительная. Ногтевые пластины кистей и стоп изменены по типу масляного пятна и наперстка.
PASI – 16,5 балла, BSA – 70%, PGA – 4 балла, NAPSI – 40 баллов, BASDAI – 8,8 балла, mPEST – 6 баллов, DLQI – 30 баллов.
При осмотре конечностей: мутилирующий артрит с множественными подвывихами в проекции проксимальных межфаланговых суставов кистей, припухлость в проекции лучезапястных суставов, второго, третьего и четвертого пястно-фаланговых суставов, плюснефаланговых суставов второго, третьего и четвертого пальцев. Симптом сжатия стоп положительный. Пальпация ахиллова сухожилия болезненная, стопы деформированы. При пальпации спины – боль в нижнегрудном и поясничном отделах позвоночника. Тест Шобера – 4 см, повороты головы в сторону на 65º. Число припухших суставов – 8, число болезненных суставов – 12, общая активность заболевания пациентом – 7. DAPSA 28 (оценка активности заболевания при ПсА) – 42,9 балла – высокая активность.
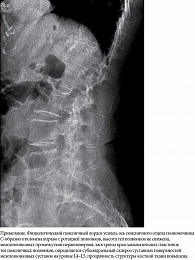
Рентгенография пояснично-крестцового отдела позвоночника: в двух проекциях рентгенологическая картина остеохондроза поясничного отдела позвоночника, спондилоартроз на уровне L4–L5, правосторонний сколиоз поясничного отдела позвоночника, остеопороз (рис. 8).
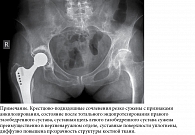
Рентгенография таза: рентгенологическая картина двустороннего сакроилиита (стадия анкилоза), левосторонний коксартроз первой-второй стадий (возможно, вторичного характера), состояние после тотального эндопротезирования правого тазобедренного сустава, остеопения (рис. 9).
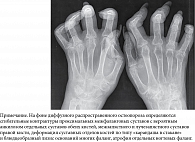
Рентгенография кистей: рентгенологическая картина псориатического полиартрита (рис. 10).
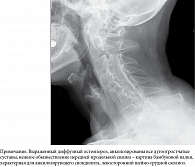
Рентгенография шейного отдела позвоночника: признаки анкилозирующего псориатического артрита (рис. 11).
Результаты лабораторного исследования: серореакции на сифилис, ВИЧ, гепатиты В и С – отрицательно.
Общий анализ крови: гемоглобин – 86 г/л, анизоцитоз, гипохромия, СОЭ – 75 мм/ч, остальные показатели в пределах нормы.
Анализ мочи (общий): показатели в пределах нормы.
Биохимический анализ крови: С-реактивный белок – 31,75 мг/л, железо – 3,40 мкмоль/л, ревматоидный фактор – отрицательный, остальные показатели в пределах нормы.
Коагулограмма крови: фибриноген по Клаусу – 5,36 г/л, остальные показатели в пределах нормы.
Электрокардиография: нормальное направление электрической оси сердца, повышение электрической активности левого желудочка, вероятно его гипертрофия, морфология Т-зубца в отведениях V3–V6 коронарного типа.
Эхокардиография: атеросклероз восходящего отдела аорты и структур аортального клапана.
Фиброэзофагогастродуоденоскопия: грыжа пищеводного отверстия диафрагмы, поверхностная гастропатия, признаки дискинезии желчевыводящих путей.
Ультразвуковое исследование органов брюшной полости, почек: калькулезный нефункционирующий желчный пузырь, поясничная дистопия правой почки.
В связи с сопутствующей желчнокаменной болезнью пациентка была консультирована абдоминальным хирургом, по заключению которого проведение оперативного вмешательства по поводу желчнокаменной болезни возможно рассмотреть с учетом клинических проявлений не ранее чем через год после проведенного эндопротезирования. Было рекомендовано динамическое наблюдение, наблюдение у гастроэнтеролога.
В связи с предполагаемым диагнозом псориатического артрита пациентка была консультирована ревматологом, который поставил следующий диагноз: псориатический спондилит, HLA-B27 (под вопросом), артрит, поздняя стадия, высокая активность заболевания (DAPSA 28 – 42,9 балла), двусторонний сакроилиит (Re четвертой стадии), мутилирующий артрит кистей и стоп, внеаксиальные поражения (дактилит, энтезит в проекции ахиллова сухожилия слева), функциональная недостаточность суставов третьей степени.
В связи с высокой активностью заболевания (DAPSA 28 – 42,9 балла), ухудшением общего состояния, рентгенологической картины, прогрессированием заболевания, состоянием после эндопротезирования тазобедренного сустава ревматологом была рекомендована инициация терапии ГИБП.
На основании клинической картины, лабораторных, инструментальных данных пациентке установлен диагноз: распространенный вульгарный псориаз, прогрессирующая стадия, псориатический спондилит, HLA-B27 (под вопросом), артрит, поздняя стадия, высокая активность заболевания, двусторонний сакроилиит (Re четвертой стадии), мутилирующий артрит кистей и стоп, внеаксиальные поражения (дактилит, энтезит в проекции ахиллова сухожилия слева), функциональная недостаточность суставов третьей степени.
Сопутствующие заболевания: гипертоническая болезнь первой степени, второй риск сердечно-сосудистых осложнений, состояние после эндопротезирования правого тазобедренного сустава, киста Бейкера справа, желчнокаменная болезнь, остеопороз, состояние после перенесенного рассеянного энцефалита.
Было также проведено необходимое для назначения ГИБП обследование.
Обзорная рентгенография грудной клетки: данных за инфильтративный процесс в легких не получено.
Консультация фтизиатра: на рентгенограмме органов грудной клетки очаговых и инфильтративных изменений легких не выявлено. Диаскин-тест (папула – ноль, гиперемия – ноль) отрицательный. Данных за активный туберкулезный процесс не получено.
С учетом торпидности и тяжести поражения кожи и костно-суставной системы назначен секукинумаб (препарат Козэнтикс) в дозе 300 мг/нед подкожно четыре введения.
После инициации терапии пациентка Ш. отметила уменьшение суставных болей, в связи с чем стала реже принимать нестероидные противовоспалительные препараты. На восьмой неделе лечения получен ответ по PASI 100. Через 16 недель терапии пациентка прекратила прием нестероидных противовоспалительных препаратов.
Через полгода от начала терапии (28-я неделя, явка для десятого введения препарата) отмечалась положительная динамика: отсутствие новых высыпаний, PASI 100, BSA – 0%, NAPSI – 30 баллов, PGA – 2 балла, BASDAI – 1,2 балла, DLQI – 0 баллов (рис. 12).
Консультация ревматолога в динамике: артрит второго и третьего проксимальных межфаланговых суставов правой кисти, припухлость второго и третьего пястно-фаланговых суставов левой кисти, симптом сжатия кистей и стоп отрицательный, множественные подвывихи в проекции проксимальных межфаланговых суставов кистей рук (последствия мутилирующего артрита), деформация пальцев стоп, болезненность при пальпации грудного и поясничного отделов позвоночника, симптом Томайера – 25 см, симптом Шобера – 5 см, симптом Отта – 5 см, ротация в шейном отделе позвоночника – 75º, расстояние «козелок – стена» – 17 см, боковое сгибание в поясничном отделе позвоночника – 7 см, экскурсия грудной клетки – 4,5 см, максимальное расстояние между лодыжками – 75 см, BASMI – 3 балла, ВАШ (визуально-аналоговая шкала) – 15 мм, число припухших суставов – 2, число болезненных суставов – 4, DAPSA 28 – 12 баллов.
Таким образом, на фоне терапии секукинумабом в дозе 300 мг подкожно отмечалась положительная динамика в виде достижения низкой активности заболевания, уменьшения выраженности артрита, исчезновения энтезитов, увеличения подвижности позвоночника.
Кроме того, в каждом конкретном случае лечение переносилось удовлетворительно, побочных эффектов не зафиксировано.
Заключение
Ингибитор ИЛ-17 секукинумаб (препарат Козэнтикс) продемонстрировал клиническую эффективность и безопасность при лечении больных ПсА со множеством сопутствующих аксСпА проявлений, включая псориаз, энтезит, синовит, эрозии костей и боль, что может свидетельствовать о важной роли ИЛ-17А в патогенезе псориаза.
Исследования эффективности секукинумаба при ПсА важно продолжить с учетом влияния ИЛ-17А на иммунные реакции в костно-суставном аппарате.
Yu.V. Molochkova, MD, PhD, M.S. Petrova, V.A. Molochkov, MD, PhD, Prof.
Moscow Regional Research and Clinical Institute
Contact person: Yuliya V. Molochkova, yulia.molochkova@yandex.ru
Psoriasis is a chronic inflammatory skin disease of multifactorial nature, in 25–30% of cases accompanied by psoriatic arthritis (PsA). As a rule, PsA debuts after 7–12 years from the beginning of the skin process and falls at the age of 30 to 50 years. PsA is characterized by damage to the peripheral joints, as well as the axial skeleton in the form of axial spondyloarthritis (ASA), which in 25–70% of cases is manifested by sacroiliitis and/or spondylitis. ASA significantly worsens the prognosis of PsA in particular and psoriasis in general, which is associated with both a greater prevalence of the skin process and more severe joint damage, a large number of enteritis and the risk of mutation. It was found that in almost half of the patients, ASA leads to the early development of destructive changes that can cause disability.
A crucial role in the timely detection of PsA belongs to dermatologists screening for the presence of pathology. However, the percentage of undiagnosed cases remains high.
Currently, nonsteroidal anti-inflammatory drugs, basic anti-inflammatory drugs, genetically engineered biological drugs and intra-articular glucocorticoids are used for the treatment of PsA.
Of particular interest are the data on the effectiveness of interleukin 17 inhibitors, in particular secukinumab, in PsA and ASA.
The effectiveness and safety of secukinumab in the treatment of 22 adult patients with moderate and severe psoriasis, including in combination with PsA and ASA, were studied in the Department of Dermatovenerology of Moscow Regional Research and Clinical Institute.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.