Результаты многоцентрового исследования по оценке эффективности и переносимости Пиаскледина
- Аннотация
- Статья
- Ссылки
Остеоартроз – группа патогенетически близких заболеваний различной этиологии, характеризующихся однотипными морфологическими и клиническими проявлениями и исходами. В основе заболевания лежит прогрессивная потеря гиалинового хряща и ремоделирование субхондральной кости. Несмотря на то что основными признаками ОА являются дегенеративные изменения хрящевой ткани, для данного заболевания характерно воспаление в тканях сустава, которое приводит к развитию рецидивирующего вторичного (реактивного) синовита, хондрита, остеита и периартрита. Персистирующий воспалительный процесс, в свою очередь, способствует прогрессированию морфологических изменений, в том числе деградации гиалинового хряща.
Реальные показатели распространенности ОА трудно оценить. При этом заболевании выраженность клинической симптоматики не всегда соответствует структурным изменениям суставов по данным рентгенографии, магнитно-резонансной томографии, ультразвуковых методов, а также с макро- и микроскопическими морфологическими показателями, полученными при изучении биоптатов синовиальной оболочки или артроскопии. Так, хорошо известно, что многие рентгенопозитивные больные не имеют клинических симптомов. При этом следует отметить, что ОА, безусловно, лидирует по своей распространенности среди других ревматических болезней [1]. В целом он встречается у 10% населения, при этом 50% населения старше 50 лет имеют клинические и/или рентгенологические симптомы этого заболевания. В возрасте старше 70 лет рентгенологические признаки ОА находят у 90% женщин. При остеоартрозе прежде всего поражаются «нагрузочные» (коленные и тазобедренные) суставы, что значительно ухудшает качество жизни больных и представляет серьезную медико-социальную проблему. Хотя ОА непосредственно не влияет на жизненный прогноз, он является одной из основных причин преждевременной потери трудоспособности и инвалидности, уступая в этом отношении только ишемической болезни сердца [2]. По данным ВОЗ, только ОА коленных суставов находится на четвертом месте среди основных причин нетрудоспособности у женщин и на восьмом – у мужчин. Существует точка зрения, согласно которой у женщин наблюдается снижение продолжительности жизни по мере увеличения числа пораженных суставов, хотя эти данные требуют дальнейшего детального изучения.
В настоящее время расшифрованы основные молекулярные механизмы ОА. В инициации патологических изменений при первичном ОА и их прогрессировании решающее значение имеет гиперпродукция хондроцитами и другими клетками металлопротеиназ (МП), включая коллагеназы (МП 1, 8, 13), аггреканазы (ADAMTS4 и -5), стромелизин-1 (МП 3) и желатиназы (МП 2, 9) [3]. Большое значение в этом процессе придается интерлейкину-1β (ИЛ-1β), который экспрессируется в пораженном остеоартрозом хряще и стимулирует выработку МП [4]. Кроме того, этот цитокин непосредственно влияет на темпы хрящевой деструкции, ингибируя синтез компонентов матрикса (аггрекана и коллагена II типа) и стимулируя продукцию провоспалительных цитокинов (ИЛ-6, ИЛ-8). В сложном многоступенчатом каскаде различных изменений задействованы также простагландин Е2, оксид азота и другие биологически активные вещества. Вышеприведенные нарушения способствуют недостаточному синтезу хондроцитами протеогликанов и фрагментации протеогликановых агрегатов, которые являются основными патологическими изменениями при ОА.
Раскрытие молекулярных механизмов деградации хряща и уточнение причин, ведущих к персистирующему воспалению непосредственно в тканях сустава, послужили основанием для разработки не только симптом-модифицирующих (быстродействующих), но и структурно-модифицирующих (медленнодействующих) препаратов, активно воздействующих на течение и темпы дальнейшего прогрессирования заболевания. Целесообразность такого подхода обусловлена тем, что даже у больных с далеко зашедшей стадией ОА хондроциты способны синтезировать межклеточный матрикс [3]. Эффективная медленнодействующая симптоматическая терапия направлена на стимуляцию хондробластами и хондроцитами синтеза макромолекул межуточного вещества гиалинового хряща, в частности протеогликанов, снижение активности МП и провоспалительных цитокинов, активацию анаболических процессов в матриксе хряща и создание условий для формирования устойчивого хряща. Кроме того, она увеличивает резистентность хондроцитов к негативному воздействию как провоспалительных цитокинов, так и большинства нестероидных противовоспалительных препаратов (НПВП), обладающих хондронегативными свойствами.
Для уменьшения темпов прогрессирования ОА предложено большое количество различных препаратов. Наиболее широкое применение нашли структурные аналоги хряща, к которым относятся, прежде всего, глюкозамин сульфат и хондроитин сульфат. В долгосрочных контролируемых рандомизированных исследованиях доказано их структурно-модифицирующее действие. Все большее применение находят комбинированные препараты, в состав которых входит хондроитин сульфат в комбинации с глюкозамин сульфатом или глюкозамин гидрохлоридом. Положительное действие этих препаратов у больных ОА также не вызывает сомнений. Интересным препаратом является диацериин – ингибитор интерлейкина-1. Препараты гиалуроновой кислоты (Гиалган, Остенил и др.) не только улучшают механическую функцию пораженных суставов, но и тормозят дальнейшее их прогрессирование.
Согласно рекомендациям ЕULAR (2003, 2006 гг.), только 5 препаратов обладают структурно-модифицирующими свойствами: глюкозамин сульфат, хондроитин сульфат, диацериин, гиалуроновая кислота, а также неомыляемые соединения масел авокадо и бобов сои [5]. Что же касается других препаратов, ранее относящихся к хондропротекторам, то они обладают анальгетической и противовоспалительной активностью, но их влияние на темпы прогрессирования ОА остается спорным.
Одним из основных структурно-модифицирующих препаратов является Пиаскледин 300. Он представляет собой неомылямые соединения масел авокадо и бобов сои в соотношении 1/3:2/3, полученные из экстрактов этих продуктов после молекулярной дистилляции [6]. В состав Пиаскледина 300 входит также комплекс активных фитостеролов (γ-токоферол и β-ситостерол). Препарат выпускается только Laboratories Expanscience (Франция) и не имеет аналогов.
Одним из основных механизмов действия Пиаскледина 300 является его влияние на экспрессию цитокинов [3, 6, 7, 8]. Пиаскледин ингибирует ИЛ-1, предотвращая его повреждающее действие на хондроциты и синовиоциты, стимулирует синтез коллагена и протеогликанов. Он угнетает ИЛ-1β-cтимулированный синтез МП (коллагеназы и стромелизина) хондроцитами, экспрессию ИЛ-6 и ИЛ-8, а также простагландина Е2, что обусловливает как антикатаболическое действие на матрикс хряща, так и ингибицию «вторичного» воспаления в тканях сустава, а именно: в синовиальной оболочке, энтезах, субхондральной кости и непосредственно в гиалиновом хряще. В эксперименте было отмечено, что неомыляемые соединения масел авокадо и бобов сои обладают превентивным действием на развитие посттравматического ОА и могут стимулировать процесс восстановления хряща.
Биологические эффекты Пиаскледина 300:
- повышает экспрессию трансформирующих факторов роста (TGF-β1 и TGF-β2);
- повышает экспрессию ингибитора активации плазминогена-1 (РАI-1);
- стимулирует синтез протеогликанов;
- ингибирует ИЛ-1;
- угнетает синтез хондроцитами коллагеназы, стромелизина;
- ингибирует стимулирующее действие ИЛ-1β на экспрессию ИЛ-6, ИЛ-8 и простагландина E2 (PgE2);
- угнетает ИЛ-1β-cтимулированный синтез МП (коллагеназы и стромелизина) хондроцитами;
- стимулирует синтез коллагеновых волокон в культуре хондроцитов;
- оказывает превентивное действие на развитие посттравматического остеоартроза у экспериментальных животных.
Однако помимо влияния на синтез и высвобождение провоспалительных цитокинов, простагландинов и активных форм кислорода, что свойственно также некоторым другим структурно-модифицирующим препаратам, Пиаскледин 300 имеет характерные фармакологические особенности. В частности, он повышает экспрессию трансформирующего фактора роста β1 (TGF-β1), трансформирующего фактора роста β2 (TGF-β2), а также ингибитора плазминогена-1 (PAI-1) [6]. Трансформирующие факторы роста являются цитокинами, которые синтезируются хондроцитами и остеобластами. Они активно влияют на синтез макромолекул межклеточного вещества суставного хряща – протеогликанов и коллагена второго типа. С одной стороны, TGF-β обладает анаболическим эффектом и является одним из самых мощных стимуляторов синтеза матрикса суставного хряща, с другой – тормозит его деградацию, блокируя экспрессию тканевых и плазменных МП и угнетая экспрессию рецепторов, чувствительных к ИЛ-1. Что касается PAI-1, то он снижает продукцию плазминогена, который опосредованно принимает участие в повреждении хряща путем стимуляции МП (коллагеназ), а также путем прямого воздействия на хрящ посредством активации деградации протеогликанов.
Симптом-модифицирующий эффект Пиаскледина доказан результатами многочисленных контролируемых исследований [9–11]. В рандомизированном двойном слепом плацебоконтролированном мультицентровом исследовании, включавшем 164 больных с ОА коленных и тазобедренных суставов, назначалась стандартная доза препарата (300 мг/сут) [7]. Длительность терапии составляла 6 месяцев, затем больных наблюдали еще в течение двух месяцев. На фоне проводимой терапии отмечалось достоверное снижение интенсивности боли в суставах и функционального индекса (в 1,58 и 1,42 раза соответственно), а также достоверное улучшение глобальной оценки пациентом своего состояния. 57% больных основной группы смогли отказаться от приема НПВП в связи со значительным уменьшением интенсивности болей в суставах или их полным прекращением. В этом исследовании более значимый положительный эффект терапии наблюдался у больных с коксартрозом, чем у пациентов с гонартрозом. Достигнутая положительная динамика основных клинических показателей заболевания сохранялась в течение изучаемого 2-месячного периода наблюдения, что подтверждает наличие у Пиаскледина 300 последействия и кумулятивных свойств.
Аналогичный симптом-модифицирующий эффект был получен и в исследовании, проведенном F. Вlotman и соавт. [10]. В этом исследовании была выявлена более яркая динамика cубъективной симптоматики ОА, включая и функциональный индекс Лекена, что позволило в большинстве случаев отменить ежедневный прием НПВП. В исследовании Т. Аppelbооm и соавт. изучали сравнительную эффективность и переносимость различных доз Пиаскледина у 260 больных с гонартрозом [11]. Длительность терапии составила 3 месяца. Эффективность Пиаскледина оказалась примерно одинаковой при приеме 300 и 600 мг/сут и достоверно выше по сравнению с плацебо. На фоне приема Пиаскледина удалось сократить в 2 раза и более суточное потребление НПВП у 71% больных, причем этот показатель оказался одинаковым у больных, принимавших как 300, так и 600 мг/сут. Переносимость двух доз Пиаскледина была хорошей и схожей с переносимостью плацебо. Эти данные демонстрируют не только отчетливый симптом-модифицирующий эффект Пиаскледина, но и целесообразность применения его низких доз.
По данным многочисленных исследований, нежелательные явления при приеме Пиаскледина немногочисленны и включают диспептические нарушения и боли в верхней половине живота, которые развиваются в основном в первые 1–1,5 месяца его приема. Частота побочных эффектов не превышала таковую при приеме плацебо. В редких случаях отмечались общая слабость, головная боль, кожная сыпь. Однако эти побочные реакции могли быть связаны не с приемом Пиаскледина, а с использованием НПВП или анальгетиков, которые назначали больным при апробации Пиаскледина. Анализ данных 4 рандомизированных испытаний, в которых принял участие 421 больной, продемонстрировал высокий уровень безопасности Пиаскледина. Частота нежелательных явлений колебалась от 9 до 15%. Чаще всего наблюдалась желудочно-кишечная токсичность, которая проявлялась болями в верхней половине живота, тошнотой, диареей, вздутием живота, но только 13 из 421 пациента прекратили лечение в связи с нежелательными явлениями, что составляет всего 3%.
Структурно-модифицирующий эффект Пиаскледина отчетливо продемонстрировали результаты мультицентрового рандомизированного двойного слепого плацебоконтролированного исследования, которое полностью соответствовало строгим требованиям, предъявляемым к таким работам [12]. В исследование были включены 163 больных с одно- или двусторонним коксартрозом I–III cтадии по Kellgren − Lawrence. У всех больных была постоянная боль в тазобедренных суставах на протяжении минимум 6 месяцев и альгофункциональный индекс Лекена ≥ 4. Основным критерием включения являлось сужение щели тазобедренных суставов по данным рентгенографии.
Все больные были разделены на две группы. Больные первой группы, которая включала 85 человек, принимали 300 мг/сут Пиаскледина на протяжении всего периода исследования, а остальные (78 человек) составили контрольную группу и принимали плацебо. Больные как основной, так и контрольной групп могли использовать НПВП по собственному усмотрению при наличии болей в суставах. Исследуемые группы были сопоставимы по возрасту, полу, весу, росту, стадии ОА, длительности заболевания, индексу Лекена, выраженности спонтанной боли. В обеих группах в целом не было выявлено существенного различия в динамике сужения суставной щели – наиболее важного показателя структурно-модифицирующей активности изучаемого препарата. Однако у больных с исходной шириной суставной щели менее 2 мм на фоне лечения Пиаскледином наблюдалось в 2 раза менее выраженное дальнейшее ее сужение по сравнению с группой контроля (0,24 мм и 0,47 мм соответственно).
Таким образом, по данным литературы, Пиаскледин 300 обладает достоверной симптом-модифицирующей и структурно-модифицирующей активностью у больных ОА коленных и тазобедренных суставов.
Нами также проведено изучение эффективности и переносимости Пиаскледина 300. На первом этапе в открытом пилотном исследовании проводилась клиническая оценка этого препарата в 8 центрах, расположенных в различных регионах России. В исследование были включены амбулаторные или стационарные больные любого возраста с первичным ОА коленного или тазобедренного сустава, а также с полиостеоартрозом. У всех больных наблюдались клинически значимые проявления заболевания, при этом интенсивность боли в суставах составляла не менее 30 мм по визуальной аналоговой шкале (ВАШ), а индекс тяжести гонартроза или коксартроза соответствовал 5 и более баллам по Лекену. Кроме того, все больные нуждались в применении НПВП на протяжении последнего месяца. Критерием включения также являлось прекращение приема любых препаратов с хондропротективной активностью за 3 месяца до начала исследования. Критерии исключения: вторичный ОА и клинически латентное течение заболевания, наличие обострения язвенной болезни желудка или 12-перстной кишки, гепатоцеллюлярной и почечной недостаточности, а также тяжелое течение других острых и хронических заболеваний.
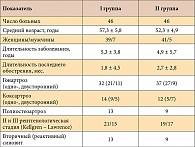
Всего в исследование вошли 440 больных, из них 302 – с гонартрозом, 84 – с коксартрозом и 54 – с полиостеоартрозом. У 47 больных наблюдалась симптоматика вторичного (реактивного) артрита коленных суставов. Возраст больных колебался от 39 до 82 лет (средний возраст составил 59,8 года). Длительность заболевания составляла от 2 до 40 лет. Рентгенологическая стадия ОА по Kellgren – Lawrence у 15,3% соответствовала I, у 65,1% – II и у 19,6% – III. У всех больных наблюдались умеренные и интенсивные боли в суставах (не менее 30 мм ВАШ), и все они нуждались в приеме НПВП. Длительность терапии у 410 больных составила 6 месяцев и у 30 – 3 месяца. Суточная доза Пиаскледина составляла 300 мг (1 капсула). Контроль основных параметров терапии осуществлялся через 1 и 3 месяца непрерывной терапии, а при 6-месячном курсе приема препарата – через 1, 3 и 6 месяцев.
Эффективность терапии оценивалась по динамике интенсивности боли в покое и при движении (ВАШ), длительности утренней скованности (минуты) и ее интенсивности (ВАШ), динамике суммарного индекса Лекена и функциональной недостаточности (WOMAC), суточной потребности в НПВП, общей оценке эффективности лечения пациентом и врачом. Переносимость и безопасность Пиаскледина 300 оценивали с учетом возникновения и выраженности возможных нежелательных явлений препарата.
Положительная динамика основных субъективных симптомов ОА наблюдалось уже к концу первого месяца лечения. Так, боль при ходьбе по ровной поверхности уменьшилась в среднем в 0,9 раза и боль в покое – в 1,3 раза. Также была отмечена существенная динамика функционального индекса WOMAC. Однако не было выявлено достоверной динамики таких показателей, как интенсивность боли при ходьбе по лестнице вниз и вверх или интенсивность боли в ночные часы. У преобладающего большинства больных спустя 14–19 дней от начала терапии разрешились явления вторичного (реактивного) артрита.
К концу третьего месяца непрерывной терапии положительная динамика основных показателей ОА стала еще более выраженной, включая интенсивность суставной боли при ходьбе по лестнице и интенсивность «стартовой» боли. Наблюдалось достоверное улучшение суммарного функционального индекса Лекена. Так, до начала терапии он составлял 7,5 балла, после первого месяца лечения − 4,7, а через 3 месяца – 3,4. Длительность утренней скованности уменьшилась в 3 раза по сравнению с исходным уровнем (27 и 11 мин.), а ее интенсивность – в 2 раза (38 и 19 мм ВАШ). Еще более значимые изменения произошли к концу шестого месяца лечения, хотя их динамика не была столь выраженной, как в первые три месяца. Например, если показатель скованности по WOMAС до лечения составлял 95,9, то к началу четвертого месяца он снизился до 53,8, а к шестому месяцу – до 44,7. Что же касается функционального индекса, то до начала терапии он составлял 902,0 балла, а после трех и шести месяцев 521,05 и 442,9 соответственно.
В целом общая оценка эффективности Пиаскледина 300 врачом после трех месяцев терапии соответствовала значительному улучшению у 16,3% больных, улучшению – у 73,3% и отсутствию эффекта – у 10,4%. Общая оценка эффективности терапии пациентом практически совпадала с мнением врача. К концу первых шести месяцев терапии значительное улучшение было отмечено у 19,5% больных, а отсутствие терапевтической активности − у 8,7%.
На втором этапе изучения Пиаскледина 300 проведена более детальная оценка его влияния на основные проявления ОА, а также переносимость и безопасность препарата в открытом рандомизированном исследовании в двух параллельных группах. В зависимости от проводимой терапии все больные были разделены на две группы (табл. 1). Первую (основную) группу составили больные, которые наряду со стандартной дозой Пиаскледина (300 мг/сут – 1 капсула во время еды) принимали НПВП. Больных II (контрольной) группы лечили только НПВП. Длительность терапии составила 6 месяцев. По условиям испытания больные I и II групп могли принимать любые НПВП в дозировке, эквивалентной 100 мг диклофенака. Чаще всего применялся диклофенак, реже – ибупрофен, нимесулид, мелоксикам (Мовалис) и еще реже – другие препараты.
Больные обеих групп были рандомизированы по основным параметрам заболевания, в частности по полу, возрасту, длительности заболевания, локализации процесса, рентгенологической стадии ОА. Однако по некоторым показателям полной рандомизации не было. Так, в I группе оказалось больше больных с генерализованным ОА и с явлениями синовита, в то время как во II группе преобладали больные с гонартрозом и с более длительным периодом последнего обострения. Наличие вторичного (реактивного) синовита позволяло более адекватно оценить противовоспалительный эффект Пиаскледина. Помимо ОА у пациентов наблюдались и другие заболевания. В основной группе наиболее часто встречались хронический гастрит или язвенная болезнь вне обострения (9 больных), реже – гипертоническая болезнь (7) и ишемическая болезнь сердца (6) и еще реже – другие хронические заболевания органов пищеварения (колит, холецистит). У одной больной имел место хронический пиелонефрит.
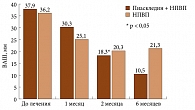
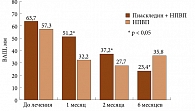
На фоне лечения Пиаскледином у больных ОА наблюдалось уменьшение выраженности боли в покое, нарастающее по мере увеличения длительности приема препарата (рис. 1). К третьему месяцу непрерывной терапии уменьшение интенсивности боли было статистически значимым только у больных основной группы, которые принимали изучаемый препарат в комбинации с НПВП. К концу шестого месяца терапии интенсивность боли в покое в основной группе уменьшилась в 3,5 раза, а в контрольной – только в 1,9 раза. Более отчетливая положительная динамика боли отмечена при движении (рис. 2). Уже к концу первого месяца получено достоверное снижение интенсивности боли у больных, которые принимали Пиаскледин 300 и НПВП, в то время как у пациентов, получавших только НПВП, достоверных различий не было выявлено в течение всего шестимесячного периода лечения. К концу шестого месяца в I группе интенсивность боли при движении снизилась с 63,7 до 23,4 мм ВАШ, а во II – с 57,3 до 35,8. К концу третьего месяца терапии интенсивность утренней скованности заметно снизилась по сравнению с исходным уровнем, причем в большей степени в контрольной группе, чем основной. Однако к концу лечения интенсивность утренней скованности увеличилась как в I, так и во II группах, причем этот показатель не коррелировал с динамикой других основных показателей ОА. Это позволяет предполагать, что ригидность у лиц пожилого и старческого возраста далеко не всегда обусловлена имеющимся дегенеративным заболеванием суставов.
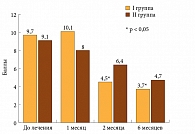
В ходе исследования получены интересные данные о влиянии проводимой терапии на функциональный индекс Лекена (рис. 3). К третьему и шестому месяцам терапии этот показатель претерпел достоверную положительную динамику (9,7, 4,5 и 3,7). Уже к третьему месяцу у больных основной группы индекс тяжести ОА как коленного, так и тазобедренного сустава снизился более чем в 2 раза по сравнению с исходным уровнем, а к концу шестого месяца – почти в 3 раза. Менее отчетливая положительная динамика наблюдалась в контрольной группе, где она оказалась статистически недостоверной.
Снижение выраженности основных симптомов ОА позволило постепенно снизить потребность в НПВП у больных, которые лечились Пиаскледином 300. К концу первого месяца лечения суточную дозу НПВП удалось уменьшить у небольшого числа больных, но спустя 3 месяца она была снижена у подавляющего большинства больных, причем более чем в 2 раза по сравнению с исходным уровнем, а после завершения терапии – в 3 раза. Интересно, что 9 из 43 больных за этот же период полностью прекратили прием НПВП без последующего обострения заболевания.
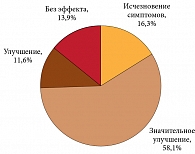
Полученные результаты нашли свое отражение в анализе эффективности лечения по оценке больного и врача. Терапия Пиаскледином 300, по мнению больных, в 58% привела к значительному улучшению и у 11,6% – к улучшению (рис. 4). Полное исчезновение клинической симптоматики ОА отметили 16,3% больных. Глобальная оценка эффективности терапии, по мнению врача, показала в целом такие же результаты. В частности, у 16% больных наблюдалось полное разрешение субъективных и объективных симптомов заболевания, включая и разрешение синовита. Значительное улучшение и улучшение отмечены у 74,4% больных, и только у 9,3% не было существенных положительных сдвигов в клинической картине ОА. Нежелательные явления были выявлены у 8 из 46 больных, которые лечились Пиаскледином 300 в сочетании с НПВП, и у 12 больных, которые получали терапию только НПВП. В основной группе наиболее часто наблюдались боли в животе (4 больных) и нарушение стула (2), а также тошнота и чувство жара. Нежелательные явления отмечались только в начале терапии и носили преходящий характер. Прекращение лечения из-за непереносимости Пиаскледина 300 не потребовалось. В контрольной группе на фоне изолированного приема НПВП нежелательные явления наблюдались у 12 больных и включали в первую очередь симптомы желудочной и кишечной диспепсии. У больных I группы за весь период лечения не наблюдалось обострений хронических заболеваний, включая гипертоническую болезнь и болезни желудочно-кишечного тракта. По оценке больных, переносимость Пиаскледина 300 оказалась отличной у 84,7%, хорошая – у 8,7% и удовлетворительная – только у 6,6%.
Таким образом, Пиаскледин 300 является эффективным медленнодействующим препаратом в терапии ОА. Он относится к модификаторам биологического ответа и обладает уникальным механизмом действия. Этот препарат способствует значительному уменьшению болей в пораженных суставах как в покое, так и при движении, уменьшению синовита, снижению индекса тяжести гонартроза и коксартроза, а также уменьшению потребности в НПВП и сохранению функциональной активности пораженных суставов. Пиаскледин 300 обладает и отчетливым структурно-модифицирующим действием, что было доказано при непрерывном двухлетнем лечении коксартроза.
Препарат характеризуется хорошей переносимостью и высокой безопасностью. Небольшое число нежелательных явлений при его приеме наблюдается на первом этапе лечения, в дальнейшем они полностью купируются без изменения программы лечения.
Особый механизм действия Пиаскледина 300, его высокая эффективность, удобство применения и хорошая переносимость позволяют рекомендовать этот препарат для лечения ОА как эффективное средство, обладающее симптом-модифицирующими и структурно-модифицирующими свойствами. Эти данные подтверждены многочисленными контролированными исследованиями, полностью отвечающими современным требованиям, предъявляемым к лекарственным препаратам для лечения остеоартроза.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.