Результаты наблюдательной программы LAURUS по применению инсулина Лантус® в повседневной клинической практике в Российской Федерации
- Аннотация
- Статья
- Ссылки


Тактика лечения СД 2 предполагает более раннее и агрессивное начало медикаментозной терапии для достижения адекватного гликемического контроля. В настоящее время специалисты выделяют 9 групп таблетированных и инъекционных препаратов, применяемых в терапии СД 2. В совместном консенсусе Американской Диабетологической Ассоциации (ADA) и Европейской Ассоциации по изучению диабета (EASD) [6], а также в недавно опубликованном Консенсусе Американской Ассоциации Клинических Эндокринологов (AACE) и Американской Коллегии Эндокринологов (ACE) [7] оговаривается сравнение различных препаратов в виде следующего заявления: «В настоящее время недостаточно данных, чтобы поддержать рекомендации по какому-то конкретному классу сахароснижающих препаратов или их комбинации в отношении влияния на предупреждение осложнений. Поэтому выбор и сравнение сахароснижающих агентов, так же, как и их сочетания, должен быть основан на их способности нормализовать и поддерживать уровень HbA1c, а также их безопасности, специфическим побочным эффектам, переносимости, удобстве в применении».
В документе также подчеркивается особая роль инсулина в лечении СД 2, что обосновано следующим: инсулин является самым мощным сахароснижающим препаратом; своевременное начало инсулинотерапии обеспечивает оптимальный контроль гликемии, улучшая тем самым прогноз СД 2, замедляя развитие в организме необратимых изменений. Доказано влияние интенсивной инсулинотерапии на предупреждение развития микро- и макрососудистых осложнений при диабете. По мере прогрессирования диабета заболеванием все труднее управлять, в этом плане инсулин дает дополнительные преимущества, поскольку его действие не зависит от остаточной секреторной активности b-клеток.
Эксперты ADA и EASD рекомендуют инсулинотерапию в качестве второго эффективного шага в лечении СД 2 в том случае, если предшествующая терапия в виде изменения образа жизни и приема пероральных сахароснижающих препаратов (ПССП) не привела к достижению целевого уровня HbA1c. Согласно «Алгоритмам специализированной медицинской помощи больным сахарным диабетом» (2009) Российской Ассоциации Эндокринологов этот показатель составляет < 7% [8].
Согласно рекомендациям IDF (2005) [9] и стандартам специализированной помощи больным с сахарным диабетом Российской Ассоциации Эндокринологов (2009) в качестве начала инсулинотерапии могут использоваться базальные или двухфазные инсулины. Учитывая более безопасный и физиологичный профиль фармакодинамики, предпочтение отдается современным аналогам инсулина.
Инсулин гларгин (Лантус®) – первый аналог инсулина длительного действия [10], который используется в России с 2003 года. В большинстве клинических исследований, в которых оценивалась эффективность и безопасность инсулина гларгин, проводилось его сравнение с НПХ-инсулином, наиболее широко применяемым для заместительной базальной терапии [11, 12, 13, 14, 15, 16].
С января 2008 г. по июль 2009 г. проводилась наблюдательная программа LAURUS (Lantus Utilisation in Russia) по применению инсулина Лантус® у пациентов с СД 2 в повседневной клинической практике в Российской Федерации.
Основной целью являлась оценка и сравнение эффективности и безопасности инсулина гларгин и инсулина НПХ по изменениям следующих параметров: HbA1c; уровень глюкозы крови натощак; средняя доза инсулина во время проведения программы; количество документированных явлений симптоматической гипогликемии (тяжелых и умеренных) на пациента в месяц; количество ночных симптоматических гипогликемий.
Материалы и методы
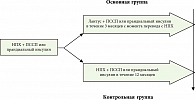
Дизайн. Многоцентровая, открытая, ретроспективная программа для оценки пациентов, переведенных с инсулина НПХ на инсулин гларгин (активная группа), в сравнении с контрольной группой (пациенты, продолжающие терапию инсулином НПХ) (рис.1).
В программу было включено 10 000 пациентов с СД 2 в возрасте старше 18 лет. Данные 6004 пациентов были доступны для анализа эффективности и безопасности.
Основную группу составили пациенты с СД 2 (5329 человек), которые были переведены лечащим врачом с инсулина НПХ на Лантус® за 3 месяца до включения в программу, при условии стабильной терапии ПССП и прандиальными инсулинами.
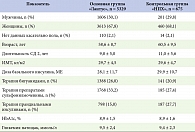
Контрольная группа состояла из 675 пациентов, получающих терапию инсулином НПХ в последние 12 месяцев без изменений в приеме ПССП в течение 6 месяцев до включения. Клиническая характеристика пациентов представлена в таблице 1.
Критерии исключения:
- пациенты, получающие другие, отличные от инсулина гларгин и НПХ, инсулины среднего и длительного действия;
- для пациентов основной группы: изменения в антидиабетической терапии (ПССП или прандиальные инсулины);
- для контрольной группы: любые изменения в антидиабетической терапии в течение 6 месяцев до включения;
- СД 2, леченный смешанными инсулинами; гестационный диабет;
- беременные и кормящие женщины;
- стационарное лечение;
- любые клинически значимые органные или системные заболевания, делающие невозможным интерпретацию и оценку результатов.
Статистический анализ
Все статистические тесты были запланированы как двусторонние с уровнем статистической значимости α = 0,05.
Для непрерывных данных сравнение групп терапии на исходном уровне выполнялось с использованием дисперсионной модели (ANOVA), либо непараметрических методов (в случае ненормального распределения данных). Сравнение дискретных данных выполнялось с использованием Хи-квадрат или других применимых статистических методов. Сравнение изменения HbA1c между группами терапии произведено с использованием дисперсионной модели (ANOVA).
Дискретные величины, представляющие собой значения «норма» или «выше нормы» описаны по визитам и группам терапии. Внутригрупповые изменения тестировались с использованием теста Мак-Немара. Межгрупповые сравнения тестировались с использованием статистик Мантеля-Хенцеля.
Зависимость качественных переменных оценивалась с использованием тестов Хи-квадрат, точного критерия Фишера или различных статистик Кохран-Мантель-Хенцеля.
Результаты
Анализ эффективности
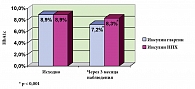
Исходно уровень HbA1с статистически не различался между группами и составлял в группе, переведенной на терапию инсулином гларгин – 8,9 ± 1,5%, в группе, продолжавшей терапию НПХ-инсулином, – 8,9 ± 1,6% (p = 0,275). После 3 месяцев терапии изменение параметра в группе «Лантус®» составило – 1,7 ± 1,4%, а в группе «НПХ – 0,6 ± 1,2%; изменения как внутри группы, так и между группами были значимыми (р < 0,001) (рис. 2).
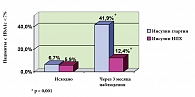
Важной характеристикой сравниваемых препаратов являлась их способность снижать уровень HbA1с до целевых значений. До начала лечения 4972 (93,3%) пациента группы «Лантус®» и 635 (94,1%) пациентов группы «НПХ» имели HbA1с > 7%. После 3 месяцев плановой терапии в группе, получавшей инсулин гларгин, доля пациентов с уровнем HbA1с < 7% составила 41,9% (2235 человек), в группе, продолжавшей терапию НПХ-инсулином, 12,4% (84 человека). Изменения были статистически значимыми (р < 0,001) (рис. 3).
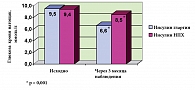
Уровень глюкозы крови натощак в начале наблюдения значимо не различался между группами и составлял в группе «Лантус® – 9,5 ± 2,4 ммоль/л, в группе «НПХ» – 9,4 ± 2,3 ммоль/л (р = 0,362). После 3 месяцев терапии значения уровня глюкозы крови натощак у пациентов изменились и составили 6,6 ± 1,5 ммоль/л в группе «Лантус®» и 8,5 ± 2,2 ммоль/л в группе «НПХ» (рис. 4). Изменение параметра в группе «Лантус®» составило – 2,9 ± 2,3 ммоль/л, а в группе «НПХ – 1,0 ± 2,2 ммоль/л; изменения были статистически значимыми (р < 0,001).
Спустя 3 месяца терапии доза принимаемого пациентами базального инсулина изменилась незначительно и составила в группах «Лантус®» и «НПХ» 29,3 ± 11,1 МЕ (медиана 28,0 МЕ) и 32,0 ± 10,6 МЕ (медиана 32,0 МЕ) соответственно. Изменения за время программы составили 1,2 ± 8,5 МЕ и 2,1 ± 5,5 МЕ в группах «Лантус®» и «НПХ» соответственно. Изменения внутри групп (< 0,001) были статистически значимыми.
3310 (62,1%) пациентов проводили самостоятельное ежедневное мониторирование глюкозы крови в группе «Лантус®» и 346 (51,3%) пациентов проводили самостоятельное ежедневное мониторирование глюкозы крови в группе «НПХ».
Анализ безопасности
Была проанализирована частота всех типов гипогликемии в обеих группах в течение месяца перед включением в программу. В группе, получавшей инсулин гларгин, статистически значимо меньшая доля пациентов испытала симптоматические подтвержденные гипогликемии, чем в группе, получавшей НПХ-инсулин. Количество эпизодов документированной симптоматической гипогликемии было следующим: 1 эпизод отмечался у 223 (4,2%) пациентов группы «Лантус®» и у 54 (8,0%) пациентов группы «НПХ»; 2 эпизода отмечались у 88 (1,7%) пациентов группы «Лантус®» и у 41 (6,1%) пациентов группы «НПХ»; 3 и более эпизодов отмечалось у 57 (1,1%) пациентов группы «Лантус®» и у 32 (4,7%) пациентов группы «НПХ» (р < 0,001) (таб. 2).
Количество эпизодов ночной гипогликемии было значимо меньшим в группе получающей терапию инсулином гларгин (р<0,001): 1 эпизод отмечался у 233 (4,4%) пациентов группы «Лантус®» и у 99 (14,7%) пациентов группы «НПХ»; 2 эпизода отмечались у 105 (2,0%) пациентов группы «Лантус®» и у 71 (10,5%) пациентов группы «НПХ»; 3 и более эпизодов отмечалось у 46 (0,8%) пациентов группы «Лантус®» и у 44 (6,5%) пациентов группы «НПХ» (Табл. 3).
Случаи тяжелой гипогликемии встречались редко (15 (0,3%) пациентов в группе «Лантус®» и 19 (2,8%) пациентов в группе «НПХ»). Процент тяжелых гипогликемий был выше в группе «НПХ» (р < 0,001).
Обсуждение результатов
В программе LAURUS были проанализированы данные 6004 пациентов с СД типа 2. Полученные результаты позволяют сделать заключение о возможностях и недостатках терапии базальными инсулинами среди больных с СД 2 в Российской Федерации. Неоспоримым преимуществом инсулина Лантус® перед инсулином НПХ является лучший суточный профиль действия, позволяющий достигать улучшения уровней глюкозы натощак и HbA1c с меньшим риском гипогликемий, в том числе в ночное время. Такие же результаты были получены ранее в исследовании ATLANTUS [17], в котором приняли участие около 5000 больных СД 2. Исследование, проведенное на базе более тысячи исследовательских центров в 59 странах, подтвердило уникальный 24-часовый профиль действия Лантус®а, позволяющий проводить интенсивную титрацию дозы в ежедневной клинической практике при низком риске развития тяжелых гипогликемий. Исследование включало в себя пациентов с длительностью СД 2 более 12 лет, во всех группах больных терапия Лантус®ом продемонстрировала существенные преимущества по сравнению с ранее проводимой терапией.
Существует большое количество публикаций, свидетельствующих об улучшении показателей углеводного обмена и снижении частоты ночных гипогликемий при однократном применении инсулина гларгин перед сном у больных с СД 2 в сравнении с инсулином НПХ [18, 19, 20]. Во всех исследованиях продемонстрировано значимое снижение утренней гликемии натощак. В отношении уровня HbA1c в одних исследованиях получен эффект, сопоставимый с таковым при применении НПХ, в других исследованиях отмечено его достоверное снижение при применении гларгина. Кроме того, в исследованиях показано, что при переводе на инсулин гларгин отмечается значимое снижение клинических, в первую очередь ночных гипогликемий.
В то же время в программе LAURUS показано, что, несмотря на улучшение показателей как утренней гликемии, так и HbA1c, доза Лантус®а значимо не менялась на протяжении периода наблюдения. В целом это показывает, что улучшение углеводного обмена связано с меньшей вариабельностью гликемии в течение суток при применении инсулина гларгин в сравнении с инсулином НПХ. В повседневной практике в отличие от клинических исследований как врачами, так и пациентами недостаточно используется возможность титрации дозы Лантус®а, который при своевременном назначении и интенсификации терапии позволяет достигать целевых значений углеводного обмена с минимальным риском гипогликемий.
Выводы
Программа продемонстрировала улучшение контроля уровня гликемии при переводе пациентов с СД 2 с инсулина НПХ на Лантус® (снижение показателей HbA1c и глюкозы крови натощак) при меньшем числе и меньшей выраженности гипогликемических эпизодов. По результатам программы, в группе Лантус® значительно большее количество пациентов достигло целевых значений – HbA1c < 7% после 3 месяцев плановой терапии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.