Результаты применения Глиатилина при когнитивных нарушениях у пациентов с последствиями тяжелой черепно-мозговой травмы
- Аннотация
- Статья
- Ссылки
В последние годы большое внимание уделяется проблеме когнитивных нарушений. Постоянный рост нейротравматизма, широкая распространенность когнитивных нарушений при последствиях черепно-мозговой травмы (ЧМТ), высокая степень инвалидизации пострадавших, в том числе и из-за интеллектуально-мнестических нарушений, обусловливают социальную значимость проблемы диагностики и лечения когнитивной дисфункции [1–6].
Для лечения когнитивных нарушений применялись препараты различных классов с разным успехом – так, например, значимого клинического результата при использовании статинов продемонстрировано не было [7]. Не установлено также существенного положительного влияния ноотропных препаратов при выраженных когнитивных нарушениях, достигающих степени глубокой деменции [8, 9]. Использование вазоактивных препаратов, антагонистов кальциевых каналов или препаратов на основе экстракта листьев Ginkgo biloba дало возможность получить убедительные положительные результаты только при умеренных когнитивных нарушениях [10].
Исследования, посвященные роли нейротрофических препаратов (регуляторных пептидов), показали их высокую эффективность в остром периоде травмы, однако по мере присоединения к посттравматическим когнитивным нарушениям субкортикальной ишемической деменции, что характерно для пострадавших старшей возрастной группы, эффект от лечения постепенно утрачивается [11]. Не случайно в последнее время интересы исследователей сосредоточены на применении препаратов, оказывающих модулирующее действие на холинергическую и глутаматергическую системы [12–14]. Актуальным остается вопрос использования ингибиторов ацетилхолинэстеразы (Реминил, Экселон) при смешанном варианте деменции [15].
Важными вопросами при определении терапевтической стратегии у пациентов с посттравматическими когнитивными нарушениями являются возможности длительного применения донаторов холина и сочетание этой группы препаратов с ингибиторами ацетилхолинэстеразы при глубокой деменции, а также превентивного лечения при легких и умеренных когнитивных нарушениях. С целью оценки применения холина альфосцерата (препарат Глиатилин) при когнитивных нарушениях у пациентов с последствиями тяжелой черепно-мозговой травмы было проведено исследование в отдаленном периоде у большой группы пациентов, перенесших тяжелую ЧМТ и оперативное вмешательство – удаление внутричерепных гематом и очагов размозжения.
Материалы и методы
В ретроспективное исследование было включено 173 пациента с последствиями тяжелой ЧМТ, срок катамнеза 48 месяцев. Катамнез изучался с момента выписки из стационара после лечения тяжелой ЧМТ с анализом наличия и степени пирамидных и экстрапирамидных нарушений, речевых и когнитивных нарушений. Сравнительный анализ исходов проводился в 3 группах больных: с травматическими изолированными внутричерепными гематомами, изолированными очагами размозжения и сочетанием очагов размозжения с внутричерепными гематомами. Все больные были оперированы.
В основную группу (включение Глиатилина в комплексную терапию после выписки из нейрохирургического стационара) вошли 111 пациентов, в контрольную (базисная терапия) – 62 пациента. В основной группе было 78 мужчин, 33 женщины, возраст больных – от 23 до 69 лет, средний возраст составил 41,3 года. В контрольной группе – 49 мужчин и 13 женщин, возраст – от 22 до 69 лет, средний возраст – 41,2 года.
Анализировались данные компьютерной и магнитно-резонансной томографии, электрокардиографии; динамика когнитивных нарушений оценивалась по шкале MMSE (Mini-Mental State Examination – Краткая шкала оценки психического статуса). Исходы, в том числе и уровень качества жизни, оценивались по индексу Бартел и модифицированной шкале Рэнкина. Изучали структуру основных клинических синдромов после выписки из стационара, а также динамику клинических синдромов на протяжении всего периода наблюдения. Была проведена статистическая обработка материала с использованием методов вариационной статистики, а также корреляционный анализ с использованием критериев Пирсона и Спирмена.
Результаты и обсуждение
Был проведен анализ динамики когнитивных нарушений в течение 48 месяцев применения препарата Глиатилин у 111 пациентов с последствиями тяжелой ЧМТ (основная группа). Контрольную группу составили 62 пациента с аналогичной степенью тяжести травмы. Исходно группы были сопоставимы по всем параметрам. У 32 пациентов основной группы были удалены изолированные эпидуральные и субдуральные гематомы объемом от 75 до 100 см3. В 15 случаях локализация гематом была левосторонней, в 17 – правосторонней. У 36 больных основной группы выявлены очаги размозжения полюсов и медиобазальных отделов лобных и височных долей. Левополушарная локализация имела место в 17 наблюдениях, правополушарная – в 13, очаги размозжения обеих лобных долей были выявлены у 6 пациентов. У 43 больных основной группы имелось сочетание очагов размозжения с эпидуральными, субдуральными и внутримозговыми гематомами. Левосторонняя локализация травматического субстрата была у 21, правополушарная – у 22 пациентов.
В контрольной группе изолированные оболочечные гематомы выявлены у 18, изолированные очаги размозжения – у 21 пациента и сочетание оболочечных внутримозговых гематом и очагов размозжения – у 23 больных. Левополушарная локализация травматического субстрата была у 21, правополушарная – у 41 пациента. В клинической картине у 96 пациентов основной и 59 больных контрольной группы имелись очаговые симптомы выпадения.
В структуре неврологических нарушений доминировали интеллектуально-мнестические (когнитивные), афатические и двигательные нарушения. Характерной особенностью ближайшего восстановительного и отдаленного периодов тяжелой ЧМТ являлась сочетанная патология (2–3 и более клинических симптомов на одного пациента). В целом церебрально-очаговый синдром диагностирован у 96 больных основной и 49 пациентов контрольной группы, гипертензионно-гидроцефальный – у 18 и 12, вегетативно-сосудистый – у 43 и 22, астенический – у 76 и 49, эпилептический – у 19 и 9 пациентов соответственно.
Все больные как в основной, так и в контрольной группах были прооперированы, им производилась костно-пластическая декомпрессивная трепанация с удалением травматического субстрата, и через 6 месяцев после травмы проводилась операция пластики дефекта костей свода черепа. Ни в одном случае ухудшения состояния пациентов после операции пластики дефекта костей свода черепа не отмечалось. В среднем все пациенты выписывались из нейрохирургического стационара через 1 месяц после оперативного вмешательства.
Все пациенты получали комплексную терапию с учетом ведущего клинического синдрома с применением вазоактивных, нейротрофических, ноотропных, рассасывающих и, по показаниям, противоэпилептических препаратов. Препарат Глиатилин включался в комплексное лечение в дозировке 400 мг 3 р/сут, курсами по 3 месяца с перерывом в 1 месяц между курсами на протяжении 48 месяцев после выписки из нейрохирургического стационара. Назначение Глиатилина как донатора холина и пресинаптического холинергического препарата обусловлено его участием в регуляторных процессах, активацией фактора роста нервной ткани, улучшением ментальных и когнитивных функций, предупреждением развития амнезии, влиянием на повышение текучести мембран в холинергических нейронах, нейрометаболической защитой мозга. Глиатилин способен проникать через гематоэнцефалический барьер, способствует сохранению цитоскелета нейронов, сохранению органелл и экономии клеточных энергоресурсов.
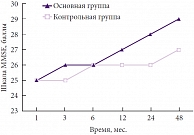
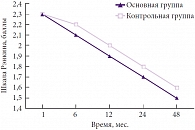
Динамика когнитивных нарушений и уровень адаптации по шкалам MMSE, Бартел и модифицированной шкале Рэнкина оценивались в течение первого года через месяц (исходный уровень) и далее через 3, 6, 12, 24 и 48 месяцев после выписки из стационара. В группе больных с изолированными гематомами получены статистически достоверные данные о меньшей степени выраженности когнитивных нарушений у пациентов, получавших Глиатилин (рис. 1). Не выявлено статистически достоверной разницы в динамике когнитивных нарушений в зависимости от право- и левополушарной локализации процесса. Следует отметить, что всех пациентов с наличием той или иной формы афазии консультировали логопед и/или нейропсихолог. Стабильное и прогрессирующее улучшение интеллектуально-мнестических функций было выявлено в основной группе (то есть у пациентов, в комплексную терапию которых включался Глиатилин). Дополнительно проводившиеся оценки по шкале батареи тестов лобной дисфункции (FAB, Frontal Assessment Battery), а также тесту рисования часов были аналогичны результатам, полученным по шкале MMSE.
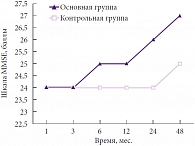
У пациентов с изолированными очагами размозжения (рис. 2) лучшие результаты в динамике когнитивных нарушений также были получены в основной группе. Как и у пациентов с изолированными внутричерепными гематомами, прогрессирующее улучшение когнитивных функций начиналось с 12-го месяца лечения. Была выявлена тенденция к более быстрому и стабильному результату при правополушарной локализации травматического субстрата, однако эта тенденция оказалась статистически не значимой (р ≥ 0,05).
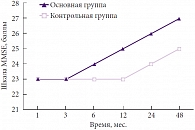
В группах наблюдения с сочетанием травматических внутричерепных гематом и очагов размозжения также отмечены лучшие результаты по шкале MMSE у пациентов, получавших в комплексном лечении Глиатилин (рис. 3). Следует отметить, что прогрессирующее улучшение состояния с прогредиентным восстановлением интеллектуально-мнестических функций в этой группе пациентов начиналось несколько раньше – с 6-го месяца комплексного лечения. В этой группе получена также статистически не значимая тенденция (р = 0,05) к лучшим результатам, но при левополушарной локализации травматического субстрата.
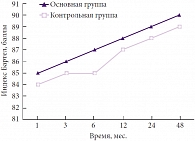
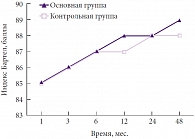
Анализ исходов и степени адаптации в ближайшем восстановительном и отдаленном периодах последствий тяжелой ЧМТ проводился с использованием шкалы Бартел и шкалы Рэнкина. При оценке исходов и уровня адаптации при изолированных внутричерепных гематомах по шкале Бартел установлено, что имеется статистически достоверная разница в уровне адаптации между основной и контрольной группами (р < 0,05). Лучшие результаты по динамике когнитивных нарушений достигнуты у пациентов с изолированными внутричерепными гематомами, в комплексном лечении которых использовался Глиатилин (рис. 4). Уровень адаптации в основной группе составил 90 баллов, в контрольной – 89. Установлена статистически достоверная разница (р < 0,05) в зависимости от локализации травматического субстрата – лучшие результаты получены при правополушарной локализации процесса, поскольку наличие афатических нарушений затрудняло адаптацию больных.
Анализ уровня адаптации и динамики неврологических нарушений по шкале Бартел у пациентов с изолированными очагами размозжения подтверждает то, что включение Глиатилина в комплексную терапию достоверно приводит к более высоким результатам (р < 0,05) (рис. 5). Уровень адаптации в основной группе достигал 89,5 баллов, а в контрольной – 88,5. Получена статистически достоверная разница в зависимости от локализации травматического субстрата – лучшие результаты при правополушарной локализации процесса.
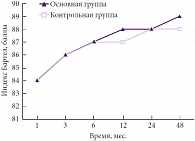
В группах пациентов с сочетанием внутричерепных гематом и очагов размозжения также получена достоверная разница между основной и контрольной группами (р < 0,05), лучшие результаты динамики неврологических нарушений и уровня адаптации продемонстрировали пациенты, в комплексном лечении которых применялся препарат Глиатилин (индекс Бартел 89 и 88 соответственно) (рис. 6). Была установлена статистически достоверная разница в зависимости от локализации травматического субстрата. Лучшие результаты получены при правополушарной локализации процесса.
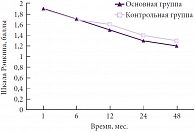
Был проведен анализ исходов по модифицированной шкале Рэнкина. В группе наблюдений с изолированными оболочечными гематомами лучшие исходы также установлены в группе Глиатилина: в основной группе балл по шкале Рэнкина составил 1,2, а в контрольной – 1,3 (р < 0,05), наблюдалась прежняя тенденция лучшего уровня исходов при правополушарной локализации процесса (рис. 7). В группе пациентов с изолированными очагами размозжения исходы по шкале Рэнкина со статистически достоверной разницей показывают высокий уровень результатов в основной группе при применении Глиатилина: балл по шкале Рэнкина – 1,3; а в контрольной – 1,4 (рис. 8). Лучшие результаты по уровню адаптации получены при правополушарной локализации процесса.
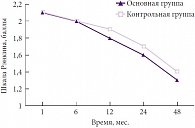
У пациентов с сочетанием травматических внутричерепных гематом и очагов размозжения анализ динамики неврологических нарушений и уровня адаптации показал, что лучшие результаты по исходам также получены у пациентов, получавших Глиатилин (рис. 9). Уровень адаптации по шкале Рэнкина в основной группе составил 1,5; а в контрольной – 1,6. Лучшие исходы также получены у пациентов с правополушарной локализацией травматического субстрата (р < 0,05).
В ходе динамического наблюдения установлено, что нарушение степени выраженности церебрально-очагового синдрома происходило не только за счет регресса двигательных нарушений, но и за счет улучшения интеллектуально-мнестических функций. Лучшие исходы получены в основной группе (у пациентов, получавших Глиатилин). В случаях с вегетативно-сосудистым и астеническим синдромами при наличии легких когнитивных нарушений статистически достоверной разницы в исходах не установлено. Не получено статистически достоверной разницы также между основной и контрольной группами при эпилептическом синдроме, у пациентов с легкими и умеренно выраженными когнитивными нарушениями.
У 15 больных старшей возрастной группы с выраженными когнитивными нарушениями (смешанной деменцией – субкортикальной ишемической и посттравматической) в комплексное лечение включались не только Глиатилин, но и Реминил (галантамин) и Экселон (ривастигмин). Экселон применялся в дозировке 3–12 мг/сут в течение 6 месяцев, после 1 месяца перерыва назначался повторный курс. Реминил назначался по 24 мг/сут по такой же схеме. Препарат Реминил не назначался пациентам с реакциями на галантамин, в этих случаях применялся Экселон (n = 5).
При оценке результатов с использованием шкал MMSE, Бартел и Рэнкина у больных старшей возрастной группы показана статистически достоверная более высокая степень адаптации и динамики когнитивных нарушений в группах с очагами размозжения и сочетанием очагов размозжения с травматическими внутричерепными гематомами на фоне лечения Глиатилином. У пациентов с изолированными травматическими гематомами статистически достоверных различий не выявлено, возможно, это обусловлено недостаточным числом наблюдений (2 в основной и 1 – в контрольной группе).
Заключение
Дагностика и лечение когнитивных нарушений представляют собой одну из актуальных проблем современной неврологии, психиатрии, нейрохирургии и нейропсихологии. Когнитивные нарушения достаточно неоднородны по своей структуре в зависимости от этиологии заболевания, особенностей патогенеза и в значительной мере отягощают реабилитационный прогноз. При повреждениях головного мозга как в результате сдавления изолированными оболочечными гематомами, так и при очагах размозжения головного мозга, особенно в сочетании с гематомами, развиваются выраженные когнитивные нарушения, достигающие степени тяжелой деменции. Необходимость поиска лечебных стратегий для решения этой проблемы становится все более и более очевидной. Проведенный анализ динамики когнитивных нарушений при последствиях тяжелой черепно-мозговой травмы показал, что включение в терапию донаторов холина (препарата Глиатилин) является перспективным направлением как профилактики, так и лечения нарушений интеллектуально-мнестических функций.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.