Роль митохондриальной цитопатии при стеатозе у больных неалкогольной жировой болезнью печени
- Аннотация
- Статья
- Ссылки
- English

Стеатоз у больных НАЖБП: классификация, распространенность, причины возникновения
Одной из сложнейших проблем современной клинической медицины являются хронические диффузные заболевания печени в силу их значительного распространения и высокого риска развития тяжелых осложнений. К наиболее часто диагностируемым хроническим заболеваниям печени относится неалкогольная жировая болезнь печени (НАЖБП).
НАЖБП (жировая дистрофия печени, жировая печень, жировая трансформация) – это первичное заболевание или синдром, формирующийся вследствие избыточного накопления жиров, преимущественно триглицеридов, в печени.
Выделяют несколько клинико-морфологических стадий течения НАЖБП, основными из которых являются стеатоз, стеатогепатит, фиброз и цирроз. В свою очередь стеатоз встречается на любом этапе НАЖБП, а его морфологические проявления могут видоизменяться в зависимости от стадии заболевания. Если эту нозологию рассматривать с количественной точки зрения, жир должен составлять не менее 5–10% веса печени, или более 5% гепатоцитов в своем составе должны содержать депозиты липидов при гистологическом исследовании [1–4].
В руководстве по гепатологии E. Kuntz и H.D. Kuntz приведены следующие определения стеатоза печени:
- стеатоз печени – состояние, при котором в отдельных клетках печени встречаются малые или средних размеров жировые капли и жир, что составляет 3–10% веса печени;
- жировая печень (fatty liver, жировой гепатоз, стеатоз печени) – состояние печени, при котором содержание жира превышает 10% веса органа, а более 50% гепатоцитов в своем составе содержат капельки жира разных размеров и жировые скопления распределены диффузно по всей паренхиме печени [5, 6].
Жировая дистрофия печени как гистологический феномен известна с 1940-х гг. Так, жировую дегенерацию исследователи описывали как морфологический синдром печени при различных заболеваниях внутренних органов. Однако активно изучать данное состояние начали в конце XX в., когда в клинических исследованиях была подтверждена его высокая распространенность, а также установлена связь с метаболическими нарушениями в организме и высоким риском сердечно-сосудистых нарушений.
По мнению большинства экспертов, избыточное накопление жира в печени является толчком для развития ряда патологических состояний. Предполагается, что даже незначительное увеличение массы тела может способствовать перераспределению содержания липидов в тканях и нарушению их нормального метаболизма. Стеатоз печени развивается при увеличении массы тела, не сопровождающемся повышением индекса массы тела (ИМТ). Кроме того, в ряде исследований у 22% пациентов с НАЖБП не было избыточного веса, они не страдали сахарным диабетом (СД), в 64% случаев отсутствовали минимальные критерии метаболического синдрома, а в 12% не зарегистрировано ни одного критерия. Однако у всех участников исследования отмечались изменения в ткани печени, характерные для стеатоза [7–9].
Распространенность НАЖБП в общей популяции в мире варьируется от 6,3 до 33%. НАЖБП выявляют в любой возрастной категории. У лиц с ожирением показатель распространенности значительно выше, чем в общей популяции, – 62–93%, по данным различных исследований. При этом на этапе стеатоза заболевание выявляется у 20–35%, на стадии стеатогепатита – у 18,5–26% больных, фиброз диагностируется в 20–37% случаев, цирроз – в 9–10%. Чаще страдают женщины в возрасте 40–50 лет, 60–75% из них имеют различные метаболические нарушения [1, 10–16].
В России НАЖБП занимает лидирующее место в структуре заболеваний внутренних органов. За последние семь лет распространенность НАЖБП увеличилась на 10,3% и составила 37,3%. Среди трудоспособного населения избыточную массу тела имеют 30%. 25% страдают ожирением [1, 17].
На сегодняшний день выделяют два морфологических типа неалкогольного стеатоза. Чаще встречается так называемое крупнокапельное (макровезикулярное) ожирение, для которого характерно наличие в гепатоците одной большой вакуоли жира, оттесняющей его ядро к периферии клетки. Реже наблюдается мелкокапельное (микровезикулярное) ожирение, которому присуще наличие множества мелких вакуолей жира вокруг ядра гепатоцита, сохраняющего центральное положение в клетке. Как правило, в печеночных клетках одновременно наблюдаются признаки обоих типов ожирения [18–20].
Крупнокапельное ожирение встречается при различных хронических заболеваниях печени, что свидетельствует о доброкачественном течении процесса с незначительной тенденцией к обострениям. В свою очередь мелкокапельный тип ожирения, в частности его самостоятельная форма, отражает распространенное, глубокое поражение митохондрий гепатоцитов, в ряде случаев приводящее к развитию печеночной недостаточности, энцефалопатии, комы и смерти больных [21].
Выделяют первичный и вторичный, очаговый и диффузный стеатоз печени. При НАЖБП чаще встречается диффузный стеатоз, который носит зональный характер с локализацией во второй и третьей зонах печеночной дольки. Первичный жировой гепатоз рассматривается как одно из проявлений метаболического синдрома. Обычно он ассоциирован с эндогенными нарушениями липидного и углеводного обмена, такими как ожирение, СД 2-го типа, гиперхолестеринемия и гипертриглицеридемия.
Развитию вторичного жирового гепатоза способствуют, в частности:
- прием лекарственных препаратов с гепатотоксическим потенциалом (глюкокортикостероиды, амиодарон, эстрогены, тамоксифен, тетрациклин, ацетилсалициловая кислота, индометацин, Бруфен, антибиотики);
- нарушение питания (голодание, резкое сокращение или увеличение калорийности пищи, чрезмерное потребление углеводов, парентеральное питание, недостаток белков, витаминов и микроэлементов);
- проявления синдрома мальабсорбции, развивающегося при наложении илеоеюнального анастомоза, билиарнопанкреатической стомы, гастропластики по поводу ожирения, расширенной резекции тонкой кишки;
- нарушение процессов пищеварения и всасывания (хронические заболевания органов желудочно-кишечного тракта с секреторной недостаточностью пищеварительных ферментов);
- нарушение микробиоценоза кишечника;
- абеталипопротеинемия;
- липодистрофия конечностей;
- болезнь Вебера – Крисчена;
- болезнь Коновалова – Вильсона [4, 12, 17, 22, 23].
В настоящее время выделяют четыре гистологические формы стеатоза:
- очаговую диссеминированную, не проявляющуюся клинически;
- выраженную диссеминированную;
- зональную (в различных отделах дольки);
- диффузную.
Диагноз стеатоза правомерен в том случае, если более 5–10% массы печени составляет жир, причем преимущественно в виде триглицеридов. Стеатоз печени обычно указывает на нарушение регуляции синтеза и секреции триглицеридов, конкретные механизмы которого изучены недостаточно. Не определены также и факторы, выступающие в роли триггеров данных нарушений. Среди потенциальных рассматривают следующие патофизиологические механизмы:
- избыточное поступление жирных кислот (ЖК) в печень из жировой ткани и/или с пищей;
- усиление эндогенного синтеза ЖК;
- уменьшение митохондриального бета-окисления жира;
- нарушение включений и экскреции триглицеридов в составе липопротеинов очень низкой плотности [24].
Развитие стеатоза у больных НАЖБП представляет неспецифическую реакцию гепатоцитов на различное токсическое воздействие. Наиболее распространенными причинами его возникновения являются СД, ожирение, гиперлипидемия [10, 11, 24].
В начале XXI в. высказывалось предположение, что жировая инфильтрация печени служит предиктором инсулинорезистентности и основой полиорганной патологии при метаболическом синдроме [10, 22, 23]. В последнее время эта точка зрения находит все большее подтверждение. Выдвигается новая концепция инсулинорезистентности самих гепатоцитов в развитии стеатоза при НАЖБП и метаболическом синдроме [25–28]. Таким образом, с развитием стеатоза круг замыкается. Так, гиперинсулинемия, обусловленная инсулинорезистентностью, способствует повышенному синтезу, концентрации в крови и накоплению в печени свободных жирных кислот (СЖК). В результате угнетается цикл бета-окисления ЖК, что способствует повышенному образованию липопротеинов очень низкой плотности (ЛПОНП) и активных форм кислорода (АФК), вызывающих развитие окислительного стресса и перекисного окисления липидов (ПОЛ). Поскольку источником свободных радикалов, участвующих в ПОЛ, является система цитохромов Р450, у пациентов с неалкогольным стеатозом цитохром Р450 2Е1 способен генерировать свободные радикалы в ответ на стимуляцию кетонами – продуктами окисления СЖК [29, 30].
Абдоминальное ожирение, гипергликемия, малоподвижный образ жизни, высококалорийная пища – дополнительные факторы, способствующие формированию НАЖБП. Важную роль в этом процессе играют наследственная предрасположенность – мутация генов, ответственных за процессы окисления СЖК и синтез провоспалительных цитокинов. В частности, известна роль в патогенезе заболевания рибонуклеотида микроРНК-10b (miRNA-10b). Он регулирует дифференцировку адипоцитов, метаболизм липидов, глюкозоопосредованную секрецию инсулина, активирующих пролиферацию пероксисом (PPAR) ENPP1/PC-1 Lys121GLN и IRS-1 Gly972Arg, которые тесно ассоциируются с повышенным риском развития ожирения [31, 32].
Кроме того, установлено значение митохондриальной дисфункции в патогенезе стеатоза при НАЖБП. Нарушения структурно-функциональной организации митохондрий при НАЖБП включают как ультраструктурные нарушения их мембранного аппарата, так и нарушение структуры митохондриальной ДНК, снижение активности комплекса дыхательной цепи и бета-окисления ЖК [33].
Митохондрии – наиболее лабильные внутриклеточные структуры, которые в первую очередь подвергаются изменениям при гиперфункции клетки и ее различных повреждениях. Изменения в митохондриях, возникающие при патологических состояниях, достаточно стереотипны, но при некоторых заболеваниях имеют специфические признаки. Митохондриальные включения, как правило, встречаются при патологических состояниях и отражают их неспецифическую реакцию на повреждение клетки.
Митохондриальные нарушения – обширная группа патологических состояний, связанных с дефектами митохондриального или ядерного генома. Митохондриальные расстройства могут возникать из-за нарушений либо в ядре, либо в митохондриальном геноме. В результате может получиться любой вариант наследования: аутосомно-доминантный, аутосомно-рецессивный, Х-сцепленный, материнское наследование, спорадические случаи. Митохондриальные цитопатии включают в себя функциональные и биохимические изменения обмена белков, жиров, углеводов, снижение активности ферментов дыхательной цепи.
Клинические признаки острых и хронических заболеваний печени свидетельствуют о том, что независимо от их этиологии на первый план выходят митохондриальные цитопатии: повышенная усталость, астенический синдром, нарушения сна, психоэмоциональная лабильность, мышечная слабость, непереносимость физических нагрузок, склонность к тахикардии и проч.
Последнее время появляется все больше данных о том, что повреждение и дисфункция митохондрий играют существенную роль не только в развитии ПОЛ, которое приводит к повреждению мембран, некрозу и апоптозу гепатоцитов, но и в развитии и прогрессировании стеатоза.
Указанные изменения способствует повышению продукции АФК, активации провоспалительных цитокинов и индукции Fas-лиганда. ПОЛ приводит к высвобождению малонового диальдегида (МДА) и m-гидроксиноненала, индуцирует образование ряда цитокинов: фактора некроза опухоли (ФНО) альфа, тканевого фактора роста бета. В свою очередь экспрессия Fas-лиганда в гепатоцитах вызывает каскадный эффект и, как следствие, апоптоз клетки. Так, среди причин развития неалкогольного стеатоза выделяют дефицит ферментов пероксисомального бета-окисления ЖК и накопление дикарбоновых кислот. Их недостаток приводит к гиперактивации генов, регулирующих экспрессию рецепторов PPAR-гамма, МДА и гидроксиноненала [34, 35]. Митохондрии способствуют окислению ЖК и развитию окислительного фосфорилирования. Учитывая, что гепатоциты богаты митохондриями, можно предположить, что они являются главным регулятором липидов печени [29]. Поскольку каждый гепатоцит содержит 800 митохондрий, которые занимают около 18% печеночной клетки, митохондриальная функция считается одной из основных составляющих регуляции жира в печени [36].
Каждая митохондрия содержит от двух до десяти молекул митохондриальной ДНК. Среди причин, способных приводить к мутациям митохондриальной ДНК, могут быть эндогенные, связанные с «ошибками» функционирования ДНК-полимераз и репараз – ферментов синтеза митохондриального генома, а также с повреждением не защищенного гистонами и нитронами митохондриального генома от продуктов ПОЛ (перекисью водорода, гидроксильными радикалами и др.). Мутации митохондриальной ДНК представляют собой делеции разного размера. Репликация митохондриальной ДНК происходит очень интенсивно, в десять раз быстрее ядерной ДНК, что ведет к быстрому накоплению мутаций. В патогенезе митохондриальных мутаций имеют значение и такие факторы, как физические нагрузки, гипоксия, лекарственные препараты [33, 37].
При инсулинорезистентности, ожирении и СД 2-го типа наблюдается уменьшение потребления кислорода тканями, синтеза АТФ, концентрации митохондриальной ДНК-транскрибирующего фактора, содержания дыхательных протеинов. Тем самым создаются условия развития неалкогольного стеатоза. На модели НАЖБП в эксперименте на животных установлено снижение экспрессии митохондриальной ДНК-кодированных пептидов и активности комплексов дыхательной цепи I, III, IV и V [30, 36].
В митохондриях гепатоцитов происходят основные биохимические процессы: цикл Кребса (цикл трикарбоновых кислот), окисление ЖК, карнитиновый цикл, транспорт электронов в дыхательной цепи и окислительное фосфорилирование, имеющие отношение к энергообмену. ЖК, поступая в гепатоциты, запускают процесс их активации за счет образования ацетилкофермента А (ацетил-КоА). Активированные ЖК попадают в митохондриальный матрикс в виде ацилкарнитина, который является трансмембранным переносчиком. Деградация ЖК также происходит в матриксе митохондрий гепатоцитов за счет реакций окислительного цикла, при которых последовательно отщепляются С2-звенья в виде ацетил-КоА (активированной уксусной кислоты). Последовательное отщепление ацетильных групп начинается с карбоксильного конца активированной ЖК в положении между атомами С2 (альфа-атомом) и С3 (бета-атомом). Поэтому цикл реакций деградации называется бета-окислением ЖК [37–39].
Установлена прямая и опосредованная токсичность ЖК. Как следствие – ингибирование K+/Na+-АТФазы, угнетение гликолиза, разобщение окислительного фосфорилирования, активизация пути утилизации избытка ЖК путем вовлечения в процесс рецепторов PPAR-альфа. Таким образом, к механизмам, способствующим накоплению жира в гепатоцитах, относятся:
- увеличение поступления ЖК в печень;
- снижение скорости бета-окисления ЖК и повышение их синтеза в митохондриях печени;
- уменьшение синтеза или секреции ЛПОНП [35].
Изучение катализирующих систем показало, что недостаточность мультифункциональных ферментов, вовлеченных в митохондриальное бета-окисление ЖК, также может приводить к развитию жировой болезни печени. Разорванные средние и длинные цепи генов ацетил-КоА-дегидрогеназы, дефекты в бета-окислении ЖК могут стать одной из причин развития микро- и макровезикулярного стеатоза печени [32, 33].
Как известно, катализатором бета-окисления длинноцепочечных ЖК является митохондриальный трехфункциональный протеин, гетеротрехмерный протеин, состоящий из четырех альфа- и четырех бета-субъединиц [40].
Серьезные нарушения митохондриального бета-окисления ЖК способствуют развитию микровезикулярного стеатоза. Первичная или вторичная митохондриальная дисфункция служит важным механизмом развития микровезикулярного стеатоза, при котором нарушения митохондриального бета-окисления неэтерифицированных ЖК приводят к аккумуляции их в печени и этерификации в триглицериды, накапливающиеся в гепатоцитах в виде вкраплений [41].
Формированию крупнокапельного стеатоза печени способствует нарушение структуры митохондриальной ДНК, которое может быть связано как с наследственным дефектом и случайной делецией, так и со встраиванием аналогов нуклеозидов [29].
Некоторые авторы среди причин митохондриальной дисфункции при НАЖБП называют повышение проницаемости внутренней мембраны митохондрий для ионов кальция. Дополнительная причина развития окислительного стресса при стеатозе – кишечный эндотоксикоз, при котором нарушается синтез аполипопротеидов классов А и С, являющихся транспортной формой триглицеридов в процессе образования ЛПОНП.
Важная роль в патогенезе стеатоза, а также в развитии и/или прогрессировании стеатогепатита принадлежит ФНО-альфа, высокий уровень которого определяется у пациентов с данными заболеваниями. Основным источником ФНО-альфа служат гепатоциты и клетки Купфера. ФНО-альфа индуцирует набухание митохондрий со снижением плотности их матрикса и потерей перегородок. Проведение анти-ФНО-альфа-лечения позволяет восстановить активность комплексов I, II, III, V, активность бета-окисления ЖК и архитектонику печени [29, 36].
Таким образом, результаты исследований последних лет помогают понять сущность происходящих изменений в печени при неалкогольном стеатозе, демонстрируют возможные механизмы его развития и прогрессирования. Среди механизмов развития стеатоза первостепенную роль играет митохондриальная дисфункция, которая не только обусловливает нарушение бета-окисления ЖК, но и приводит к увеличению продукции свободных радикалов и провоспалительных цитокинов [40, 42].
Исследование эффективности БАД Гепагард Актив
В исследовании, проведенном на базе кафедры внутренних болезней и нефрологии Северо-Западного государственного медицинского университета им. И.И. Мечникова, изучали клиническую эффективность и безопасность БАД к пище Гепагард Актив у пациентов с НАЖБП на стадии стеатоза [4, 43]. Гепагард Актив назначали по одной капсуле три раза в день во время еды в течение трех месяцев. В состав средства входят эссенциальные фосфолипиды (ЭФЛ), витамин E (токоферол) и L-карнитин (Евразийский патент на состав препарата и его применение № ЕА19268 от 28.02.2014). Главным действующим ингредиентом БАД Гепагард Актив являются ЭФЛ. Эти биологически активные соединения нормализуют метаболизм клеточных липидов и белков, восстанавливают клеточные ферментные системы и стабилизируют мембраны гепатоцитов. Кроме того, они оказывают антиоксидантный эффект за счет участия в реакциях перекисного окисления, тормозят процесс жирового перерождения печеночной паренхимы, предотвращают окисление жира в печени, предупреждают развитие фиброза и стабилизируют физико-химические свойства желчи.
Вторым компонентом БАД Гепагард Актив является витамин E (токоферол), обладающий антиоксидантным и антигипоксантным эффектом, что способствует стабилизации митохондриальной мембраны и экономии потребления кислорода клетками.
Третьим составляющим является L-карнитин. Его основная функция заключается в доставке ЖК в гепатоцит. L-карнитин, активируя распад жиров, защищает печень от жировой инфильтрации и обеспечивает липотропный эффект. Карнитин является основным питательным веществом, увеличивающим способность организма к сжиганию жира. Кроме того, он участвует в дезинтоксикационных процессах в печени, что позволяет митохондриям продолжать выработку энергии с максимальной эффективностью.
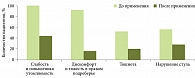
В ходе исследования показано положительное влияние БАД Гепагард Актив на клинические симптомы заболевания печени. Так, одним из наиболее важных результатов стало благоприятное влияние БАД Гепагард Актив на субъективные клинические симптомы. Основными жалобами, которые предъявляли пациенты до исследования, были слабость и повышенная утомляемость – астеновегетативный синдром – клиническое проявление митохондриальной дисфункции, а также дискомфорт и тяжесть в правом подреберье, тошнота, нарушение стула с преобладанием запоров. После курсового применения (три месяца) БАД Гепагард Актив отмечалась отчетливая положительная динамика по частоте выявления перечисленных жалоб (рис. 1).
Показатели клинического (гемоглобин, лейкоциты, эритроциты, тромбоциты, скорость оседания эритроцитов) и биохимического (уровни общего белка, амилазы, общего билирубина, глюкозы, аланинаминотрансферазы, аспартатаминотрансферазы, гамма-глутамилтранспептидазы, щелочной фосфатазы) анализов крови, за исключением липидного спектра, как до, так и после исследования были в пределах нормы. На фоне терапии наблюдалась отчетливая тенденция к нормализации показателей липидограммы. Так, статистически значимо снижался уровень общего холестерина, липопротеинов низкой плотности, наблюдалась тенденция к уменьшению концентрации ЛПОНП, триглицеридов и коэффициента атерогенности (рис. 2).
Кроме того, на фоне проводимой терапии все пациенты отмечали снижение изначально повышенной массы тела. Так, на основании результатов биоимпедансного анализа компонентного состава организма выявлено значимое снижение ИМТ в среднем на 10,7% и количества жировой ткани в организме пациентов на 20,6%. Одновременно менялась картина кишечного микробиоценоза, связанная с избыточной массой тела и риском развития системных нарушений метаболизма. Так, при количественном определении представителей основных бактериальных групп в кале методом полимеразной цепной реакции у подавляющего большинства пациентов изначально определялся дисбиоз кишечника, что выражалось в существенном снижении доли бактероидов. После курса терапии зафиксировано достоверное увеличение доли бактероидов – с 11,3 ± 10,6 (среднее ± стандартное отклонение) до 47,6 ± 28,8% общего количества микроорганизмов (p < 0,0001). Причем увеличение количества бактероидов не нарушало баланса анаэробных представителей кишечной микрофлоры. Например, доля одного из важнейших представителей фирмикутов (Firmicutes) Faecalibacterium prausnitzii имела тенденцию к повышению (пребиотическое действие препарата – патент РФ № 2571495 от 20.12.2015).
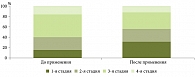
Изначально при ультразвуковом исследовании (УЗИ) гепатобилиарной системы у большинства пациентов выявлялись гипомоторная дискинезия желчного пузыря и билиарный сладж в виде взвеси микролитов и мелких гиперэхогенных частиц, смещаемых при изменении положения тела и не дающих акустической тени. При повторном УЗИ, после терапии, плотность содержимого желчного пузыря уменьшилась и характеризовалась отсутствием гиперэхогенных частиц и эхонеоднородной желчи. Зафиксировано также снижение выраженности признаков стеатоза за счет нормализации размеров печени, эхогенности, структуры и визуализации печеночных вен. Подобные изменения указывают на снижение степени выраженности неалкогольного стеатоза (рис. 3).
На фоне терапии БАД Гепагард Актив, по данным ФиброМакс-теста, предусматривающего оценку активности процесса, фиброза, стеатоза, метаболических нарушений, зарегистрирована положительная динамика по всем показателям, включая степень выраженности стеатоза.
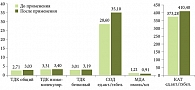
У всех пациентов исходно до терапии наблюдались изменения, характерные для окислительного стресса, – снижение активности ферментного и субстратного звена антиоксидантной системы (АОС), нарушения в окислительно-восстановительном гомеостазе тиол-дисульфидной системы (рис. 4). Об этом свидетельствуют низкие величины общего, низкомолекулярного, белкового, тиол-дисульфидного коэффициента (ТДК). Анализ состояния ферментного звена АОС сыворотки крови выявил угнетение активности супероксиддисмутазы (СОД), каталазы (КАТ). Нарушения протекали на фоне увеличения уровня МДА. Коррекция состояния пациентов с использованием БАД Гепагард Актив способствовала снижению мощности ферментативного звена АОС, сдвигу окислительно-восстановительного потенциала в тиол-дисульфидной системе в сторону окисления, повышению пероксидации белков, снижению ПОЛ. Об этом свидетельствовали повышение общего, низкомолекулярного, белкового ТДК, СОД, КАТ и снижение уровня МДА. Следовательно, одним из положительных механизмов патогенетического действия БАД Гепагард Актив у пациентов со стеатозом является стимуляция ферментов тиол-дисульфидной системы, СОД, каталазы и уменьшение продукции МДА.
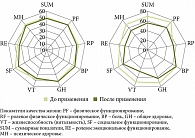
При оценке качества жизни с помощью опросника SF-36 до курсового применения у всех пациентов отмечалось снижение показателей, характеризующих физический и психологический компоненты здоровья. После проведенного курса применения отмечалось достоверное (р < 0,05) улучшение показателей, характеризующих физический компонент здоровья: уровень физического функционирования, интенсивность болевого синдрома, жизненная активность, социальное функционирование, психическое здоровье. На фоне изменения этих показателей возрос уровень ролевого функционирования, обусловленного физическим состоянием, а также уровень общего состояния здоровья (рис. 5).
Таким образом, проявления митохондриальной дисфункции у пациентов с НАЖБП на стадии стеатоза характеризовались наличием астеновегетативного и диспепсического синдромов, дискомфорта и тяжести в правом подреберье, гепатомегалии и билиарной дисфункции.
Результаты проведенного исследования свидетельствуют о положительном опыте применения БАД к пище Гепагард Актив, назначаемой пациентам с НАЖБП на стадии стеатоза. Курсовое применение (три месяца) БАД Гепагард Актив способствует положительной динамике симптомов стеатоза, улучшая состояние печени за счет восстановления структуры и функции гепатоцитов, нормализации митохондриальной дисфункции, предотвращения развития фиброза печени, усиления детоксицирующей функции печени, нормализации липидного спектра, снижению избыточной массы тела, повышению качества жизни пациентов, тем самым способствуя профилактике прогрессирования НАЖБП.
Заключение
Вопросы этиопатогенеза, диагностики, лечения и профилактики стеатоза у больных НАЖБП остаются актуальными и сегодня. Отсутствие единого представления о сути процесса, скудность клинической симптоматики, ограниченные возможности своевременной диагностики обусловливают интерес врачей различных специальностей к поиску решения данной проблемы. Появление современных инновационных фармацевтических препаратов открывает новые возможности в лечении и профилактике хронических заболеваний печени различной этиологии.
P.V. Seliverstov, V.G. Radchenko
North-Western State Medical University named after I.I. Mechnikov
Contact person: Pavel Vasilyevich Seliverstov, seliverstov-pv@yandex.ru
A clinical efficacy and safety of dietary supplement Hepaguard Active was examined during steatosis in patients with fatty liver disease. A course therapy with Hepaguard Active was noted to be associated with a positive dynamics of steatosis symptoms: improved liver state due to restored hepatocyte structure and functioning, normalized mitochondrial dysfunction, prevented development of liver fibrosis, enhanced liver detoxifying function, normalized lipid profile, lowered overweight, and elevated patients’ quality of life.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.