Роль таурина в коррекции нарушений углеводного обмена
- Аннотация
- Статья
- Ссылки
- English
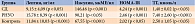

Введение
Важная роль в нарушении углеводного обмена (НУО) отводится изменению соотношения жировой и мышечной тканей в сторону первой. Это приводит к развитию абдоминального ожирения, которое сопровождается изменением метаболизма лептина. Снижение физиологических эффектов лептина ассоциируется с уменьшением антилипотоксического действия, элиминации глюкозы, увеличением продукции глюкозы печенью. Таким образом развивается и прогрессирует инсулинорезистентность (ИР). В условиях ИР происходит срыв регуляции концентрации свободных жирных кислот в плазме крови. При хронически повышенном уровне свободных жирных кислот запускается окислительный стресс и клетки перестают адекватно реагировать на действие инсулина. Избыток висцеральной жировой ткани связан с патологически повышенным поступлением в кровоток провоспалительных цитокинов, что приводит к нарушению гомеостаза в адипоцитах и увеличению липолиза.
На баланс жировой ткани влияют такие факторы, как образ жизни (с учетом хронобиологических часов бодрствования и сна), стресс, питание и физическая активность. Необходимо отметить, что последние десятилетия в рационе населения отмечается преобладание быстрых углеводов и рафинированных жиров над белками. Установлено, что избыток быстрых углеводов вызывает развитие резистентности к лептину и повышение уровня триглицеридов (ТГ), дефицит белка – дисбаланс аминокислотного состава. Это в свою очередь приводит к нарушению процессов метаболизма [1]. Ограничение белка в рационе способно вызвать гиперфагию за счет активации лептинорезистентности через гипоталамическую ось [2]. Употребление продуктов с большим содержанием рафинированных жиров ухудшает лизосомальную функцию адипоцитов, что усугубляет ИР и окислительный стресс [3].
По данным ряда авторов, в условиях дисбаланса аминокислот, преобладания липолиза в адипоцитах, прогрессирования инсулино- и лептинорезистентности снижается уровень таурина как в плазме крови, так и в тканях.
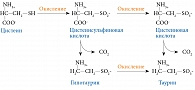
Таурин – жизненно необходимая сульфоаминокислота, которая является конечным продуктом обмена серосодержащих аминокислот (цистеина, метионина, цистеамина) (рис. 1).
Функции таурина в организме разнообразны. Известно, что, соединяясь с холевой кислотой, таурин влияет на всасывание жиров и жирорастворимых витаминов. При соединении с хлором выступает в роли окислителя и компонента антибактериальной защиты. В митохондриях хлорамина таурин воздействует на процесс сборки белков дыхательной цепи и оказывает антиоксидантный эффект. В свободном состоянии таурин регулирует осмотическое давление. Кроме того, он участвует в регуляции выделения желчи. Тауроконъюгаты желчных кислот обладают холеретическим действием и предупреждают развитие холестаза [4]. Таурохолевая кислота снижает количество Escherichia coli в слепой кишке. Таурин уменьшает содержание продуктов жизнедеятельности микроорганизмов в толстой кишке (короткоцепочечных жирных кислот, эндотоксина, оксида азота) [5]. У больных сахарным диабетом (СД) 2 типа таурин улучшает ИР. С одной стороны, он модулирует выработку инсулина – регулирует секрецию инсулина через влияние на уровень внутриклеточного кальция, с другой – участвует в реализации сигнала инсулина – повышает чувствительность рецепторов к инсулину [6–8]. Кроме того, доказано положительное влияние таурина при эндотелиальной дисфункции, диабетической ретинопатии и синдроме диабетической стопы.
Установлено, что у пациентов с микроангиопатией концентрация таурина в крови снижена. Поэтому некоторые авторы предлагают использовать его в качестве маркера для ранней диагностики микроангиопатий у пациентов с СД [9, 10].
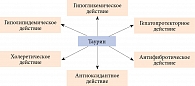
Механизмы действия таурина представлены на рис. 2.
Целью нашего исследования стала оценка роли таурина в коррекции углеводного обмена у пациентов с ранними нарушениями углеводного обмена и СД 2 типа.
Материал и методы
Проведен ретроспективный анализ карт пациентов с ожирением и нарушениями углеводного обмена разной степени, а также без нарушений углеводного обмена. С ранними нарушениями углеводного обмена (РНУО) отобрано 20 человек (группа РНУО), с СД 2 типа длительностью до пяти лет – 20 (группа СД), без нарушений углеводного обмена – 20 больных (группа контроля).
Анализировали антропометрические показатели: окружность талии (ОТ), окружность бедер (ОБ), рост и массу тела для расчета индекса массы тела (ИМТ), а также значения глюкозы плазмы натощак (ГПН), гликированного гемоглобина (HbA1с), лептина, инсулина, индекса гомеостатической модели оценки резистентности к инсулину (Homeostasis Model Assessment of Insulin Resistance – HOMA-IR), триглицеридов (ТГ). Уровень HbA1с исследовали с помощью высокоэффективной жидкостной хроматографии (Bio-Rad D10, США), лептина – иммуноферментного анализа, иммунореактивного инсулина (ИРИ) – радиоиммунного метода (BIOSEN C-Line, Германия). Значения НОМA-IR рассчитывали по формуле: ИРИ × ГПН : 22,5.
От всех участников исследования было получено письменное информированное согласие на обработку данных.
Для сравнения выборок использовался непараметрический дисперсионный критерий Краскела – Уоллиса, коэффициент ранговой корреляции Спирмена, а также множественный линейный регрессионный анализ. Критическое значение значимости результатов приняли равным 0,05. Математическая обработка данных проводилась с использованием SPSS Statistics 22.0, Statistica 6.0.
Результаты и их обсуждение
Средний возраст пациентов в группах – 54,50 ± 5,04 года. 75% участников исследования – женщины.
Все больные страдали ожирением первой степени (по классификации Всемирной организации здравоохранения 1997 г.). Так, ИМТ в группе контроля составил 31,35 ± 5,85 кг/м2, в группе РНУО – 32,70 ± 5,12 кг/м2, в группе СД – 33,21 ± 6,12 кг/м2, ОТ – 96,65 ± 8,53, 98,75 ± 16,49 и 104,05 ± 5,69 см, ОБ – 92,00 ± 21,89, 112,00 ± 18,91 и 114,42 ± 7,76 см соответственно. Средний уровень ГПН – 4,96 ± 0,46, 5,34 ± 0,48 и 6,89 ± 1,34 ммоль/л, HbA1с – 5,57 ± 0,45, 6,07 ± 0,53 и 6,27 ± 1,34% соответственно. Значения лептина, инсулина, НОМA-IR, ТГ представлены в табл. 1.
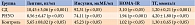
Пациенты группы контроля и РНУО находились на низкоуглеводной диете. Больные СД 2 типа принимали пероральный сахароснижающий препарат из группы бигуанидов и гиполипидемический препарат из группы статинов. С целью лучшей коррекции углеводного обмена и уровня триглицеридов пациентам назначен таурин (Дибикор). Режим применения – по 500 мг два раза в сутки в течение трех месяцев. По истечении данного периода времени ИМТ в группах в среднем снизился на 3,5%, ОТ – на 13,4%, ОБ – на 10,3% (табл. 2).
Средний уровень HbA1с в группах составил 4,50 ± 0,35, 5,6 ± 0,42, 6,01 ± 1,23% соответственно. Уровень лептина снизился на 3,96%, инсулина – на 30,5%, значение НОМА-IR – на 0,9%, ТГ – на 1,54% (табл. 3).
Заключение
Согласно полученным результатам, во всех группах таурин способствовал снижению лептино- и инсулинорезистентности за счет сокращения объема висцерального жира и уменьшения уровня ТГ. Следовательно, Дибикор можно использовать при разной степени нарушения углеводного обмена для воздействия на механизмы развития ИР как на уровне жировой ткани, так и на уровне печени.
А.Ye. Yuzhakova, A.A. Nelayeva, MD, PhD, Prof., Yu.V. Khasanova, PhD
Consultative and Diagnostic Center ‘Endos’, Tyumen
Tyumen State Medical University
Contact person: Anna Ye. Yuzhakova, agamzina@yandex.ru
Abdominal obesity plays an important role in the development of carbohydrate metabolism disorders. Against this background, there is and progresses leptin- and insulin resistance. Under these conditions, there is a violation of the production of free fatty acids and develops chronic oxidative stress. The situation is exacerbated by an imbalance in the amino acid composition of the body, which leads to a decrease in the level of taurine in blood plasma and tissues. In violation of carbohydrate metabolism taurine can be used as a drug that has a positive effect on the links of pathogenesis at the level of adipose tissue and at the level of the liver.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.