Системная терапия микозов волосистых участков кожи: возможности адъювантных препаратов
- Аннотация
- Статья
- Ссылки
- English
Применяемые в качестве адъювантной терапии стандартные поливитаминные комплексы оказались менее эффективными, чем пробиотик-поливитаминные комплексы. В частности, последние ассоциировались с более ранней негативацией свечения волос в лучах лампы Вуда.
Применяемые в качестве адъювантной терапии стандартные поливитаминные комплексы оказались менее эффективными, чем пробиотик-поливитаминные комплексы. В частности, последние ассоциировались с более ранней негативацией свечения волос в лучах лампы Вуда.

Считается, что наиболее часто микроспорией страдают дети от шести до 14 лет, однако патология нередко встречается и у детей до года. У пациентов старше 15 лет доля поражения волосистой части головы снижается, но увеличивается процент поражения других волосистых зон. Речь, в частности, идет о пограничной зоне роста волос – зоне офиаза, зонах подбородка и лобка [1].
Системная терапия микозов волосистых участков кожи – одно из обязательных условий эффективности лечения, основной целью которого является быстрое и надежное купирование инфекционного процесса. Подавление размножения патогенного гриба и его своевременная элиминация позволяют избежать необратимых поражений аппарата волоса и восстановить его к моменту полного излечения [1, 3]. При микроспории продолжительность системной терапии обычно составляет шесть – восемь недель, при трихофитии – четыре – шесть (без учета времени на определение излеченности) [3–5].
На сегодняшний день для системной терапии микозов волосистой части головы показаны четыре основных вещества (молекулы). Первые два – ксенобиотики, искусственно синтезированные вещества. К таковым относятся флуконазол и итраконазол – соединения группы имидазола [3, 4, 6]. Два вторых представляют собой природные соединения, либо соединения, используемые в неизмененном виде (гризеофульвин), либо соединения, имеющие природные аналоги (тербинафин) [4].
Гризеофульвин – вещество, синтезируемое грибом Penicillium griseofulvum (P. nigricans). Гризеофульвин относится к группе гризанов. Его молекула имеет определенное сходство с молекулой пенициллина [3, 7].
Вещество было обнаружено в культуре гриба в 1938 г., однако только 20 лет назад начато его применение в медицинских целях.
Гризеофульвин является фунгистатиком. Его активность проявляется только в отношении дерматомицетов (дерматофитов).
Механизм действия указанного препарата связан с нарушением синтеза нуклеиновых кислот. Проникая в ядро клетки через микротубулярные структуры, гризеофульвин связывается с белками внутри ядерных канальцев и вызывает нарушение их проводящих функций. В результате нарушения транспорта различных метаболитов прекращается рост гриба и спорообразование, митоз останавливается на стадии метафазы, образуются многоядерные клетки. Изменения в клеточной стенке являются вторичными – в результате нарушения синтеза белка [7, 8].
Минимальная ингибирующая концентрация гризеофульвина для дерматомицетов – 0,1–0,5 мкг/мл [7, 8].
Помимо противогрибкового действия гризеофульвин обладает противовоспалительным, сосудорасширяющим и иммуносупрессивным свойствами, способен улучшать трофическую функцию периферических нервов.
Необходимо отметить, что в настоящее время область применения гризеофульвина постепенно сужается. Однако препарат по-прежнему занимает свою нишу в терапии микозов волосистых участков кожи у детей и подростков.
Схема применения препарата обусловлена его фармакокинетикой: концентрация вещества медленно снижается в течение 48 часов после приема и уже через 72 часа не определяется в роговом слое. Поэтому была рекомендована трехэтапная схема терапии. На первом (основном) этапе гризеофульвин принимают в дозе 21–22 мг/кг/сут. Суточную дозу делят на три приема с равными интервалами – по восемь часов [1]. Длительность первого этапа лечения в среднем составляет две-три недели (пока не прекратится свечение волос в лучах лампы Вуда и не перестанут обнаруживаться грибы в растворе КОН). На втором этапе гризеофульвин назначают через день, при этом суточная доза не меняется. Продолжительность этого этапа – две недели. Если грибы не обнаруживают при микроскопическом исследовании, пациента переводят на прием гризеофульвина два раза в неделю, то есть через 48 часов, суточная доза остается прежней. Продолжительность третьего этапа, как правило, составляет две недели [3, 9].
Следует подчеркнуть, что на данный момент времени гризеофульвин используется исключительно для лечения микроспории волосистой зоны кожи. Поэтому рассматриваются терапевтические дозы из расчета 21–22 мг/кг/сут. Это расчетные дозы для микродисперсного гризеофульвина с размером частиц около 4 мкм. Использование ультрамикродисперсного гризеофульвина с размером частиц менее 4 мкм позволяет снизить суточную дозу до 15–16 мг/кг, что достигается благодаря повышению биодоступности. Как показывает практика, применение препарата в дозе 15 мг/кг/сут приводит к формированию устойчивости даже у грибов рода Microsporum [3, 10].
Снижение суточной дозы препарата позволяет снизить нежелательные реакции терапии, которые, как правило, носят дозозависимый характер.
Как отмечалось ранее, гризеофульвин обладает довольно выраженным иммуносупрессивным действием. На фоне его приема обостряются хронические инфекции (как правило, ЛОР-органов). Поэтому, если во время терапии гризеофульвином пациент заболевает острой респираторной вирусной инфекцией или гриппом, лечение следует прервать во избежание развития осложнений [3, 5].
Гризеофульвин также обладает нефротоксичностью, гепатотоксичностью, коканцерогенным (усиление роста уже имеющейся опухоли), эмбриотоксическим, тератогенным и фотосенсибилизирующим эффектами. Данная терапия также ассоциируется с ортостатическим коллапсом вследствие сосудорасширяющего действия, различными неврологическими нарушениями – от снижения быстроты реакции до токсического энцефалита [7, 8].
Частота возникновения указанных нежелательных явлений не менее 15%, что не отвечает стандартам Надлежащей производственной практики (Good Manufacturing Practic – GMP) [2, 9].
Существенным побочным эффектом гризеофульвина является нарушение всасывания в кишечнике витаминов, преимущественно группы В. Этот эффект также носит дозозависимый характер. Однако степень его выраженности зависит от индивидуальных особенностей пациента – от незначительного гиповитаминоза в виде слабых проявлений хейлоза (заеды на фоне гиповитаминоза В2) до выраженных пеллагроподобных высыпаний (гиповитаминоз РР) или неврологических нарушений (гиповитаминоз В1). Несколько реже на фоне терапии гризеофульвином у детей встречается гиповитаминоз В6 и В12. Очевидно, что индивидуальны не только количественные показатели гиповитаминоза, но и качественные. Патологическое снижение концентрации витаминов может отмечаться как по одному веществу, так и по нескольким, доходя до пангиповитаминоза [7, 11].
Количественные и качественные показатели снижения биодоступности витаминов обусловлены активностью ряда кишечных ферментов. Активность и устойчивость ферментативных систем – наследуемые признаки. В норме врожденные нарушения ферментативной активности могут не проявляться, триггером могут стать те или иные вещества, попавшие в организм. Примером может служить фавизм – врожденное снижение активности (или количества) фермента глюкозо-6-фосфатдегидрогеназы. Данное состояние характеризуется возникновением токсических реакций (острая гемолитическая анемия) при приеме ацетилсалициловой кислоты, сульфаниламидных препаратов, садовых бобов. Аналогичная реакция наблюдается на фоне лечения гризеофульвином, с одной лишь разницей – нарушение может быть поливалентным [7, 12].
Каков же выход из этой ситуации? Во-первых, можно провести мониторинг концентрации витаминов в организме. Во-вторых, назначить адъювантные препараты. Последний способ является менее затратным.
Адъювантные препараты – средства, применяемые для нивелирования побочных эффектов основного лечения. При лечении микоза гризеофульвином в качестве адъювантных средств используют поливитаминные комплексы. Они позволяют компенсировать дефицит витаминов, вызванный препаратом.
Однако обычный поливитаминный комплекс не способен повлиять на состояние иммунной системы. Назначение нескольких адъювантных препаратов может привести к неоправданной полипрагмазии [8, 13].
Сказанное выше обусловливает целесообразность использования в качестве адъювантного средства препаратов, которые сочетали бы свойства поливитаминного комплекса и иммунного регулятора [14], например пробиотик-поливитаминных комплексов.
Известно, что препараты, содержащие кишечные бактерии человека, способны оказывать мощное системное иммунорегулирующее воздействие, очевидно за счет стимуляции кишечной микробиоты [11].
Все средства, нормализующие кишечную флору, можно разделить на четыре группы [14]:
- пробиотики (живые микроорганизмы): жидкие (на молочной сыворотке) и сухие (лиофилизированные);
- пребиотики (субстраты для поддержания жизнедеятельности нормальных микроорганизмов);
- синбиотики (комбинация пре- и пробиотика);
- симбиотики (сочетание различных пробиотических культур).
История применения пробиотиков в хозяйственной жизнедеятельности насчитывает не одно тысячелетие. Формирование научного подхода началось лишь со второй половины ХХ в.
Положительные свойства современных пробиотических препаратов обусловлены органичным сочетанием свойств указанных выше классов препаратов. Это позволяет не увеличивать до бесконечности количество микробных тел в одном грамме препарата, в то же время обеспечить оптимальное их количество – в пределах 107–108 КОЕ/г. Данной концентрации бактериям достаточно для создания колонии и биопленки [11].
Необходимо отметить, что механизм нарушения обмена витаминов зависит от антибактериального вещества. Так, натуральные и полусинтетические антибиотики воздействуют по типу синдрома мальабсорбции. Сульфаниламиды (полностью синтетические соединения – ксенобиотики) сами способны нарушать обмен витаминов, прежде всего фолиевой кислоты, за счет чего и обеспечивается их антибактериальное действие. Фторхинолоны нарушают синтез белка, как следствие, снижается ферментативная активность слизистой кишечника и развивается синдром наподобие мальабсорбции [14]. Гризеофульвин относится к натуральным пенициллинподобным антибиотикам [15].
По сути, пробиотик-поливитаминный комплекс – это адаптоген, позволяющий проводить последовательные и длительные курсы терапии антибактериальными препаратами без ущерба для кишечного биоценоза.
В настоящее время на российский фармацевтический рынок выведено четыре таких комплекса.
В нашем исследовании использован пробиотик-поливитаминный комплекс, содержащий пробиотические культуры Lactobacillus gasseri PA 16/8, Bifidobacterium bifidum MF 20/5, Bifidobacterium longum SP 07/3 – 107 КОЕ/г каждого вида [16, 17].
Данный препарат отличается удобством применения – один раз в сутки. Этого достаточно для достижения терапевтического эффекта. Длительность курса должна составлять не менее двух-трех месяцев. Продолжительность лечения влияет на устойчивость эффекта [17].
Целью нашего исследования стало сравнение эффективности пробиотик-поливитаминного комплекса и поливитаминного комплекса.
Материал и методы
Под наблюдением находилось 44 пациента с микроспорией волосистых участков кожи. Лиц мужского пола – 17, женского – 27. Возраст больных – от 11 до 18 лет. С микроспорией волосистой части головы – 32 человека, микроспорией иной локализации – 12. Поражение кожи бровей зафиксировано у шести пациентов, лобка – у трех, подбородка – у двух, век – у одного больного.
Диагноз «микроспория» подтверждали при обнаружении мицелия гриба. Для этого использовали раствор КОН.
Критерии включения в исследование:
- грибковое поражение волосистых участков кожи;
- показания к лечению гризеофульвином по стандартным схемам;
- отсутствие системных противопоказаний (в том числе аллергии на препараты пенициллинового ряда);
- отсутствие противопоказаний к приему гризеофульвина.
Критерии исключения:
- наличие показаний для проведения короткого курса терапии гризеофульвином, без соблюдения стандартной схемы (например, микроспория гладкой кожи с поражением пушковых волос);
- наличие противопоказаний к применению гризеофульвина;
- аллергия или иная непереносимость препаратов из группы пенициллинов;
- аллергия или иная непереносимость поливитаминных препаратов;
- обнаружение в очагах поражения спор грибов в отсутствие мицелия (диагноз не подтвержден).
Только у шести пациентов не фиксировалось свечение пораженных волос в лучах лампы Вуда. В четырех случаях пациенты обращались на второй – четвертый день заболевания, когда свечение отсутствует. В двух случаях свечение не отмечалось в течение всего срока наблюдения.
Посев на патогенные грибы выполнен в 26 случаях. Рост грибов обнаружен в 22: в 15 – Microsporum canis, в пяти – M. audouinii, в одном – M. ferrugineum, в одном – M. gallinae.
Строгими показаниями для выполнения посева считали отсутствие свечения волос в лучах лампы Вуда, выраженный воспалительный компонент в очагах с везикуляцией, наличие волос, обломанных на разном уровне.
В большинстве случаев очаги поражения на волосистых участках кожи были единичными.
Два и три очага поражения на волосистой части головы обнаружены у четырех пациентов (по два на каждый случай). Необходимо отметить, что большинство очагов микроспории на волосистой части головы достигали от 1 до 3 см и имели четкие границы.
При микроспории других локализаций единичные очаги выявлены в четырех случаях: в одном – в области лобка, в двух – в области подбородка и еще в одном – в области век. У восьми пациентов очаги были множественными – от двух до четырех.
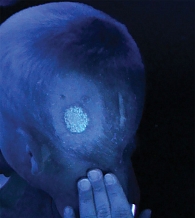
Во всех случаях воспаление проявлялось в виде эритемы от розового до ярко-красного цвета (рис. 1). Мелкие (милиарные) папулезные высыпания наблюдались как в центральной, так и в периферической зоне поражения. У пяти пациентов на этих участках отмечалась везикуляция. Шелушение в большинстве случаев было необильным, мелкопластинчатым.
В семи случаях волосы в пределах очагов поражения были обломаны над поверхностью кожи на разном уровне – от 3 до 12 мм.
Участники исследования были разделены на две группы. Первая группа (n = 20) получала в качестве адъювантного средства поливитаминный комплекс. Поливитаминный комплекс принимали по одной таблетке три раза в день. Вторая группа (n = 24) в качестве адъювантного средства использовала пробиотик-поливитаминный комплекс. Схема применения – по одной капсуле один раз в день.
Оба препарата пациенты применяли в течение всего периода системной терапии гризеофульвином. Продолжительность последней – от 33 до 58 дней.
Перед началом лечения все больные прошли обследование, включавшее общеклинический анализ крови с определением лейкоцитарной формулы и скорости оседания эритроцитов, общеклинический анализ мочи, биохимический анализ крови с оценкой аланинаминотрансферазы, аспартатаминотрансферазы, щелочной фосфатазы, мочевины, креатинина, билирубина, глюкозы.
Терапию гризеофульвином проводили в соответствии с клиническими рекомендациями Российского общества дерматовенерологов и косметологов 2015 г. На первом этапе препарат назначали в дозе 22 мг/мг/сут (обычно три недели), на втором – в той же суточной дозе через день (две недели), на третьем этапе – в той же суточной дозе два раза в неделю (как правило, две недели). Основанием для перехода от одного этапа к другому служило отсутствие мицелия гриба в контрольных исследованиях и свечения волос в очагах поражения.
Все пациенты получали одинаковую топическую терапию:
- утром – на очаги поражения 5%-ный раствор повидон-йода;
- вечером – противогрибковый крем.
При значительной везикуляции в течение первой недели вместо повидон-йода назначали фукорцин.
Раз в неделю пациентам с микроспорией волосистой части головы сбривали волосы в очагах поражения. В случае микроспории другой локализации применяли как бритье, так и депиляцию.
В качестве основного критерия эффективности комбинированной терапии выбран период времени до негативации свечения волос в пораженных зонах (рис. 2), дополнительного, служившего основанием для очередного взятия материала на наличие грибов в очаге поражения, – отсутствие новых папуло-везикулезных высыпаний, отрастание клинически неизмененных волос [18]. Важно отметить, что данный критерий является условным, так как пациенты в основном применяли цветные растворы для лечения (повидон-йод, фукорцин).
Результаты
Клинический эффект отмечен у пациентов обеих групп. Это выражалось в уменьшении интенсивности свечения волос и шелушения в очагах поражения, а также в постепенном отрастании здоровых волос. Светящаяся часть волос была приподнята над уровнем кожи и легко удалялась при сбривании.
В первой группе время до негативации свечения в среднем составило 24,55 ± 0,61 дня, во второй – 22,79 ± 0,56 дня (p < 0,05).
Сроки исчезновения грибов при последующих контрольных исследованиях статистически не выверялись, так как данный показатель в значительной степени регламентирован существующими рекомендациями Российского общества дерматовенерологов и косметологов и другими стандартами. Кроме того, определенная иррациональность вносилась пациентами и их родителями, не всегда четко выполняющими программу визитов к врачу.
Дополнительным преимуществом пробиотик-поливитаминного комплекса можно считать меньшую частоту относительных неудач лечения, когда мицелий патогенных грибов обнаруживали в одном из анализов в период установления излеченности. В первой группе таких случаев было два (во время второго контрольного анализа на грибы), во второй – один (во время первого контрольного анализа на грибы). У таких пациентов системная терапия не возобновлялась, однако назначалось дополнительное наружное средство.
Вывод
Гризеофульвин остается препаратом выбора при лечении микроспории волосистых участков кожи различной локализации у детей от шести до 18 лет. Данный препарат обладает иммуносупрессивным свойством, а также снижает биодоступность витаминов группы В. Поэтому при его назначении показаны адъювантные средства, нивелирующие отрицательное влияние такой терапии. Стандартными адъювантными препаратами являются поливитаминные комплексы. В настоящее время появились пробиотик-поливитаминные комплексы. Они считаются более предпочтительными, так как позволяют полностью нивелировать отрицательное воздействие гризеофульвина. Как следствие, повышается эффективность патогенетического лечения.
A.B. Yakovlev, PhD
Central State Medical Academy of the Administrative Department of the President of the Russian Federation
Contact person: Aleksey Borisovich Yakovlev, ale64080530@yandex.ru
Griseofulvin remains the drug of choice for microsporosis of the scalp in children from 6 to 18 years. However, this treatment leads to the reduction of the bioavailability of B vitamins and immunosuppression.
Standard multivitamin complexes used as adjuvant therapy were less effective than probiotic-multivitamin complexes. In particular, the latter were associated with an earlier negation of the hair luminescence in the rays of the Wood’s lamp.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.