Скрининг кардиотоксичности с оценкой функции внешнего дыхания у онкологических больных с локализацией опухоли в средостении
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведено сравнительное проспективное исследование с динамическим наблюдением 80 больных с лимфомами, имевших внутригрудное поражение и без него, получавших кардиотоксичную химиотерапию (ХТ) с блеомицином, обладающим пульмонотоксичностью, а также другие варианты противоопухолевого лечения. Были исследованы показатели гемодинамики функции внешнего дыхания (ФВД) у включенных в исследование больных, с оценкой влияния локализации опухоли в области средостения и пульмонотоксичности ХТ. Статистическая обработка результатов осуществлялась с помощью программы STATISTICA.
Результаты. У 39% пациентов с внутригрудной локализацией опухоли, до начала ХТ параметры ФВД были менее 80% от должных величин. В результате исследования показано, что динамика жизненной емкости легких (ЖЕЛ) у больных с внутригрудным поражением и без него имела некоторые различия. У больных без внутригрудного поражения регистрируется статистически значимое закономерное увеличение этого показателя на фоне проводимой ХТ, р < 0,0001. У пациентов с внутригрудным поражением отмечается снижение медианы ЖЕЛ к моменту окончания противоопухолевого лечения по сравнению с больными без внутригрудного поражения. В ближайшем отдаленном периоде после окончания противоопухолевого лечения медианы ЖЕЛ у больных обеих групп сближаются и находятся в пределах референсных значений. При оценке параметров ЭКГ и ЭхоКГ признаков кардиотоксичности за время наблюдения выявлено не было.
При исследовании влияния пульмонотоксичности на показатели ФВД в группах больных, получавших и не получавших блеомицин, нами выявлено динамическое увеличение ЖЕЛ до нормальных значений, р = 0,024 и р = 0,0004 соответственно. При этом в группе больных, принимавших блеомицин, в период окончания ХТ происходило некоторое снижение ЖЕЛ. У пациентов, не получавших блеомицин, динамика ЖЕЛ закономерно представляет прямую по увеличению этого показателя на фоне проводимой противоопухолевой терапии.
Заключение. Проведенное исследование показало, что параметры ФВД у онкологических больных с локализацией опухоли в средостении соответствуют ответу на противоопухолевое лечение. Токсическое пульмонологическое действие блеомицина в составе применяемых схем ХТ клинически не выражено, не оказывает значимого влияния на параметры ФВД и не выявляется в ближайшем периоде после успешного завершения противоопухолевой терапии. В рамках скрининга кардиотоксичности не было выявлено изменений параметров ЭхоКГ и ЭКГ в период наблюдения.
Материал и методы. Проведено сравнительное проспективное исследование с динамическим наблюдением 80 больных с лимфомами, имевших внутригрудное поражение и без него, получавших кардиотоксичную химиотерапию (ХТ) с блеомицином, обладающим пульмонотоксичностью, а также другие варианты противоопухолевого лечения. Были исследованы показатели гемодинамики функции внешнего дыхания (ФВД) у включенных в исследование больных, с оценкой влияния локализации опухоли в области средостения и пульмонотоксичности ХТ. Статистическая обработка результатов осуществлялась с помощью программы STATISTICA.
Результаты. У 39% пациентов с внутригрудной локализацией опухоли, до начала ХТ параметры ФВД были менее 80% от должных величин. В результате исследования показано, что динамика жизненной емкости легких (ЖЕЛ) у больных с внутригрудным поражением и без него имела некоторые различия. У больных без внутригрудного поражения регистрируется статистически значимое закономерное увеличение этого показателя на фоне проводимой ХТ, р < 0,0001. У пациентов с внутригрудным поражением отмечается снижение медианы ЖЕЛ к моменту окончания противоопухолевого лечения по сравнению с больными без внутригрудного поражения. В ближайшем отдаленном периоде после окончания противоопухолевого лечения медианы ЖЕЛ у больных обеих групп сближаются и находятся в пределах референсных значений. При оценке параметров ЭКГ и ЭхоКГ признаков кардиотоксичности за время наблюдения выявлено не было.
При исследовании влияния пульмонотоксичности на показатели ФВД в группах больных, получавших и не получавших блеомицин, нами выявлено динамическое увеличение ЖЕЛ до нормальных значений, р = 0,024 и р = 0,0004 соответственно. При этом в группе больных, принимавших блеомицин, в период окончания ХТ происходило некоторое снижение ЖЕЛ. У пациентов, не получавших блеомицин, динамика ЖЕЛ закономерно представляет прямую по увеличению этого показателя на фоне проводимой противоопухолевой терапии.
Заключение. Проведенное исследование показало, что параметры ФВД у онкологических больных с локализацией опухоли в средостении соответствуют ответу на противоопухолевое лечение. Токсическое пульмонологическое действие блеомицина в составе применяемых схем ХТ клинически не выражено, не оказывает значимого влияния на параметры ФВД и не выявляется в ближайшем периоде после успешного завершения противоопухолевой терапии. В рамках скрининга кардиотоксичности не было выявлено изменений параметров ЭхоКГ и ЭКГ в период наблюдения.
Введение
В настоящее время достигнуты значительные успехи в лечении многих онкологических пациентов: пятилетняя выживаемость больных с лимфомой Ходжкина (ЛХ) достигает 90%, при неходжкинских лимфомах (НХЛ) – около 82%, в зависимости от патологоанатомического типа [1]. Лимфомы по своей распространенности занимают третье место в мире среди всех злокачественных новообразований, при этом большое число таких пациентов успешно завершают противоопухолевую терапию [2].
Довольно часто встречаются внутригрудные лимфомы (ВГЛ) – поражение внутригрудных лимфоузлов и органов средостения (от 17 до 46%) [3]. Однако мало изучено влияние опухоли, находящейся в непосредственной близости от органов дыхания и кровообращения, на показатели функции внешнего дыхания (ФВД) и гемодинамики.
Все большее внимание уделяется проблемам токсичности противоопухолевой терапии, определяющей не только различные осложнения во время проведения лечения, но и отдаленный прогноз у больных.
Наибольшая часть исследований нежелательных явлений противоопухолевой терапии посвящена кардиотоксичности [4]. Однако многие препараты обладают токсичностью, которая в большей степени направлена на другие органы и системы [5]. Одним из широко применяемых для химиотерапии (ХТ) препаратов является блеомицин, обладающий пульмонотоксичностью и широко применяемый в составе схем ХТ для лечения пациентов с лимфопролиферативными заболеваниями.
Одновременное воздействие двух факторов – локализации опухоли в средостении и пульмонотоксичности ХТ – на ФВД и гемодинамику у онкологических пациентов во время проведения противоопухолевого лечения и после его завершения стало предметом нашего исследования.
Цель исследования – определить влияние локализации опухоли в области средостения на функцию легких у пациентов с ВГЛ, находящихся на противоопухолевом лечении, сопровождающемся пульмонотоксическими эффектами.
Материал и методы
С целью исследования влияния внутригрудной опухоли на биомеханику дыхания и гемодинамические параметры нами были обследованы 80 больных с лимфомами: с поражением внутригрудных лимфатических узлов (n = 62) и без него (n = 18), получавших ХТ с использованием схем ABVD, BEACOP, EACODD-14, R-DA-EPOCH, RB, R-CHOP, N-AVD. Из 67 пациентов, обследованных нами в динамике во время противоопухолевого лечения и после его окончания, 46 больным был назначен блеомицин, обладающий пульмонотоксичностью.
Из 80 пациентов, включенных в исследование, 51 больной получал противоопухолевое лечение по поводу ЛХ, 29 пациентов – по поводу НХЛ. У единственной пациентки с НХЛ был диагностирован редко встречаемый вариант первичной медиастинальной лимфомы. У нее оказалась самая низкая жизненная емкость легких (ЖЕЛ), выходящая за пределы нижних значений нормы этого показателя. В соответствии с частотой встречаемости этого вида лимфом данные этой пациентки представлены отдельно.
Среди пациентов с ЛХ: 49 человек имели внутригрудное поражение, у 2 пациентов эти изменения отсутствовали. В группе больных НХЛ: у 13 (44,8%) человек было внутригрудное поражение.
Включенные в исследование пациенты обследовались в динамике: на первом визите – до начала ХТ, на втором визите – после 3-го курса ХТ, на третьем визите – после окончания ХТ, на четвертом визите – через 6–12 месяцев и более после окончания противоопухолевого лечения. Были обследованы: 51 пациент на четырех последовательных визитах, 9 больных – на трех визитах, 7 пациентов – на первом и втором визите, 13 больных – до начала лечения.
Поскольку пациенты в составе схем ХТ получали препараты, способные оказывать токсическое воздействие на миокард [6], при каждом визите проводилась электрокардиография (ЭКГ) с помощью электрокардиографа «Комплекс МИОКАРД-12» на скорости 25 мм/с длительностью не менее 30 с. Оценивались ритм, частота сердечных сокращений, продолжительность комплекса QRS, интервалов PQ и QT.
Эхокардиография (ЭхоКГ) выполнялась с помощью ультразвуковой диагностической системы экспертного класса на аппарате Simens ACUSON Sequoia 512, в положении лежа, на левом боку, с отведением левой руки за голову. Визуализация сердца осуществлялась в стандартных проекциях с применением В-режима, М-режима и допплеровских показателей (тканевой и импульсно-волновой). Оценивали следующие стандартные параметры ЭхоКГ: размер левого предсердия (ЛП), индекс объема левого предсердия, трикуспидальную регургитацию, конечно-диастолический размер правого желудочка, толщину межжелудочковой перегородки, конечно-диастолический размер левого желудочка, конечный диастолический объем, конечный систолический объем, фракцию выброса левого желудочка по Симпсону, среднее давление легочной артерии, время достижения максимальной скорости в аорте, объем правого желудочка в систолу и диастолу [7].
Для изучения влияния пульмонотоксичности используемой ХТ была выполнена оценка ФВД аппаратом «Спирограф Jaeger FlowScreen Pro». Перед началом каждого исследования проводились калибрование аппарата и подробный инструктаж пациентов. ФВД измеряли с 12.00 до 13.00 дня, были выполнены последовательно три исследования с дальнейшим выбором лучшей попытки. Параметры спирометрии определяли в процентах от должных величин. За нижнюю границу нормы принято 80% от должного показателя [8]. Проанализированы: ЖЕЛ, объем форсированного выдоха за 1 секунду (ОФВ1), индекс Тиффно (ИТ). Исследуемые параметры оценивали в процентах от должных величин.
Применялись непараметрические методы оценки значимости: метод Манна –Уитни был использован для сравнения двух независимых величин; при сравнении трех и более независимых величин применялся метод Краскела – Уоллиса с поправкой Бонферрони в необходимых ситуациях. При изучении ассоциации показателей использовалась корреляция Спирмена. Статистические выбросы определялись как показатели – более Q3 + (Q1–Q3) × 1,5 и менее (Q1–Q3) × 1,5 – Q1, где Q1 и Q3 – нижний и третий квартили соответственно, и не учитывались в статистической обработке. При анализе качественных признаков был использован критерий χ2. Данные представлены в виде медианы и интерквартильного размаха (25 и 75 процентилей), абсолютных чисел или процентов.
Результаты
В рамках скрининга кардиотоксичности применяемых схем химиотерапии, для оценки влияния внутригрудной опухоли на ФВД у пациентов с лимфомами мы проводили спирометрию на каждом визите. При первом обследовании у 39% пациентов с внутригрудным поражением ЖЕЛ и другие параметры ФВД были менее 80% от должных величин; у 9,4% – менее 70%. Среди больных со сниженными показателями: 66,7% – пациенты с ЛХ, 33% – с НХЛ, 21% – с анамнезом табакокурения, 12,5% – с ожирением. Клинически эти больные отличались мало, в группе со сниженными показателями ФВД было несколько больше больных, жаловавшихся на зуд (р = 0,036). Уровень лактатдегидрогеназы у пациентов с низкими показателями ФВД был повышен – 394,9 (262,6–595,1) Ед/л, в то время как в группе с нормальным уровнем показателей ФВД он составлял 239,6 (186,4–310,5) Ед/л, р = 0,0015. Возраст в группах с низкими и нормальными показателями ФВД не различался.
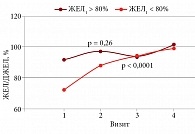
Исследование динамики ЖЕЛ при внутригрудном поражении в группах с ее различной исходной величиной (рис. 1) показало, что медианы ЖЕЛ быстро увеличиваются в группе с исходно сниженными показателями ФВД: 72,3 (68,1–78,8)% от должной ЖЕЛ (ДЖЕЛ) – на первом визите; далее последовательно – 88,2 (77,7–96,8)%, 94,7 (85,3–105,8)% и 99,4 (85,3–114,0)%; в то же время у больных с нормальными показателями ЖЕЛ на старте обследования в дальнейшем динамика была незначительной, с периодами повышения и снижения: 92,3 (87,8–98,2)% – на старте обследований, 97,4 (80,3–100,0)% – на втором визите, несколько меньше 93,8 (88,2–108,0)% – на третьем визите, и на четвертом ЖЕЛ вновь повышалась до нормальной величины – 101,5 (86,1 – 108,0)%.
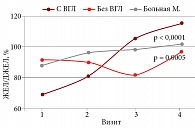
Динамика ЖЕЛ у больных с внутригрудным поражением и без него имела некоторые различия (рис. 2). На первом визите у больных без ВГЛ (n = 61) ЖЕЛ составляла 86,6 (75,9–94,2)%, на втором визите – 93,2 (85,4–99,3)%, на третьем – 93,8 (88,2–106,0)%, на четвертом – 99,4 (83,9–106,0)%. Несмотря на то что параметры ЖЕЛ находятся в пределах нормальных значений, отмечается статистически значимое закономерное увеличение этого показателя, р < 0,0001.
За время наблюдения у больных с ВГЛ отмечается некоторое снижение медианы ЖЕЛ к моменту окончания противоопухолевого лечения в сравнении с больными без внутригрудного поражения. К моменту четвертого визита медианы ЖЕЛ у больных обеих групп сближаются и находятся в пределах референсных значений.
На рисунке 2 также представлена кривая ЖЕЛ пациентки М., 34 года, с первичной медиастинальной лимфомой с массивным поражением легких. У этой больной до начала противоопухолевого лечения ЖЕЛ была самой низкой среди больных исследуемой группы – 64,4% ДЖЕЛ. Через 3 месяца (2-й визит) после начала ХТ отмечено значительное улучшение состояния (уменьшение кашля и одышки) и увеличение ЖЕЛ. На 3-м визите ЖЕЛ динамически увеличилась, полностью исчезли кашель и одышка. Через год после окончания ХТ и лучевой терапии ЖЕЛ стала в два раза больше, чем на старте лечения (115,0% ДЖЕЛ).
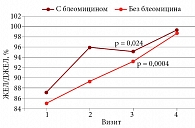
Для исследования влияния пульмонотоксичности блеомицина на показатели ФВД включенные в исследование больные были поделены на две группы: получающие ХТ с включением блеомицина (n = 21) и без него (n = 46).
На рисунке 3 видно, что в обеих группах наблюдалось динамическое увеличение ЖЕЛ до нормальных значений, р = 0,024 и р = 0,0004 соответственно. При этом именно в группе больных, принимавших блеомицин, на 3-м визите происходило некоторое снижение ЖЕЛ: 87,3 (75,6–105,3)% – на первом визите; 96,0 (89,6–99,3)% – на втором; 96,2 (90,0–108,5) % – на третьем; 99,4 (75,4–107,0)% – в отдаленном периоде после лечения (см. рис. 3). У больных, не получавших блеомицин, ЖЕЛ закономерно динамически увеличивается: 85,1 (75,9–92,3)%; 89,3 (79,3–98,7)%; 93,3 (86,5–104,0)%; 98,8 (85,5–105,0)% соответственно. Так же, как ЖЕЛ и ОФВ1, динамически увеличивался ИТ – от первого визита пациента к четвертому, р = 0,0007. Таким образом, положительная динамика показателей ФВД отражала влияние проводимого противоопухолевого лечения.
При исследовании параметров ЭКГ и ЭхоКГ признаков кардиотоксичности выявлено не было. Интересно, что на втором, третьем и четвертом визитах (на втором и четвертом статистически значимо) в группе со сниженными показателями ФВД увеличился индекс массы миокарда левого желудочка (ИММЛЖ) при сопоставимых значениях артериального давления (АД). В группе с нормальной исходной ФВД на втором визите ИММЛЖ – 94,8 (85,4–112,0) мл/м2 при 78,5 (66,6–86,1) мл/м2 на старте обследования; на четвертом визите – 93,6 (75,1–103,3) мл/м2 при 72,8 (66,2–87,2) мл/м2 на старте обследования. Таким образом, изменения ИММЛЖ соответствовали более выраженному снижению ФВД, при том что АД в группах не различалось. По-видимому, это является известным влиянием гипоксии на ремоделирование миокарда ЛЖ [9].
В нашем исследовании пульмонотоксическое действие блеомицина было инструментально заметным, но минимальным и не мешало восстановлению функции легких в отдаленном периоде.
Заключение
В результате проведенного исследования показано, что до начала ХТ у 39% пациентов с внутригрудной локализацией опухоли ЖЕЛ и другие параметры ФВД были менее 80% от должных величин; у 9,4% – менее 70%.
Исследование динамики ЖЕЛ на фоне ХТ при внутригрудном поражении в группах с ее различной исходной величиной показало, что медианы ЖЕЛ быстро увеличиваются в группе больных с исходно сниженными показателями ФВД, а у пациентов с нормальными показателями ЖЕЛ на старте обследования динамика в дальнейшем незначительная.
Было продемонстрировано, что динамика ЖЕЛ у больных с внутригрудным поражением и без него имела некоторые различия. Несмотря на то что параметры ЖЕЛ находятся в пределах нормальных значений, у больных без внутригрудного поражения регистрируется статистически значимое закономерное увеличение этого показателя на фоне проводимой ХТ, р < 0,0001.
У пациентов с внутригрудным поражением отмечается снижение медианы ЖЕЛ к моменту окончания противоопухолевого лечения по сравнению с больными без внутригрудного поражения. В ближайшем отдаленном периоде после окончания противоопухолевого лечения медианы ЖЕЛ у больных обеих групп сближаются и находятся в пределах референсных значений.
При исследовании влияния пульмонотоксичности на показатели ФВД в группах больных, получавших и не получавших блеомицин, мы выявили динамическое увеличение ЖЕЛ до нормальных значений, р = 0,024 и р = 0,0004 соответственно. При этом, именно в группе больных, принимавших блеомицин, в период окончания ХТ происходило некоторое снижение ЖЕЛ. У пациентов, не получавших блеомицин, динамика ЖЕЛ закономерно представляет прямую по увеличению этого показателя на фоне проводимой противоопухолевой терапии.
Проведенное исследование показало, что параметры ФВД у онкологических больных с локализацией опухоли в средостении соответствуют ответу на противоопухолевое лечение. При оценке параметров ЭКГ и ЭхоКГ признаков кардиотоксичности за время наблюдения выявлено не было.
Токсическое пульмонологическое действие блеомицина в составе применяемых схем ХТ клинически не выражено, не оказывает значимого влияния на параметры функции внешнего дыхания и не выявляется в ближайшем периоде после успешного завершения противоопухолевой терапии.
D.A. Paegle, E.I. Emelina, G.E. Gendlin, D.D. Ivanova, E.A. Baryakh, E.N. Misyurina, A.V. Arakelyan, V.O. Shpirko, G.S. Tumyan
N.I. Pirogov Russian National Research Medical University, Moscow
N.N. Blokhin National Medical Research Center of Oncology, Moscow
City Clinical Hospital No 52, Moscow
I.M. Sechenov First Moscow State Medical University
Contact person: Gennady E. Gendlin, rgmugt2@mail.ru
Aim. To determine the impact of mediastinal tumor location on cardiac and pulmonary function in patients with intrathoracic lymphomas undergoing antitumor treatment associated with cardiotoxic and pulmonary toxic effects.
Material and methods. A comparative prospective study with follow-up was conducted in 80 patients with lymphomas, with and without intrathoracic lesions, receiving cardiotoxic chemotherapy (CT) with bleomycin, which is associated with pulmonary toxicity, as well as other antitumor treatment options. Parameters of pulmonary function (FER) were analyzed in the included patients, assessing the impact of mediastinal tumor location and pulmonary toxicity of CT. Statistical processing of the results was performed using STATISTICA software.
Results. In 39% of patients with intrathoracic tumors, FER parameters were less than 80% of the predicted values before CT. The study demonstrated that the dynamics of vital capacity (VC) in patients with and without intrathoracic lesions differed slightly. In patients without intrathoracic lesions, a statistically significant, consistent increase in this indicator was recorded during chemotherapy, p < 0.0001. Patients with intrathoracic lesions showed a decrease in the median VC by the end of antitumor treatment compared to patients without intrathoracic lesions. In the immediate follow-up period after the end of antitumor treatment, the median VC in both groups converged and remained within reference values. No signs of cardiotoxicity were detected during the observation period when evaluating ECG and echocardiography parameters.
When examining the effect of pulmonary toxicity on respiratory function parameters in groups of patients who received and did not receive bleomycin, we found a dynamic increase in VC to normal values, p = 0.024 and p = 0.0004, respectively. Moreover, in the group of patients receiving bleomycin, there was a slight decrease in vital capacity at the end of chemotherapy. In patients not receiving bleomycin, vital capacity dynamics naturally followed a direct correlation with the increase in this indicator during antitumor therapy.
Conclusion. This study demonstrated that respiratory function parameters in cancer patients with tumors localized in the mediastinum correspond to the response to antitumor treatment. The toxic pulmonary effect of bleomycin in the chemotherapy regimens used is not clinically evident, does not significantly affect respiratory function parameters, and is not detectable in the immediate period after successful completion of antitumor therapy. Cardiotoxicity screening revealed no changes in echocardiogram and ECG parameters during the observation period.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.