Сорафениб в лечении метастатического рака почки
- Аннотация
- Статья
- Ссылки



Почечно-клеточный рак (ПКР) – одно из наиболее распространенных онкоурологических заболеваний. Ежегодно в мире диагностируют около 210 000 новых случаев ПКР, что составляет 2% в структуре онкологической заболеваемости [1]. В России в 2010 г. выявлено 18 723 больных со злокачественными опухолями почки. По темпам прироста заболеваемости злокачественными новообразованиями в России ПКР устойчиво занимает третье место после рака предстательной железы и опухолей головного мозга (40,85%). В России в 2010 г. от ПКР умерли 8526 человек [2].
«Золотым стандартом» лечения локализованного ПКР начальных стадий является хирургическое вмешательство, позволяющее излечить большинство больных. Однако впоследствии у 20–40% из них выявляют прогрессирование опухолевого процесса и появление метастазов. Хирургическое лечение метастатического ПКР (мПКР) возможно лишь при солитарном характере поражения, а в остальных случаях его возможности крайне ограничены. Согласно проведенным исследованиям, химиотерапия и лучевая терапия при мПКР неэффективны.
В настоящее время наиболее эффективным методом медикаментозного лечения мПКР является таргетная терапия, пришедшая на смену иммунотерапии. Применение таргетных препаратов при мПКР продемонстрировало хорошие результаты во всех исследованиях II и III фазы. В частности, зарегистрировано увеличение показателей выживаемости без прогрессирования при умеренно выраженной токсичности, а в некоторых исследованиях – увеличение показателей общей выживаемости больных мПКР.
В арсенале онкологов и урологов есть следующие таргетные препараты: сорафениб (Нексавар), сунитиниб (Сутент), темсиролимус (Торисел), бевацизумаб (Авастин), эверолимус (Афинитор), пазопаниб (Вотриент). Доступность нескольких препаратов для лечения мПКР подразумевает возможность их последовательного применения. В настоящее время активно обсуждается вопрос о комбинированном применении таргетных препаратов и выработке оптимальных режимов их назначения с целью улучшения показателей выживаемости и качества жизни больных [3–5].
Последовательное использование таргетных препаратов позволяет более длительно лечить больных до прогрессирования заболевания, обеспечивая получение оптимальных дозировок и хорошую переносимость лечения. Учитывая многочисленные патогенетические пути ПКР, последовательное применение таргетных препаратов позволяет в дальнейшем получать результат от терапии второй линии, несмотря на развитие резистентности к антиангиогенным препаратам, используемым в первой линии.
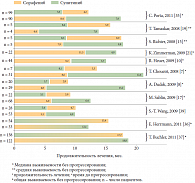
В настоящее время проведен ряд ретро- и проспективных клинических исследований с изучением последовательного использования таргетных препаратов у пациентов с мПКР (табл. 1, рис. 1), результаты которых указывают на отсутствие перекрестной резистентности между ними, подтверждая клинический потенциал этой стратегии [6–21].
Одно из первых пилотных исследований по последовательному применению таргетных препаратов провел R.J. Motzer с соавторами. В исследовании III фазы RECORD-1 (Renal Cell Cancer Treatment with Oral RAD001 Given Daily) изучалась эффективность применения эверолимуса у 410 больных мПКР после прогрессирования заболевания на фоне лечения таргетными препаратами сунитиниб и/или сорафениб. Согласно данным итогового статистического анализа, медиана выживаемости без прогрессирования в группе больных, принимавших эверолимус, составила 4,9 мес. против 1,9 мес. в группе плацебо (p < 0,0001). Медиана выживаемости без прогрессирования в группе больных, получавших эверолимус после предшествующей терапии сунитинибом, составила 3,9 мес., сорафенибом – 5,9 мес. и обоими препаратами – 4,0 мес. После итогового двойного слепого анализа частичный ответ зафиксировали у 5 (2%) больных и стабилизацию заболевания – у 185 (67%) пациентов из группы принимавших эверолимус, а в группе плацебо – ни у одного и у 45 (32%) пациентов соответственно. Достоверных различий в показателях общей выживаемости не выявлено: медиана общей выживаемости в группе больных, принимавших эверолимус, составила 14,78 мес. и в группе плацебо – 14,39 мес. (p = 0,177). Возможно, это обусловлено тем, что 79 из 98 (81%) пациентов в группе плацебо после регистрации прогрессирования заболевания начали получать эверолимус [11–13].
Получив убедительные данные о доказанной эффективности и безопасности эверолимуса в исследованиях III и II фазы, его включили в перечень основных рекомендаций по лечению диссеминированного ПКР как препарат второй линии для лечения мПКР при резистентности к другим таргетным препаратам [4–5]. Наибольший опыт накоплен по применению первых зарегистрированных и наиболее исследованных таргетных препаратов сорафениба и сунитиниба. До появления эверолимуса эти два препарата также назначали последовательно. Сорафениб (Нексавар) относится к группе мультикиназных ингибиторов, действующих одновременно как на рецепторы тирозинкиназы (VEGFR-2, VEGFR-3, PDGF-b, RET, с-KIT, FLT-3), так и на серин/треонинкиназы (С-Raf, B-Raf) в опухолевых и эндотелиальных клетках.
В регистрационное исследование III фазы TARGET (Treatment Approaches in Renal Cancer Global Evaluation Trial) включили 903 больных мПКР, получивших предшествующую иммунотерапию. Больных рандомизировали в группы, получающие сорафениб или плацебо. Согласно полученным результатам, медиана выживаемости без прогрессирования была достоверно больше в группе больных, получавших сорафениб, чем в группе плацебо (5,5 против 2,8 мес., p < 0,01). Частичный ответ зарегистрировали у 10% пациентов, получивших сорафениб, по сравнению с 2% в группе плацебо (р < 0,001). Окончательный анализ общей выживаемости с исключением пациентов из группы плацебо, переведенных на терапию сорафенибом, также выявил достоверное преимущество показателей общей выживаемости в группе сорафениба по сравнению с группой плацебо: 17,8 и 14,3 мес. соответственно (р = 0,0287) [22–25].
Медиана выживаемости без прогрессирования в исследованиях II и III фазы сорафениба в качестве препарата первой линии терапии в лечении диссеминированного светлоклеточного ПКР варьирует от 5,7 до 9,3 мес. [26, 27]. Эффективность и безопасность применения сорафениба подтверждены также в двух открытых исследованиях сорафениба с расширенными критериями включения ARCCS (Advanced Renal Cell Carcinoma Sorafenib), проводившихся в странах Северной Америки и Европы с участием 2504 и 1155 больных соответственно [28–30].
В открытое исследование сорафениба с расширенными критериями включения ARCCS, проводившееся в США и Канаде, включили 2504 больных мПКР, которым невозможно было провести таргетную терапию в рамках других исследований. В исследовании принимали участие пациенты с несветлоклеточными опухолями, метастазами в головной мозг, пожилого возраста, а также больные, ранее получавшие терапию другими препаратами, в том числе таргетными. Согласно опубликованным результатам, полный ответ на лечение был зарегистрирован у 1 (0,05%) из 1891 больных, частичный ответ – у 67 (4%) пациентов, стабилизация заболевания более 8 недель – у 1511 (80%) больных, прогрессирование заболевания – у 303 (16%) больных. Суммарный ответ на лечение (сумма полных, частичных ремиссий и стабилизации) достигнут у 84% больных. Медиана выживаемости без прогрессирования составила 36 недель, а медиана общей выживаемости – 50 недель. Различий в эффективности терапии сорафенибом в зависимости от гистологического варианта ПКР, наличия метастазов в головной мозг, возраста и ранее проводившегося лечения не отмечено. Наиболее часто встречающаяся токсичность 2-й степени тяжести, связанная с приемом препарата, включала ладонно-подошвенный синдром (18%), кожную сыпь (14%), гипертензию (12%) и слабость (11%) [28, 30].
В открытом исследовании сорафениба с расширенными критериями включения, проводившемся в странах Европы (EU-ARCCS), приняли участие 1155 больных. В исследование включили пациентов с несветлоклеточными опухолями, бессимптомными метастазами в головной мозг, с соматическим статусом по шкале ECOG 0–2 и ожидаемой продолжительностью жизни > 2 мес. Медиана выживаемости без прогрессирования составила 6,8 мес., а медиана продолжительности лечения – 6,9 мес. Таким образом, эффективность и безопасность применения сорафениба оказались сопоставимы с проведенными ранее рандомизированными исследованиями [28].
Препарат сорафениб одобрен в странах Европы (EMEA), США (FDA) и в 2007 г. зарегистрирован в России для лечения мПКР после неэффективной терапии цитокинами ИНФ-α или интерлейкином-2. Сорафениб входит в перечень основных международных (NCCN, EAU) и российских (Минздравсоцразвития РФ) рекомендаций по лечению мПКР в качестве стандарта второй линии терапии. Члены экспертной группы NCCN по раку почки, основываясь на данных, полученных по окончании исследований II фазы и исследований сорафениба с расширенными критериями включения, рекомендуют применять сорафениб в качестве препарата первой линии терапии некоторым больным нерезектабельным ПКР IV стадии или с прогрессированием после хирургического лечения. Рекомендуемые дозы для лечения сорафенибом – по 400 мг 2 раза в день перорально. Для удобства подбора дозы при возникновении выраженных побочных реакций препарат выпускается таблетках по 200 мг [4–5].
Так, M.P. Sablin и соавт. включили 90 пациентов в ретроспективное исследование по изучению последовательного назначения сорафениба после прогрессирования заболевания на фоне терапии сунитинибом, и наоборот. Из 68 больных, первично принимавших сорафениб и затем получивших сунитиниб, частичный ответ на лечение зарегистрировали у 10 (14,7%) пациентов, стабилизацию – у 35 (51,5%). Медиана выживаемости без прогрессирования в группе «сорафениб – сунитиниб» составила 26 недель для сорафениба и 28 недель для сунитиниба. Из 22 пациентов, у которых наблюдалось прогрессирование заболевания при терапии сунитинибом и которые затем были переведены на прием сорафениба, частичный ответ и стабилизация зарегистрированы у 3 (13,6%) и 11 (50%) больных соответственно. В группе «сунитиниб – сорафениб» медиана выживаемости без прогрессирования составила 22 недели для сунитиниба и 17 недель для сорафениба.
При сравнении показателей общей выживаемости выявлено достоверное преимущество в группе последовательного применения препаратов сорафениб – сунитиниб (135 недель), чем обратной их последовательности (82 недели). Средняя продолжительность последовательного лечения в группах «сорафениб – сунитиниб» и «сунитиниб – сорафениб» составила 61 и 49 недель соответственно. Каждый из вариантов последовательного применения препаратов был хорошо переносим и не увеличивал частоты возникновения побочных эффектов 3–4-й степени. По результатам проведенного исследования авторы сделали выводы об отсутствии абсолютной перекрестной резистентности между препаратами и высказали мнение, что в исследуемой популяции больных последовательное назначение препарата сунитиниб после прогрессирования на фоне терапии сорафенибом ассоциировалось с более продолжительной общей выживаемостью [32, 33].
В ретроспективное исследование, выполненное в Германии, включили 44 больных мПКР, на первом этапе получивших сорафениб, а затем (после прогрессирования заболевания) переведенных на сунитиниб. У 39 (88,6%) больных на фоне начальной терапии сорафенибом зарегистрировали стабилизацию и частичный ответ. Среди пациентов, переведенных на последовательное назначение сунитиниба, у 24 (54,4%) больных зафиксированы стабилизация и частичный ответ и у 20 пациентов – прогрессирование заболевания. Медиана выживаемости без прогрессирования на фоне первичного лечения сорафенибом составила 9,2 мес., в то время как в результате терапии второй линии сунитинибом – 5,7 мес. Общая продолжительность лечения таргетными препаратами составила 19 мес., причем время лечения больных, ответивших на терапию сунитинибом, оказалось более продолжительным. Согласно результатам проведенного исследования, авторы подтвердили целесообразность последовательного назначения таргетных препаратов и эффективность сунитиниба после сорафениба [34].
Группа исследователей под руководством C. Porta провела масштабное ретроспективное исследование, в которое включили 189 пациентов, из которых 90 первично принимали сорафениб и затем были переведены на терапию сунитинибом, а 99 больных на первом этапе принимали сунитиниб и затем были переведены на прием сорафениба. Группы «сорафениб – сунитиниб» и «сунитиниб – сорафениб» были сопоставимы по возрасту и соматическому статусу. В группе «сорафениб – сунитиниб» преобладали больные с более благоприятным прогнозом по шкале онкологического центра «Мемориал Слоана – Кеттеринга» (благоприятный/промежуточный/плохой: 50/39/10% против 41/26/32%). Медиана выживаемости без прогрессирования на первом этапе исследования в группах терапии сорафенибом и сунитинибом была сопоставима и составила 8,4 против 7,8 мес. (р = 0,75). После последовательного применения препаратов медиана выживаемости без прогрессирования оказалась достоверно более продолжительной в группе больных, первоначально принимавших сорафениб, чем в группе, получавшей сначала сунитиниб: 7,9 против 4,2 мес. соответственно (р < 0,001). Авторы сделали вывод об отсутствии перекрестной резистентности между препаратами и возможности их безопасного и эффективного применения. Исследователи полагают, что последовательное применение сорафениба и затем сунитиниба может приводить к увеличению показателей безрецидивной выживаемости. Единственным ограничением в этом исследовании является его ретроспективный характер [14, 35].
В исследование, проведенное в 9 клиниках Германии в период с 2002 по 2009 г. E. Herrmann и соавт., было включено 89 пациентов. Последовательную терапию ингибиторами тирозинкиназ применяли в качестве первой, второй и третьей линий после предшествующей химио- или иммунотерапии. При прогрессировании заболевания проводили смену препарата до следующего прогрессирования. Статистически достоверных различий в показателях выживаемости без прогрессирования между группой пациентов, получавших препараты в последовательности «сунитиниб – сорафениб», и больных, получавших таргетные препараты в обратной последовательности, не выявили (15,4 и 12,1 мес. соответственно). Общая выживаемость всех пациентов составила 28,8 мес. без статистически значимых различий между группами. Как и в предшествующих исследованиях, авторы отметили клиническую эффективность последовательного назначения сунитиниба и сорафениба. Однако данное исследование не дает ответ на вопрос о преимуществах той или иной последовательности данных препаратов [36].
Результаты крупного исследования, посвященного изучению оптимальной последовательности применения двух наиболее изученных таргетных препаратов – сорафениба и сунитиниба, опубликовали T. Buchler и соавт. В ретроспективном исследовании использовали чешскую базу данных, включавшую больных мПКР, принимавших таргетные препараты сорафениб и сунитиниб. В анализ включили 138 пациентов, получивших сунитиниб как препарат первой линии и сорафениб в качестве препарата второй линии, и 122 пациента, получавших таргетную терапию в обратной последовательности. Выживаемость без прогрессирования составила 17,7 мес. для пациентов, получавших сунитиниб в качестве первой линии, и 18,8 мес. для пациентов, получавших сорафениб (p = 0,47). Общая 1-летняя выживаемость больных, получавших терапию в последовательности «сунитиниб – сорафениб», составила 85% (ДИ 95%; 77–90%) и 84% (ДИ 95%; 77–91%) для больных, получавших таргетную терапию в последовательности «сорафениб – сунитиниб» (p = 0,99). Спектр токсичности был стандартным для данного класса препаратов, и у значительной части пациентов (от 14 до 25% для различных линий терапии) производили смену препарата либо завершали терапию ингибиторами тирозинкиназ. В отличие от большинства опубликованных ранее работ, в данном исследовании не было отмечено улучшения показателей общей выживаемости и выживаемости без прогрессирования среди пациентов, получавших терапию в последовательности «сорафениб – сунитиниб», по сравнению с последовательностью «сунитиниб – сорафениб» [37].
В метаанализ, проведенный F. Stenner и соавт., включили 860 пациентов из 11 исследований. 405 пациентов получали последовательную терапию препаратами сунитиниб – сорафениб и 455 – сорафениб – сунитиниб. Согласно результатам метаанализа, отмечено улучшение показателей выживаемости без прогрессирования в группе больных, получавших последовательность препаратов «сорафениб – сунитиниб», по сравнению с таковой «сунитиниб – сорафениб» – 15,3 против 12,4 мес. соответственно, p = 0,006. Статистически достоверных различий во времени до первого прогрессирования заболевания выявлено не было, вне зависимости от того, какой препарат был назначен в качестве терапии первой линии (медиана времени до первого прогрессирования оказалась в среднем на 0,13 мес. больше при последовательности «сорафениб – сунитиниб», p = 0,87).
При назначении сунитиниба в качестве препарата второй линии отмечено статистически достоверное увеличение выживаемости без прогрессирования (среднее увеличение составило 2,8 мес. по сравнению с сорафенибом, p = 0,0015). Авторы сделали вывод об отсутствии перекрестной резистентности между препаратами и о целесообразности их последовательного применения. По мнению исследователей, последовательное применение схемы «сорафениб – сунитиниб» позволяет увеличить показатели общей безрецидивной выживаемости по сравнению с последовательностью «сунитиниб – сорафениб». Влияние последовательной терапии с использованием препаратов сунитиниб и сорафениб в настоящее время не может быть оценено, так как необходимо завершение крупных проспективных исследований [38].
В настоящее время продолжаются исследования последовательной терапии при неэффективности или непереносимости других таргетных препаратов. Запланировано проведение ряда исследований III фазы по оценке эффективности и переносимости таргетных препаратов во второй линии лечения мПКР и исследования с последовательным назначением различных ингибиторов тирозинкиназ (табл. 2, 3) [20]. Окончательная выработка четких рекомендаций относительно последовательного применения таргетных препаратов станет возможной только после проведения крупных проспективных клинических исследований, а также после детального изучения механизмов резистентности. Поиск биологических характеристик опухоли и маркеров, варьирующих на фоне лечения, вероятно, поможет прогнозировать ответ на проводимую терапию.
Заключение
Появление группы таргетных препаратов позволило значительно улучшить прогноз течения заболевания для больных мПКР. Развивающаяся резистентность опухолей и непереносимость препаратов на фоне длительной терапии обусловливают необходимость проведения клинических исследований с целью поиска новых препаратов и схем лечения. В настоящее время в литературе активно обсуждается появление препаратов второй и третьей линии лечения мПКР после неэффективности ингибиторов тирозинкиназных рецепторов и ингибиторов mTOR. Целесообразность последовательного применения таргетных препаратов у больных мПКР подтверждена в ряде про- и ретроспективных исследований и обусловлена отсутствием перекрестной резистентности. Результаты нескольких клинических исследований продемонстрировали эффективность использования на первом этапе лечения препарата сорафениб с последующим назначением сунитиниба. Ожидаемые результаты продолжающихся крупных клинических исследований III фазы, вероятно, позволят ответить, в какой именно последовательности оптимально использовать таргетные препараты.
