количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Современная профилактика заболеваний, связанных с атеросклерозом: возможности статинов
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" №1
- Аннотация
- Статья
- Ссылки
Предполагается, что к 2030 году смертность от сердечно-сосудистых заболеваний (ССЗ) вырастет до 24,2 млн случаев в год.
В связи с этим остро стоит вопрос о совершенствовании профилактической стратегии, в том числе и в России, которая относится к странам высокого риска.
Предполагается, что к 2030 году смертность от сердечно-сосудистых заболеваний (ССЗ) вырастет до 24,2 млн случаев в год.
В связи с этим остро стоит вопрос о совершенствовании профилактической стратегии, в том числе и в России, которая относится к странам высокого риска.
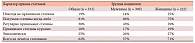
Таблица 1. Характер приема статинов больными ИБС/СД 2 типа в реальной клинической практике (программа ПОРА)

Таблица 2. Дозы статинов, принимаемые больными ИБС/СД 2 типа в реальной клинической практике (программа ПОРА)
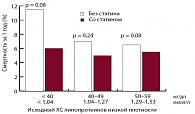
Рис. 1. Влияние статинов на смертность у пациентов с низким уровнем ХС ЛНП (< 1,55 ммоль/л)

Таблица 3. Влияние терапии розувастатином (20 мг) на ССО в исследовании JUPITER

Таблица 4. Причины низкой приверженности больных ИБС/СД 2 типа терапии статинам в реальной клинической практике (программа ПОРА). Мнение 531 п
Атеросклероз – основная причина развития ССЗ. Заболевание начинается в молодом возрасте и постоянно прогрессирует. Гемодинамически значимым считается уменьшение внутреннего просвета коронарной артерии (КА) на 50% и более, а сужение на 100% рассматривается как окклюзия КА. Выявление общих механизмов в процессе развития атеросклероза и тромбообразования привело к появлению в конце ХХ века термина атеротромбоз [1]. Именно тогда стало очевидно, что формирование, рост и разрыв атеросклеротической бляшки очень тесно связаны с активацией тромбоцитов, каскадом коагуляции и системой фибринолиза. Морфологически атеротромбоз – это бляшка с поврежденной (разрыв, трещины или эрозии) поверхностью, «прикрытой» тромботическими массами (тромбом). В конечном счете, именно атероматозная бляшка является причиной всех острых сосудистых катастроф.
Клинические проявления атеротромбоза зависят от локализации атеромы и размеров тромбов и реализуются в виде разнообразных форм ишемической болезни сердца (ИБС), мозговых инсультов, перемежающейся хромотой, абдоминальной жабы, признаваемыми наиболее частыми причинами смерти большинства жителей планеты. В настоящее время хорошо известны факторы риска (ФР), обуславливающие развитие атеросклероза и атеротромбоза. Это – артериальная гипертония (АГ), гиперхолестеринемия (ГХС), курение, сахарный диабет (СД), наследственная предрасположенность, низкая физическая активность, ожирение.
Среди факторов, играющих первостепенную роль в атерогенезе, выделяют нарушения процессов синтеза и транспорта холестерина (ХС). Формирование атеросклеротической бляшки в артериях напрямую связано с повышением в крови содержания липопротеидов низкой плотности (ЛНП), способных модифицироваться в окисленные мелкие плотные частицы и доставлять в сосудистую стенку избыточное количество ХС. При появлении ГХС вероятность развития сердечно-сосудистых осложнений (ССО) увеличивается в 1,6 раза, но если ГХС выявляется у пациента с ССЗ, то вероятность развития ССО возрастает до 6 раз [2].
При лечении пациента, страдающего заболеваниями, обусловленными атеросклерозом, следует не только проводить симптоматическую терапию (профилактика приступов стенокардии, устранение болевого синдрома), но и решать стратегические задачи, выполняемые в рамках программ вторичной профилактики – снижение смертности, продление жизни, уменьшение риска развития осложнений, госпитализаций и потребностей в инвазивных вмешательствах.
Вторичная профилактика ССО в реальной клинической практике
Анкетирование 87 врачей из 10 регионов России в многоцентровой клинической программе ПОРА (Программа Оценки эффективности симвастатина у пациентов с ИБС и/или сахаРным диАбетом 2 типа, 2008 г.) выявило интересные тенденции. Так, в четверку препаратов, которые врачами считаются наиболее важными для вторичной профилактики у больных ИБС, вошли: бета-адреноблокаторы (92%), антиагреганты (90,8%), статины (85,1%) и ингибиторы ангиотензинпревращающего фермента (ИАПФ, 67,8%). В то же время реально назначаемые врачами препараты распределились следующим образом: бета-адреноблокаторы (97,7%), ИАПФ (96,5%), антиагреганты (94,3%), пролонгированные нитраты (81,6%). При этом, статины пациентам высокого риска (при ИБС) врачи назначают только в 54% случае, а 20% больных ИБС продолжают принимать фитопрепараты и витамины, не имеющие доказанной эффективности. Главный недостаток современной терапии – назначение врачами препаратов в неадекватных дозах, и как следствие – недостижение целевых уровней ФР. Это напрямую связано с успехом или не успехом проводимых профилактических мероприятий против атеросклероза. Так, по данным программы ПОРА у больных ИБС/СД 2 типа были зарегистрированы средние значения следующих показателей:
Липидснижающие цели профилактики
Первичной профилактической целью является снижение уровня ХС ЛНП в крови пациента и его жесткий пожизненный контроль. Проведенные в последние годы многоцентровые исследования установили клинически полезный (желаемый) уровень ХС ЛНП, к которому надо стремиться при приеме гиполипидемического средства: при высоком ССР – ХС ЛНП < 2,5 ммоль/л (в российских рекомендациях < 2,0 ммоль/л), а при низком и среднем ССР – < 3,0 ммоль/л. Возможно, и эти пределы в полной мере не отражают той максимальной клинической пользы, которая обусловлена снижением концентрации ХС ЛНП на терапии статинами. Этим объясняется постоянное «ужесточение» целевых уровней липидов. Появляется все больше доказательств того, что достижение целевого уровня ХС ЛНП < 1,8 ммоль/л с помощью терапии статинами имеет большие предпочтения для пациентов очень высокого риска: с острым коронарным синдромом (ОКС), КБС или другими атеросклеротическими заболеваниями, сочетающимися с множественными неконтролируемыми или плохо контролируемыми ФР (например, с курением), метаболическим синдромом. Данные метаанализа O`Keefe J.H. (2004) позволили определить уровень ХС ЛНП, при котором не происходит прогрессирование атеросклероза – 1,7 ммоль/л и ниже.
Какую дозу статина выбрать при инициации терапии? Согласно проведенным исследованиям оптимальной является доза статина, при которой концентрация ХС ЛНП в сыворотке крови снижается на 30–40%, что вызывает соответствующее снижение риска КБС в течение 5 лет. Существует и другая точка зрения. В канадских рекомендация 2009 года по диагностике и лечению дислипидемий и профилактике ССЗ у пациентов любого (от высокого до низкого) уровня ССР снижение концентрации ХС ЛНП должно достигать 50% и более от исходного значения [8]. Концепция терапии статинами: «чем ниже ХС ЛНП, тем лучше клинический эффект». Решить проблему более быстрого достижения целевых уровней ХС позволяют препараты последней генерации, представляющие собой синтетические статины. В ряде сравнительных исследований (STELLAR, MERCURY I, II) розувастатин превосходил другие статины по своей гиполипидемической активности. В среднем уже на стартовой дозе (10 мг) он клинически значимо снижал (на 46%) концентрацию ХС ЛНП у большинства (70%) пациентов [9].
Такой выраженный холестерин-снижающий эффект розувастатина позволяет врачу в амбулаторных условиях решать ряд проблем: избавляет от длительного титрования дозы препарата и обеспечивает быстрое наступление благоприятного эффекта, в результате сокращается количество визитов пациента к врачу и повышается приверженность пациента терапии. В среднем снижение уровня ХС ЛНП составляет 52–63% для доз 10–40 мг соответственно [4]. Сильное холестеринснижающее действие розувастатина обусловлено выраженным (до 90%) блокированием (ингибированием) активности ключевого фермента синтеза ХС – ГМГ-КоА-редуктазы, прежде всего в гепатоцитах, и продолжительным периодом его полувыведения (19 ч).
У розувастатина имеется достаточно выраженный (скорее дозозависимый) эффект снижения концентрации ТГ: от 20% на дозе 10 мг до 26% на дозе 40 мг, который особенно заметен у пациентов с гипертриглицеридемией (снижение ТГ на дозах 10–40 мг от 37до 43%) [9, 10]. Концентрация ХС ЛВП при разных дозах розувастатина повышается от 7,7% до 9,6% (на фоне других статинов от 2,1 до 6,8%) [9]. Такое разностороннее влияние розувастатина на липидный спектр крови позволяет назначать его более широко в клинической практике: и при изолированной гиперхолестеринемии, и при комбинированных липидных нарушениях.
Клинические цели профилактики
Пристальное внимание клиницистов к статинам и порой необоснованная негативная критика этих препаратов напрямую связаны с теми поразительными позитивными результатами по профилактике осложнений атеросклероза и КБС, которых удалось достичь только после их появления в клинической практике. Так, снижая в крови концентрацию ХС ЛНП на 30% на фоне приема статина, можно ожидать уменьшение объема атеромы на 3%, риска развития инфаркта миокарда на 33%, мозгового инсульта на 29%, ССО на 28% и общей смертности на 22%. Эпидемиологические данные показали, что одновременное снижение уровня атерогенного ХС ЛНП на 1% и повышение концентрации антиатерогенного ХС ЛВП на 1% может дать уменьшение риска ССО (КБС) на 2% (при изменении только одного из этих показателей риск уменьшается на 1%). Очевидно, что суммирование процентных изменений уровней ХС ЛНП и ХС ЛВП – лучший предиктор снижения ССР. Например, при снижении у пациента ХС ЛНП на рекомендуемые 40% и повышении ХС ЛВП даже на 10% появляется вероятность уменьшения риска ССО на 50%.
Клиническая польза розувастатина связана не только с его гиполипидемической активностью, но и с его плейотропными свойствами: вазопротекцией, снижением окислительного стресса, подавлением асептического воспаления в стенке сосуда и атероме [11]. Противовоспалительные свойства статинов вызывают сегодня особое внимание, поскольку подтверждается наличие прямой взаимосвязи уровня ХС ЛНП с воспалительным процессом, за исключением стадии дестабилизации атеромы в период развития ОКС, где процессы асептического воспаления в атероме доминируют [11]. Маркером активности воспалительного процесса может выступать уровень высокочувствительного С-реактивного белка (СРБ). Противовоспалительная активность статина дозозависимая, например, при дозе розувастатина 10 мг концентрация СРБ снижается на 34%, при дозе 20 мг – на 40% [12].
Исследование JUPITER – первое крупное плацебо-контролируемое исследование эффективности первичной профилактики атеросклероза и его осложнений [13]. Оно показало ранний (менее 2 лет) достоверный эффект применения розувастатина в дозе 20 мг/сут у 8900 лиц без ССЗ и эквивалентов КБС в анамнезе с низким риском атеросклероза, с нормальным уровнем ХС ЛНП (критерий включения – менее 3,4 ммоль/л, исходное среднее значение в группах – 2,79 ммоль/л) и повышенный уровень СРБ (критерий включения – 2 мг/л и более, исходное среднее значение в группах – 4,3 мг/л). По результатам исследования снижение количества всех сердечно-сосудистых событий составило 44% (p < 0,0001), общей смертности – на 20% (p = 0,02). Динамика других событий в исследовании JUPITER представлена в таблице 3. При этом следует отметить хорошую переносимость 20 мг розувастатина. В национальных рекомендациях «Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза» (2009) указывается на значимость исследования JUPITER, открывающего широкие возможности для первичной профилактики ИБС и атеросклероза у лиц нормальным уровнем ХС ЛНП и повышенным уровнем СРБ [13].
Антиатеросклеротические цели профилактики
Важнейшей задачей профилактики является непосредственное влияние на атерогенез: при вторичной профилактике – не только замедление, но и приостановление и даже регресс (обратное развитие) атеросклеротических процессов в артериях, при первичной профилактике – это предотвращение развития атеросклероза. Первые исследования, изучающие возможность влияния статинов на процессы атерогенеза, появились в 1980-е годы, при этом эффективность статинов оценивалась посредством проведения повторных количественных коронароангиографических исследований. Однако коронароангиография имеет свои технологические ограничения. Так не ясно, что происходит с самой бляшкой под влиянием терапии (изменения просвета сосуда не отражают изменения размера бляшки из-за сосудистого ремоделирования), нет представления об атеросклеротической бляшке, расположенной в толще стенки сосуда, ее составе. С 2000-х годов с появлением новых инструментальных технологий (внутрисосудистого ультразвука (ВСУЗИ), мониторинга толщины комплекса интима-медиа, метода ядерно-магнитного резонанса) началась новая эра в изучении влияния статинов на атерогенез и атероматозную бляшку.
В рандомизированном плацебо-контролируемом исследовании METEOR (Measuring effects on intima media thickness: an evaluation of rosuvastatin) изучали эффективность розувастатина в дозе 40 мг/сут в течение 24 месяцев у пациентов (всего 984 человек) с относительно низким риском развития атеросклероза по данным измерения толщины комплекса интима-медиа (ТКИМ) [14]. После лечения розувастатином изменение максимальной ТКИМ во всех 12 сегментах сонной артерии (СА) было-0,0014 мм/год против +0,0131 мм/год в группе плацебо (разница -0,0145 мм/год, р < 0,001), в сегменте общей СА -0,0038 мм/год против +0,0084 мм/год на плацебо (разница -0,0122, р < 0,001), что указывало на регрессирование атеромы. Иначе говоря, результаты исследования METEOR указали возможный путь к уменьшению количества пациентов с высоким риском в будущем – активное назначение статинов уже на стадии формирования атеросклеротической бляшки.
В открытом несравнительном исследовании ASTEROID (A Study To Evaluate the effect of Rosuvastatin On Intravascular ultrasound-Derived coronary atheroma burden) изучали влияние розувастатина в дозе 40 мг/сут на размер атеросклеротической бляшки КА при использовании ВСУЗИ в течение 24 месяцев [15]. Достигнутый уровень ХС ЛНП в исследовании составил 1,6 ммоль/л. К концу исследования зарегистрировано достоверное снижение объема атеромы в наиболее пораженных сегментах КА. У 78,1%, т.е. у каждого второго пациента из трех, было продемонстрировано обратное развитие объема атеросклеротической бляшки. Причем, статистически значимое уменьшение объема атеромы наблюдалось в разных подгруппах: у мужчин и женщин, молодых и пожилых, пациентов с метаболическими нарушениями (диабет, ожирение) и без них, у больных с разным липидным спектром крови. Следует также отметить хорошую переносимость 40 мг/сут розувастатина пациентами. Итак, показано системное влияние розувастатина на разных этапах атерогенеза: в исследовании ASTEROID – у пациентов с верифицированным атеросклерозом коронарных артерий и высоким риском ССО, а в исследовании METEOR – у пациентов с начальными признаками атеросклероза и относительно низким риском ССО.
Практические аспекты применения статинов
Очевидно, уже настало время, когда статины в силу своей доказанной клинической эффективности и безопасности следует рассматривать как стратегически важные для сохранения и улучшения качества жизни препараты. Сегодня врачу необходимо преодолевать существующие барьеры «недоверия» и «боязни» побочных эффектов статинов, мотивируя пациентов к постоянному приему препаратов. При выборе статина следует учитывать соотношение «эффективность – стоимость». В клинической программе ПОРА, выполняемой в реальной практике, спрашивали пациентов, страдающих ИБС/СД 2 типа (n = 531), почему они принимают статины так редко или вообще не принимают их, несмотря на рекомендации лечащего врача? Как видно из таблицы 4, главные причины: каждый третий пациент считает, что у статинов высокий риск побочных эффектов, каждый третий пациент отказывается от приема препаратов из-за высокой стоимости, 29% забывают принимать статины, поскольку не имеют симптомов повышения ХС. Очень тревожный сигнал – пациенты не понимают необходимости контроля уровня ХС при отсутствии клинических симптомов, и считают, что для них более важно принимать другие препараты, на самом деле имеющие второстепенное значение.
Что делать? Вести разъяснительную работу, объяснять значимость приема статинов и назначать оптимальный по соотношению «эффективность – стоимость» препарат. Не так давно на фармацевтическом рынке появился новый генерик розувастатина – препарат Мертенил® (компания «Гедеон Рихтер»), который выпускается в дозах 5–40 мг. Мертенил® имеет доказанную биоэквивалентность оригинальному препарату. Появление генерика розувастатина – препарата Мертенил® – позволит существенно расширить возможности врача при назначении статинов для контроля уровня липидов крови и профилактических целей, а также несомненно будет способствовать повышению приверженности пациентов терапии.
Клинические проявления атеротромбоза зависят от локализации атеромы и размеров тромбов и реализуются в виде разнообразных форм ишемической болезни сердца (ИБС), мозговых инсультов, перемежающейся хромотой, абдоминальной жабы, признаваемыми наиболее частыми причинами смерти большинства жителей планеты. В настоящее время хорошо известны факторы риска (ФР), обуславливающие развитие атеросклероза и атеротромбоза. Это – артериальная гипертония (АГ), гиперхолестеринемия (ГХС), курение, сахарный диабет (СД), наследственная предрасположенность, низкая физическая активность, ожирение.
Среди факторов, играющих первостепенную роль в атерогенезе, выделяют нарушения процессов синтеза и транспорта холестерина (ХС). Формирование атеросклеротической бляшки в артериях напрямую связано с повышением в крови содержания липопротеидов низкой плотности (ЛНП), способных модифицироваться в окисленные мелкие плотные частицы и доставлять в сосудистую стенку избыточное количество ХС. При появлении ГХС вероятность развития сердечно-сосудистых осложнений (ССО) увеличивается в 1,6 раза, но если ГХС выявляется у пациента с ССЗ, то вероятность развития ССО возрастает до 6 раз [2].
При лечении пациента, страдающего заболеваниями, обусловленными атеросклерозом, следует не только проводить симптоматическую терапию (профилактика приступов стенокардии, устранение болевого синдрома), но и решать стратегические задачи, выполняемые в рамках программ вторичной профилактики – снижение смертности, продление жизни, уменьшение риска развития осложнений, госпитализаций и потребностей в инвазивных вмешательствах.
Вторичная профилактика ССО в реальной клинической практике
Анкетирование 87 врачей из 10 регионов России в многоцентровой клинической программе ПОРА (Программа Оценки эффективности симвастатина у пациентов с ИБС и/или сахаРным диАбетом 2 типа, 2008 г.) выявило интересные тенденции. Так, в четверку препаратов, которые врачами считаются наиболее важными для вторичной профилактики у больных ИБС, вошли: бета-адреноблокаторы (92%), антиагреганты (90,8%), статины (85,1%) и ингибиторы ангиотензинпревращающего фермента (ИАПФ, 67,8%). В то же время реально назначаемые врачами препараты распределились следующим образом: бета-адреноблокаторы (97,7%), ИАПФ (96,5%), антиагреганты (94,3%), пролонгированные нитраты (81,6%). При этом, статины пациентам высокого риска (при ИБС) врачи назначают только в 54% случае, а 20% больных ИБС продолжают принимать фитопрепараты и витамины, не имеющие доказанной эффективности. Главный недостаток современной терапии – назначение врачами препаратов в неадекватных дозах, и как следствие – недостижение целевых уровней ФР. Это напрямую связано с успехом или не успехом проводимых профилактических мероприятий против атеросклероза. Так, по данным программы ПОРА у больных ИБС/СД 2 типа были зарегистрированы средние значения следующих показателей:
- уровень артериального давления (АД) – 136/83 мм рт. ст. (при целевом уровне < 130/80 мм рт. ст.);
- уровень общего ХС – 6,26 ммоль/л (целевой уровень < 4,5 ммоль/л);
- уровень ХС ЛНП – 4,19 ммоль/л (целевой уровень < 2,5, а лучше
- < 2,0 ммоль/л);
- уровень частоты сердечных сокращений (ЧСС) – 70 уд/мин (целевой уровень 55–60 уд/мин).
- статины эффективно снижают уровень атерогенного ХС ЛНП;
- нормализуют уровень атерогенных триглицеридов (ТГ) и антиатерогенного ХС липопротеидов высокой плотности (ЛВП);
- имеют большую доказательную базу клинической эффективности в снижении риска развития атеросклероза, предотвращении его серьезных последствий и увеличения продолжительности жизни;
- позитивно влияют на несердечную патологию.
- с любыми клиническими проявлениями коронарной болезни сердца (КБС) – стабильной и нестабильной стенокардией, инфарктом миокарда, а также после реваскуляризации миокарда;
- с эквивалентами КБС – периферическим атеросклерозом (перемежающей хромотой), цереброваскулярной атеросклеротической болезнью (атеросклерозом мозговых артерий, транзиторной ишемической атаке, мозговым инсультом), аневризмой аорты, СД 2 типа и 1 типа с микроальбуминурией;
- без КБС, но при наличии двух и более факторов факторов риска или при значительном повышении уровня одного ФР, например, общего ХС до 8 ммоль/л и более, или ХС ЛНП до 6 ммоль/л и более, или АД 180/110 мм рт. ст. и более;
- имеющие близких родственников с ранним развитием заболеваний, обусловленных атеросклерозом (у родственников первой линии мужского пола < 55 лет и женского пола < 65 лет).
Липидснижающие цели профилактики
Первичной профилактической целью является снижение уровня ХС ЛНП в крови пациента и его жесткий пожизненный контроль. Проведенные в последние годы многоцентровые исследования установили клинически полезный (желаемый) уровень ХС ЛНП, к которому надо стремиться при приеме гиполипидемического средства: при высоком ССР – ХС ЛНП < 2,5 ммоль/л (в российских рекомендациях < 2,0 ммоль/л), а при низком и среднем ССР – < 3,0 ммоль/л. Возможно, и эти пределы в полной мере не отражают той максимальной клинической пользы, которая обусловлена снижением концентрации ХС ЛНП на терапии статинами. Этим объясняется постоянное «ужесточение» целевых уровней липидов. Появляется все больше доказательств того, что достижение целевого уровня ХС ЛНП < 1,8 ммоль/л с помощью терапии статинами имеет большие предпочтения для пациентов очень высокого риска: с острым коронарным синдромом (ОКС), КБС или другими атеросклеротическими заболеваниями, сочетающимися с множественными неконтролируемыми или плохо контролируемыми ФР (например, с курением), метаболическим синдромом. Данные метаанализа O`Keefe J.H. (2004) позволили определить уровень ХС ЛНП, при котором не происходит прогрессирование атеросклероза – 1,7 ммоль/л и ниже.
Какую дозу статина выбрать при инициации терапии? Согласно проведенным исследованиям оптимальной является доза статина, при которой концентрация ХС ЛНП в сыворотке крови снижается на 30–40%, что вызывает соответствующее снижение риска КБС в течение 5 лет. Существует и другая точка зрения. В канадских рекомендация 2009 года по диагностике и лечению дислипидемий и профилактике ССЗ у пациентов любого (от высокого до низкого) уровня ССР снижение концентрации ХС ЛНП должно достигать 50% и более от исходного значения [8]. Концепция терапии статинами: «чем ниже ХС ЛНП, тем лучше клинический эффект». Решить проблему более быстрого достижения целевых уровней ХС позволяют препараты последней генерации, представляющие собой синтетические статины. В ряде сравнительных исследований (STELLAR, MERCURY I, II) розувастатин превосходил другие статины по своей гиполипидемической активности. В среднем уже на стартовой дозе (10 мг) он клинически значимо снижал (на 46%) концентрацию ХС ЛНП у большинства (70%) пациентов [9].
Такой выраженный холестерин-снижающий эффект розувастатина позволяет врачу в амбулаторных условиях решать ряд проблем: избавляет от длительного титрования дозы препарата и обеспечивает быстрое наступление благоприятного эффекта, в результате сокращается количество визитов пациента к врачу и повышается приверженность пациента терапии. В среднем снижение уровня ХС ЛНП составляет 52–63% для доз 10–40 мг соответственно [4]. Сильное холестеринснижающее действие розувастатина обусловлено выраженным (до 90%) блокированием (ингибированием) активности ключевого фермента синтеза ХС – ГМГ-КоА-редуктазы, прежде всего в гепатоцитах, и продолжительным периодом его полувыведения (19 ч).
У розувастатина имеется достаточно выраженный (скорее дозозависимый) эффект снижения концентрации ТГ: от 20% на дозе 10 мг до 26% на дозе 40 мг, который особенно заметен у пациентов с гипертриглицеридемией (снижение ТГ на дозах 10–40 мг от 37до 43%) [9, 10]. Концентрация ХС ЛВП при разных дозах розувастатина повышается от 7,7% до 9,6% (на фоне других статинов от 2,1 до 6,8%) [9]. Такое разностороннее влияние розувастатина на липидный спектр крови позволяет назначать его более широко в клинической практике: и при изолированной гиперхолестеринемии, и при комбинированных липидных нарушениях.
Клинические цели профилактики
Пристальное внимание клиницистов к статинам и порой необоснованная негативная критика этих препаратов напрямую связаны с теми поразительными позитивными результатами по профилактике осложнений атеросклероза и КБС, которых удалось достичь только после их появления в клинической практике. Так, снижая в крови концентрацию ХС ЛНП на 30% на фоне приема статина, можно ожидать уменьшение объема атеромы на 3%, риска развития инфаркта миокарда на 33%, мозгового инсульта на 29%, ССО на 28% и общей смертности на 22%. Эпидемиологические данные показали, что одновременное снижение уровня атерогенного ХС ЛНП на 1% и повышение концентрации антиатерогенного ХС ЛВП на 1% может дать уменьшение риска ССО (КБС) на 2% (при изменении только одного из этих показателей риск уменьшается на 1%). Очевидно, что суммирование процентных изменений уровней ХС ЛНП и ХС ЛВП – лучший предиктор снижения ССР. Например, при снижении у пациента ХС ЛНП на рекомендуемые 40% и повышении ХС ЛВП даже на 10% появляется вероятность уменьшения риска ССО на 50%.
Клиническая польза розувастатина связана не только с его гиполипидемической активностью, но и с его плейотропными свойствами: вазопротекцией, снижением окислительного стресса, подавлением асептического воспаления в стенке сосуда и атероме [11]. Противовоспалительные свойства статинов вызывают сегодня особое внимание, поскольку подтверждается наличие прямой взаимосвязи уровня ХС ЛНП с воспалительным процессом, за исключением стадии дестабилизации атеромы в период развития ОКС, где процессы асептического воспаления в атероме доминируют [11]. Маркером активности воспалительного процесса может выступать уровень высокочувствительного С-реактивного белка (СРБ). Противовоспалительная активность статина дозозависимая, например, при дозе розувастатина 10 мг концентрация СРБ снижается на 34%, при дозе 20 мг – на 40% [12].
Исследование JUPITER – первое крупное плацебо-контролируемое исследование эффективности первичной профилактики атеросклероза и его осложнений [13]. Оно показало ранний (менее 2 лет) достоверный эффект применения розувастатина в дозе 20 мг/сут у 8900 лиц без ССЗ и эквивалентов КБС в анамнезе с низким риском атеросклероза, с нормальным уровнем ХС ЛНП (критерий включения – менее 3,4 ммоль/л, исходное среднее значение в группах – 2,79 ммоль/л) и повышенный уровень СРБ (критерий включения – 2 мг/л и более, исходное среднее значение в группах – 4,3 мг/л). По результатам исследования снижение количества всех сердечно-сосудистых событий составило 44% (p < 0,0001), общей смертности – на 20% (p = 0,02). Динамика других событий в исследовании JUPITER представлена в таблице 3. При этом следует отметить хорошую переносимость 20 мг розувастатина. В национальных рекомендациях «Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза» (2009) указывается на значимость исследования JUPITER, открывающего широкие возможности для первичной профилактики ИБС и атеросклероза у лиц нормальным уровнем ХС ЛНП и повышенным уровнем СРБ [13].
Антиатеросклеротические цели профилактики
Важнейшей задачей профилактики является непосредственное влияние на атерогенез: при вторичной профилактике – не только замедление, но и приостановление и даже регресс (обратное развитие) атеросклеротических процессов в артериях, при первичной профилактике – это предотвращение развития атеросклероза. Первые исследования, изучающие возможность влияния статинов на процессы атерогенеза, появились в 1980-е годы, при этом эффективность статинов оценивалась посредством проведения повторных количественных коронароангиографических исследований. Однако коронароангиография имеет свои технологические ограничения. Так не ясно, что происходит с самой бляшкой под влиянием терапии (изменения просвета сосуда не отражают изменения размера бляшки из-за сосудистого ремоделирования), нет представления об атеросклеротической бляшке, расположенной в толще стенки сосуда, ее составе. С 2000-х годов с появлением новых инструментальных технологий (внутрисосудистого ультразвука (ВСУЗИ), мониторинга толщины комплекса интима-медиа, метода ядерно-магнитного резонанса) началась новая эра в изучении влияния статинов на атерогенез и атероматозную бляшку.
В рандомизированном плацебо-контролируемом исследовании METEOR (Measuring effects on intima media thickness: an evaluation of rosuvastatin) изучали эффективность розувастатина в дозе 40 мг/сут в течение 24 месяцев у пациентов (всего 984 человек) с относительно низким риском развития атеросклероза по данным измерения толщины комплекса интима-медиа (ТКИМ) [14]. После лечения розувастатином изменение максимальной ТКИМ во всех 12 сегментах сонной артерии (СА) было-0,0014 мм/год против +0,0131 мм/год в группе плацебо (разница -0,0145 мм/год, р < 0,001), в сегменте общей СА -0,0038 мм/год против +0,0084 мм/год на плацебо (разница -0,0122, р < 0,001), что указывало на регрессирование атеромы. Иначе говоря, результаты исследования METEOR указали возможный путь к уменьшению количества пациентов с высоким риском в будущем – активное назначение статинов уже на стадии формирования атеросклеротической бляшки.
В открытом несравнительном исследовании ASTEROID (A Study To Evaluate the effect of Rosuvastatin On Intravascular ultrasound-Derived coronary atheroma burden) изучали влияние розувастатина в дозе 40 мг/сут на размер атеросклеротической бляшки КА при использовании ВСУЗИ в течение 24 месяцев [15]. Достигнутый уровень ХС ЛНП в исследовании составил 1,6 ммоль/л. К концу исследования зарегистрировано достоверное снижение объема атеромы в наиболее пораженных сегментах КА. У 78,1%, т.е. у каждого второго пациента из трех, было продемонстрировано обратное развитие объема атеросклеротической бляшки. Причем, статистически значимое уменьшение объема атеромы наблюдалось в разных подгруппах: у мужчин и женщин, молодых и пожилых, пациентов с метаболическими нарушениями (диабет, ожирение) и без них, у больных с разным липидным спектром крови. Следует также отметить хорошую переносимость 40 мг/сут розувастатина пациентами. Итак, показано системное влияние розувастатина на разных этапах атерогенеза: в исследовании ASTEROID – у пациентов с верифицированным атеросклерозом коронарных артерий и высоким риском ССО, а в исследовании METEOR – у пациентов с начальными признаками атеросклероза и относительно низким риском ССО.
Практические аспекты применения статинов
Очевидно, уже настало время, когда статины в силу своей доказанной клинической эффективности и безопасности следует рассматривать как стратегически важные для сохранения и улучшения качества жизни препараты. Сегодня врачу необходимо преодолевать существующие барьеры «недоверия» и «боязни» побочных эффектов статинов, мотивируя пациентов к постоянному приему препаратов. При выборе статина следует учитывать соотношение «эффективность – стоимость». В клинической программе ПОРА, выполняемой в реальной практике, спрашивали пациентов, страдающих ИБС/СД 2 типа (n = 531), почему они принимают статины так редко или вообще не принимают их, несмотря на рекомендации лечащего врача? Как видно из таблицы 4, главные причины: каждый третий пациент считает, что у статинов высокий риск побочных эффектов, каждый третий пациент отказывается от приема препаратов из-за высокой стоимости, 29% забывают принимать статины, поскольку не имеют симптомов повышения ХС. Очень тревожный сигнал – пациенты не понимают необходимости контроля уровня ХС при отсутствии клинических симптомов, и считают, что для них более важно принимать другие препараты, на самом деле имеющие второстепенное значение.
Что делать? Вести разъяснительную работу, объяснять значимость приема статинов и назначать оптимальный по соотношению «эффективность – стоимость» препарат. Не так давно на фармацевтическом рынке появился новый генерик розувастатина – препарат Мертенил® (компания «Гедеон Рихтер»), который выпускается в дозах 5–40 мг. Мертенил® имеет доказанную биоэквивалентность оригинальному препарату. Появление генерика розувастатина – препарата Мертенил® – позволит существенно расширить возможности врача при назначении статинов для контроля уровня липидов крови и профилактических целей, а также несомненно будет способствовать повышению приверженности пациентов терапии.
1. Панченко Е.П. Атеротромбоз: механизмы развития и реально проводимая терапия. Атеротромбоз. 2008; 1: 22–26.
2. Шальнова С.А., Деев А.Д., Оганов Р.Г. Факторы, влияющие на смертность от сердечно-сосудистых заболеваний в российской популяции. Кардиоваскулярная терапия и профилактика. 2005; 4(1): 4–9.
3. Grundy S.M., Cleeman J.I., Merz C.N. et al. National Heart, Lung, and Blood Institute; American College of Cardiology Foundation; American Heart Association. Implications of recent clinical trial for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation. 2004; 110: 227–39.
4. European Guidelines on Cardiovascular Disease Prevention in Clinical Practice. Eur. J. Cardiovasc Prevention and Rehabilitation 2007; 4 (Suppl. 2).
5. Российские рекомендации IV пересмотра. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. М., 2009.
6. Leeper N.J., Ardehali R., deGoma E.M., Yeidenreich P.A. Statin use in patients with extremely low-density lipoprotein levels is associated with improved survival. Circulation. 2007; 116: 613–618.
7. Shepherd J., Blauw G.J., Murphy M.B. et al. Pravastatin in elderly individuals at of vascular disease (PROSPER) randomized controlled trial. Lancet. 2002; 360: 1623–30.
8. Genest J., VcPherson R., Frohlich J. et al. 2009 Canadian Cardiovascular Society/Canadian guidelines for the diagnosis and treatment of dyslipidemia and prevention of cardiovascular disease in the adult – 2009 recommendations. Can J Cardiol. 2009; 25 (10): 567–579.
9. McKenney J.M., Jones P.H., Adamczyk M.A. et al. Comparison of efficacy of rosuvastatin verus atorvastatin, simvastatin, and pravastatin in achieving lipid goals: results from the STELLAR trial. Curr Med Res Opin. 2003; 19: 689–98.
10. Hunninghake D.B., Stein E.A., Bays H.E. et al. Rosuvastatin improves the atherogenic and artheroprotective lipid profile in patients with hypertriglyceridaemia. Coron Artery Dis. 2004; 15: 115–23.
11. Copin C., Davidson R., McTaggiart F. et al. Rosuvastatin reduces MMP-9 and MMP-7 secretion by human monocyte-derived macrophages. Int J Clin Pract. 2002; 124 (Suppl): 7.
12. Betteridge D., Gibson M. Effect of rosuvastatin and atorvastatin on LDL-C and CRP levels in patients with type 2 diabetes: results of the ANDROMEDA study. Atherosclerosis. 2004; 5 (Suppl):107 Abs M464.
13. Ridker P. et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008; 359: 2195–2207.
14. Crouse III J.R., Raichlen J.S., Evans G.W. et al. Effects of Rosuvastatin on progression of carotid intima-media thickness in low-risk individuals with subclinical аtherosclerosis. The METEOR trial. JAMA. 2007; 297: 1344–53.
15. Nissen S.E., Stephen J.N., Sipahi I. et al. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis. The ASTEROID trial. JAMA. 2006; 295: 1556–65.
Новости на тему
13.02.2025
14.05.2024
05.02.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
Предполагается, что к 2030 году смертность от сердечно-сосудистых заболеваний (ССЗ) вырастет до 24,2 млн случаев в год.
В связи с этим остро стоит вопрос о совершенствовании профилактической стратегии, в том числе и в России, которая относится к странам высокого риска.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
