Современные особенности проблемных ИППП
- Аннотация
- Статья
- Ссылки

Удельный вес хламидийной инфекции среди ИППП по некоторым данным составляет 30-50%. Так урогенитальный хламидиоз встречается в 2-4 раза чаще, чем гонорея, в 7,5 раз чаще, чем сифилис.
По данным CDC, частота регистрации УГХ в США в 2005 г. составила 332,5 на 100 тыс. населения. По некоторым оценкам, в Российской Федерации в год заболевает УГХ от 1,5 до 2 млн человек, при этом в большинстве наблюдений этиологический диагноз болезни не устанавливается. По данным ВОЗ, в 35-50% случаев хламидийная инфекция протекает под маской других заболеваний.
По статистике Всероссийского центра по хламидиозам, хламидийная инфекция диагностируется как:
- негонококковый уретрит – в 20-70%;
- постгонококковый уретрит – в 40-80%;
- цистоуретрит – в 30-40%;
- цервицит – в 30-50%;
- болезнь Рейтера – в 30-50%;
- сальпингит – в 20-30%;
- конъюнктивит – в 5-14%.
У 60% инфицированных хламидиями женщин увеличивается риск заражения ВИЧ, при этом штаммы ВИЧ-инфекции, выделенные от таких больных, более вирулентны.
Хламидии обнаруживают в 47% случаев при эктопии шейки матки. Имеются предположения, что гиперпластические процессы в шейке матки, вызываемые хламидиями, могут способствовать развитию опухоли. Так у женщин с неоплазией шейки матки хламидии обнаруживали в 8%, при цервикальном раке – в 18% случаев, а в группе контроля (здоровые женщины) – лишь в 1% случаев.
При бесплодии хламидии обнаруживают в 50-57% случаев. При этом наблюдают не только функциональные нарушения репродуктивной деятельности, но и вовлечение в процесс систем регуляции гомеостаза иммунокомпетентные клетки и др.
Частота хламидийного инфицирования при трубном бесплодии составляет 41-54%. После первого случая хламидиоза риск трубного бесплодия возрастает на 10%, а после третьего – на 50%.
В бесплодных браках 50-55% мужчин стерильны, из них у 64% стерильность обусловлена УГХ. Хламидии могут вызвать бесплодие в результате прямого воздействия на сперматозоиды вследствие плотного прилипания хламидии к мужским гаметам, что препятствует оплодотворению яйцеклетки. Изучение состава незрелых половых клеток эякулята у больных УГХ выявило нарушение мейотических процессов в клетках-предшественниках сперматозоидов.
Некоторыми авторами отмечено, что развитие вторичного бесплодия у женщин при восходящей хламидийной УГИ наблюдается в 6 раз чаще, чем при гонорее.
При эктопической беременности C. trachomatis обнаруживают в 9-30% случаев. За последние годы отмечено увеличение числа хламидиоза беременных (10-40%) и новорожденных. Инфицированные женщины в 40-60% случаев передают инфекцию новорожденным.
В возрасте 15-19 лет УГХ диагностируется у 46%, в 20-24 лет – у 30%.
Уровень заболеваемости достаточно высок не только среди взрослого населения и подростков, ведущих активную половую жизнь, но и среди детей младшего возраста, не живущих половой жизнью. Так при обследовании мальчиков до 12 лет, обратившихся в детский кабинет УГИ, у 67,4% была выявлена C. trachomatis. При этом клиническая картина УГХ соответствовала уретриту, а у 7,9% детей по УЗИ имелись следы перенесенного простатита.
Очень важно, что у 75% женщин отмечено асимптомное течение заболевания, а у подростков в 30-40% случаев имеет место скрытая хламидийная инфекция, которая протекает в течение 2-5 лет. Поэтому в некоторых странах приняты рекомендации по ежегодному скринингу на хламидиоз сексуально-активных подростков и женщин в возрасте 20-24 лет с целью предотвратить возможные последствия хламидийной инфекции.
Проведенные нами исследования позволяют рекомендовать для сохранения репродуктивного здоровья поколения проведение скрининга на хламидиоз в более ранних возрастных группах сексуально-активных подростков. Так при скрининговом обследовании нами 150 подростков в возрасте от 13 до18 лет обнаружено:
- наибольшая частота выявления C. trachomatis наблюдалась в возрасте 17 лет + 0,22;
- при этом моноинфекция C. trachomatis была отмечена в 14%. Сочетание с уреаплазмами, микоплазмами наблюдали в 54%, с бактериальным вагинозом – в 30%, с трихомонадами – в 2% случаев. Начало половой жизни регистрировалось в 14+1,08 лет, а количество половых партнеров преимущественно от 3 до 5. На момент обследования фиксирование C. trachomatis второй раз в жизни – у 14,6%.
При обследовании 300 пациенток различных возрастных групп с воспалительными заболеваниями половых органов в условиях гинекологического отделения (стационар и амбулаторный прием), C. trachomatis была обнаружена в 19,3% случаев.
Учитывая все вышеперечисленное, для сохранения репродуктивного здоровья поколения возможно рекомендовать проведение скрининга на хламидиоз в более ранних возрастных группах сексуально-активных подростков.
Этиология и патогенез
На IV Европейском конгрессе «Хламидия – 2000» (Хельсинки, 2000 г.) была принята новая международная классификация хламидий.
Определение генома уже известных видов хламидий способствовало пересмотру их номенклатуры.
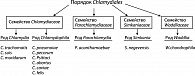
Классификация хламидий и хламидия-подобных микроорганизмов основана на наличии >95% гомологии в нуклеотидной последовательности генов 16S и 23S рРНК для всех представителей рода и >90% – семейства. Ранее неклассифицированные микроорганизмы, имеющие сходный с хламидиями цикл развития, были выделены в четыре дополнительных семейства в составе порядка Chlamydiales – Chlamydiaceae, Parachlamydiaceae, Simkaniaceae, Waddliaceae.
Наиболее радикальные изменения произошли в систематике семейства Chlamydiaceae, в котором в настоящее время выделено два рода – Chlamydia и Chlamydophila. Они отличаются между собой и по ряду фенотипических признаков. Представители рода Chlamydia, к которому относится единственный патогенный для человека вид Chlamydia trachomatis, содержат сходные по ультраструктуре экстрахромосомные элементы и способны накапливать гликоген во включениях. Элементарные тельца (ЭТ) представителей этого рода, внедрившись в клетку организма-хозяина, стремятся слиться в одно общее большое включение, биологический смысл которого состоит в обмене генетической информацией, что обусловливает большую генетическую вариабельность возбудителя.
Фундаментальные изменения, внесенные в классификацию представителей порядка Chlamydiales, должны быть учтены при диагностике хламидийной инфекции. Это связано с тем, что все виды, входящие в семейство Chlamydiaceae, обладают сходной структурой липополисахаридного антигена и распознаются моноклональными антителами, специфичными к трисахаридному фрагменту alphaKdo-(2-8)-alphaKdo-(2-4)-alphaKdo ЛПС. В связи с этим многие из них в ПИФ и серологических методах идентифицируются как Chlamydia trachomatis.
Chlamydia trachomatis имеют 2 биовара, 15 сероваров, вызывают трахому, урогенитальные заболевания, некоторые формы артрита, конъюнктивит и пневмонию новорожденных.
Возбудителем УГХ является C. trachomatis (серовары D, Da, E, F, G, H, I, Ia, J, K).
Возбудитель отличается уникальным циклом развития, затрудняющим воздействие на него специфических средств, возможностью к персистенции и образованию атипичной инфекции (одновременное присутствие всех стадий цикла размножения хламидий).
ЭТ хламидий имеют овальную форму при размерах 250-500 нм. Элементарные тельца – инфекционная внеклеточная форма, обладающая антигенными свойствами. Цикл развития хламидий происходит только внутри связанных с мембраной клетки вакуолей цитоплазмы, где ЭТ последовательно преобразовываются в более крупные ретикулярные тельца (РТ). РТ обладают полиморфизмом (округлой, овальной, полулунной, коккобациллярной формы), не имеют постоянного размера, величина их – от 300 до 1000 нм. Не обладают инфекционными свойствами, не имеют нуклеотида, проницаемы для трипсина и разрушаются ультразвуком. Это, так называемая, вегетативная (незрелая) внутриклеточная форма, способна к росту и делению, и только на этой фазе – эффективно применение антибиотиков.
В некоторых исследованиях доказано, что одни антибактериальные средства могут действовать на стадии превращения ЭТ в РТ, другие – во время бинарного деления РТ.
ЭТ (CE) обычно локализуются в крупных внутриклеточных включениях, РТ (CR) – в образованиях, ограниченных мембраной.
Инкубационный период – 5-30 дней с момента заражения (в среднем 10-14 дней).
Первым этапом инфекционного процесса является адсорбция ЭТ хламидий на плазмалемме чувствительной клетки организма-хозяина (действие электростатических сил). Внедрение хламидий происходит путем эндоцитоза в течение 7-10 часов. При этом ЭТ, внедряясь в клетку, использует для роста и размножения клеточную АТФ и через 6-8 часов превращается в РТ. Ранее считали, что хламидии существуют только за счет макроэргических соединений и биологических субстратов клетки хозяина. Однако в настоящее время доказано, что они способны синтезировать в небольших количествах собственную АТФ, отдельные аминокислоты, накапливать гликоген. В процессе роста и деления РТ образуют микроколонии – хламидийные включения (тельца Гальберштадтера-Провачека). В течение 18-24 часов развития они локализованы в цитоплазматическом пузырьке, образованном из мембраны клетки хозяина.
В микроколониях может содержаться от 100 до 500 ЭТ хламидий. Процесс созревания (промежуточные тельца) и трансформации РТ путем деления в ЭТ занимает 36-42 часа.
Полный цикл репродукции (48-72 часа) завершается разрушением пораженной клетки.
Хламидии могут высвобождаться из инфицированной клетки, сохраняя жизнеспособность клетки (при выходе ЭТ путем экзоцитоза), что приводит к бессимптомному течению заболевания.
Освободившиеся ЭТ проникают в новые клетки-мишени. При возникновении неблагоприятных биохимических условий продолжительность жизненного цикла может значительно увеличиваться.
В результате размножения C. trachomatis в инфицированных эпителиальных клетках развивается воспалительный процесс, выраженность которого зависит от состояния местного и общего специфического и неспецифического иммунитета организма.
После инвазии хламидий образуется комплемент, который приводит к стимуляции гранулоцитов. Эта воспалительная реакция сопровождается локальной гибелью клетки и разрушением ткани, что дополняется высвобождением фосфолипазы А² и простагландинов. Это приводит к отеку и гиперемии слизистой оболочки, нарушению целостности эпителиального слоя с частичной десквамацией эпителия.
Превращение РТ в ЭТ требует не только энергии, но зависит от присутствия биологических субстратов, среди которых важнейшее место занимает аминокислота триптофан. В процессе воспаления лимфоциты выделяют разнообразные цитокины (в т. ч. интерферон g), который индуцирует клеточный фермент индоламин-диоксигеназу (ИДО), разрушающий триптофан. Уменьшение триптофана приводит или к гибели хламидий, или к замедлению процессов репликации (клеточного деления), и в эпителиальной клетке начинают накапливаться неинфекционные, неделящиеся РТ. Цикл развития хламидий приостанавливается, но, несмотря на неблагоприятные условия, РТ сохраняют свою жизнеспособность (персистируют). Дальнейшее развитие и исход этого состояния зависят от продолжительности и уровня содержания триптофана. Уменьшение содержания интерферона g и, соответственно, увеличение внутриклеточного пула триптофана приводят к редифференцировке персистирующих форм в инфекционные ЭТ, их выходу из клетки и продолжению инфекционного процесса.
Однако недавно показано, что генитальные хламидии имеют собственный фермент, который позволяет синтезировать триптофан, используя в качестве субстрата индол, в результате чего полного нарушения жизненного цикла может не наступить и образование инфекционных ЭТ будет продолжаться. Продуцентом индола, в частности, может быть микрофлора влагалища. Это важно иметь в виду при наличии ассоциированных влагалищных инфекций (хламидии – анаэробы).
При хламидийной инфекции не срабатывает важное звено неспецифической резистентности – фагоцитоз. Взаимодействие хламидий с лимфоцитами и макрофагами не всегда завершается лизисом (циркуляция возбудителя с крово-и лимфотоком, персистенция, приводит к многоочаговости и преобладанию подострых и хронических форм). На стадии РТ хламидии недоступны для антител, лимфоцитов, макрофагов. Доступность этих факторов защиты возможна лишь на стадии ЭТ.
Основные факторы распространения хламидиоза
- Социальные факторы:
- алкоголизм, наркомания;
- низкий уровень жизни;
- увеличение числа разводов.
- Демографические факторы:
- молодые люди в возрасте 15-30 лет (хламидийная инфекция среди молодых женщин встречается в 5 раз чаще, чем у мужчин этой возрастной группы);
- снижение возраста полового созревания;
- увеличение возраста вступления в брак.
- Экономические факторы:
- международный туризм (в том числе секс-туры).
- Поведенческие факторы:
- раннее начало половой жизни;
- количество половых партнеров;
- недавняя смена полового партнера;
- нетрадиционные половые контакты.
Механизмы передачи инфекции
Контактный – реализация половым и неполовым (контактно-бытовым) путями.
Передача хламидий при сексуальном контакте с инфицированным больным происходит в 32-40% случаев.
Вертикальный – антенатальным, интранатальным путями.
- Восходящая хламидийная инфекция, пути передачи:
- каналикулярный – через цервикальный канал, полость матки, маточные трубы, на брюшину и органы брюшной полости;
- лимфогенный – по лимфатическим капиллярам;
- гематогенный – о чем свидетельствует наличие экстрагенитальных поражений (глотка, суставные сумки).
В распространении хламидий могут участвовать сперматозоиды, использование внутриматочных средств, различные гинекологические вмешательства.
Клиника
Классификация по МКБ-10:
- Хламидийная инфекция нижних отделов мочеполового тракта:
- цервицит;
- цистит;
- уретрит;
- вульвовагинит.
- Хламидийная инфекция органов малого таза и других мочеполовых органов:
- эпидидимит;
- воспалительные заболевания органов малого таза у женщин;
- орхит.
- Хламидийная инфекция аноректальной области.
- Хламидийный фарингит.
- Хламидийная инфекция другой локализации.
Хламидиоз может протекать в виде острого, подострого, хронического заболевания, но на современном этапе преобладает бессимптомное течение. Так клинические симптомы отмечаются лишь в 1/3 случаев УХ:
- слизистые, слизисто-гнойные выделения из цервикального канала и/или влагалища;
- боли в нижней части живота;
- посткоитальные и межменструальные кровянистые выделения;
- хронические тазовые боли;
- дизурия;
- диспареуния.
Помимо асимптомного течения УГХ в настоящее время отмечено увеличение частоты рецидивов УГХ. По данным различных авторов – от 2-50%.
Осложнения:
- ВЗОМТ;
- синдром Фитца-Хью Куртиса;
- бесплодие;
- внематочная беременность;
- привычное невынашивание беременности (13-25%);
- преждевременный разрыв плодного пузыря;
- преждевременные роды;
- послеродовый эндометрит;
- хориоамнионит, плацентит;
- внутриутробное инфицирование плода (8-12%), внутриутробная гибель плода;
- неудачи в попытках ЭКО.
Диагностика УХ
В настоящее время не существует лабораторного метода, позволяющего избежать как ложноположительных, так и ложноотрицательных результатов.
Необходимо учитывать предел чувствительности и специфичности каждого метода. Важна комплексная лабораторная диагностика (для того, чтобы выявить возбудителя, определить стадию заболевания, обосновать необходимость назначения антибактериальных препаратов). Таким образом, золотой стандарт в настоящее время – комбинация методов с использованием сертифицированных диагностических реагентов и тест-систем.
Методы диагностики
Иммунофлюоресцентный метод – прямая, непрямая иммунофлюоресценция (ПИФ, НПИФ). ПИФ – определение антигена с использованием моноклональных антител (сокращение ложноположительных результатов) против липополисахаридов (ЛПС) или основных белков наружной мембраны возбудителя. Выявляет жизнеспособные хламидии и их фрагменты. Чувствительность – 90-95%, специфичность – 98%. Регламентирован МЗ РФ.
Достоинство метода: быстрота, непосредственное определение возбудителя в небольшом объеме исследования, недостаток – ложноотрицательные результаты при гонорейно-хламидийном процессе, зависимость от человеческого фактора.
Культуральный метод – выделение жизнеспособного возбудителя на культуре клеток, обработанных различными антиметаболитами. Специфичность – до 100%, чувствительность – 80%. Референс-метод при оценке эффективности антибактериального лечения является стандартом, с которым сравнивают вновь разработанные методы диагностики.
Достоинство метода – достаточно обнаружения одной клетки с типичными цитоплазматическими включениями, определение чувствительности к антибиотикам. Недостаток – высокая стоимость, трудоемкость, возможность гибели хламидий при транспортировке.
Молекулярные методы:
- метод гибридизации нуклеиновых кислот (ДНК-зонды) – выделяют суммарную ДНК; чувствительность и специфичность – 80 и 100% соответственно; недостаток метода – высокая стоимость, риск переноса загрязнений между образцами и реагентами;
- методы амплификации нуклеиновых кислот (ПЦР, ЛЦР), рибосомальная РНК амплификация (ТМА – «transcription-mediated-amplification»);
- ПЦР – многократно повторяющиеся циклы синтеза (амплификация) специфической области ДНК-мишени в присутствии ДНК-полимеразы; высокая и регулируемая специфичность, высокая чувствительность позволяют определять жизнеспособные и нежизнеспособные микроорганизмы.
На основании амплификационных методик разработаны мочевые тесты, довольно удобные для применения в амбулаторной практике.
Дифференциальный диагноз
Проводится со специфическими урогенитальными инфекциями, обусловленными патогенными и условно-патогенными микроорганизмами на основании клинико-лабораторных критериев.
Уреамикоплазменная инфекция
Хотя в мире ежегодно регистрируется около 92 млн больных урогенитальным хламидиозом, предметом обсуждения на рабочем совещании специалистов различных отраслей медицины в Черногории в июне 2006 г. явилось рассмотрение роли микроорганизмов из рода микоплазм, приводящих к нарушению репродуктивной функции, как у женщин, так и у мужчин. Все большее количество данных подтверждает этиологическую роль микоплазм в развитии воспалительных процессов, как в нижнем отделе генитального тракта, так и причин ВЗОМТ (многие авторы в 1998-99 гг. не выделяли микоплазменную и уреаплазменную инфекции в структуре ВЗОМТ, однако, в современных публикациях 2003-2007 гг. есть данные о влиянии этих инфекций на эндометрий, миометрий с развитием эндометрита).
Существуют данные, доказывающие влияние уреаплазм на бесплодие, послеродовой эндометрит, хориоамнионит, самопроизвольные аборты, мертворождения, преждевременные роды, перинатальную заболеваемость и смертность, пневмонию, бактериемию, менингит, хроническую болезнь легких (бронхопульмональная дисплазия).
В случае с М. genitalium, отсутствие болезней и ассоциации могут отражать тот факт, что проведено недостаточно исследований с использованием соответствующих методов диагностики, поскольку этот вид хуже диагностируется, нежели М. hominis и Ureaplasma spp.
В 2007 году выработан консенсус специалистов, занимающихся вопросами диагностики и терапии инфекций, ассоциированных с микоплазмами:
- M. genitalium – патогенный микроорганизм, при выявлении – всегда этиотропное лечение. При выявлении U. urealyticum и M. hominis (условно патогенные микроорганизмы) лечение следует назначать, если нет других бактериальных/вирусных агентов:
- при наличии клинических и лабораторных признаков воспалительного процесса органов мочеполовой системы;
- при предстоящих оперативных или других инвазивных лечебно-диагностических манипуляциях в области мочеполовых органов;
- при отягощенном акушерско-гинекологическом анамнезе (невынашивание беременности, бесплодие, перинатальные потери и др.);
- при осложненном течении настоящей беременности, предполагающим возможное инфицирование плода.
Лечение следует назначать при наличии у пациентов клинических проявлений воспалительного процесса и в том случае, если U. urealyticum и M. hominis выявляются в количестве более 104 КОЕ/мл.
Лечение
- В настоящее время в лечении урогенитальной инфекции важное место занимают макролиды, которые в субингибиторных концентрациях оказывают воздействие на следующие факторы патогена, определяющие течение инфекции:
- адгезию на эпителиальных клетках;
- образование бактериальных токсинов;
- образование экзоэнзимов;
- подвижность бактерий;
- чувствительность к бактерицидному действию крови;
- состояние ультраструктуры бактериальных клеток.
Макролиды, являясь ингибиторами синтеза белка, связываются с 50S субъединицами бактериальной рибосомы, что приводит к нарушению процессов транслокации/транспептидации и преждевременному отщеплению растущей тРНК – полипептидной цепочки. Сборка белковой молекулы прекращается.
Существенное место в эффекте макролидов занимает их воздействие на процесс клеточного иммунитета и, в частности, фагоцитоз, задача которого помочь макроорганизму различными путями препятствовать развитию инфекционного процесса. Лейкоциты (нейтрофилы, моноциты, макрофаги) способны накапливать макролиды внутри лизосом из внеклеточной среды; доставлять их из интактных тканей или из сосудистого русла к очагу воспаления и выделять антибиотики из клеток в концентрациях, достигающих значений МПК или субингибирующих.
Итог взаимодействия клеточных механизмов защиты и макролидов зависит от множества реагирующих факторов. Та часть бактериальной популяции, которая сохранила жизнеспособность под воздействием антибиотика на уровне его МПК, может повреждаться за счет снижения способности к экспрессии рассмотренных выше факторов вирулентности (экзотоксины, экзоэнзимы, подвижность клеток и др.), что ограничивает распространение инфекции из очага на здоровые ткани. Гуморальные факторы защиты (система комплемента, специфические антитела) также вносят свой вклад в ограничение распространения процесса. Фагоцитируемые клетками, содержащими антибиотик, бактерии в большей мере подвергаются повреждению за счет предварительного воздействия макролидов и комплементсвязывающих антител. Фагосомы с бактериями при проникновении в содержащие макролид лизосомы образуют фаголизосомы, обеспечивающие разрушение бактерий. Фармакологическая особенность – способность преодолевать клеточные мембраны и накапливаться в клетках макроорганизма, в том числе и в иммунокомпетентных клетках. Способность к внутриклеточной кумуляции, создавая при этом высокие концентрации, определяет выраженную бактерицидную активность в отношении внутриклеточных возбудителей: хламидий, микоплазм, уреаплазм, легионелл, листерий, а так же стрептококков, стафилококков, аэробных грамотрицательных микроорганизмов типа гемофильной палочки, моракселлы, бордателлы.
Азитромицин является первым представителем подкласса азалидов, несколько отличающихся по структуре от классических макролидов, полученным путем включения атома азота в 14-членное лактонное кольцо между 9 и 10-м атомами углерода. Данная структурная организация азитромицина обуславливает значительное повышение его кислотоустойчивости (в 300 раз по сравнению с классическим представителем макролидов – эритромицином).
Представителем подкласса является препарат Азицид, действующее вещество азитромицин, выпускаемый компанией Zentiva (Чехия).
Механизм действия азитромицина обусловлен связыванием с 50S-субъединицей рибосомы микробной клетки и нарушением синтеза белка.
Подобно другим макролидам, азитромицин обладает в основном бактериостатическим эффектом, но благодаря способности создавать высокий уровень внутриклеточной концентрации на многие патогены, находящиеся внутри клеток, может действовать бактерицидно (4).
Важной фармакокинетической особенностью азитромицина является создание высоких и стабильных концентраций в тканях и органах репродуктивной системы даже при его однократном приеме. Так через 24 ч. после однократного приема азитромицина в дозе 1 г его уровень в ткани предстательной железы составляет 94 мг/л, через 48 ч. – 54 мг/л и даже через 3 нед. превышает минимальную подавляющую концентрацию (МПК) для C. trachomatis (6).
Высокие концентрации азитромицина, превышающие МПК для N. gonorrhoeae, C. trachomatis и U. urealyticum, создаются также в секрете простаты (6). Уровень содержания азитромицина в цервикальном канале в первый день после приема 1 г однократно в 9,5 раза, через 7 дней – в 5,5 раза превышает его концентрацию в сыворотке крови. Отмечено накопление антибиотика и в других органах малого таза у женщин (7).
Рекомендуемые схемы лечения
Неосложненный УГХ – азитромицин 1 г внутрь однократно пациентке и половым партнерам.
Осложненный УГХ – схема пульс-терапии азитромицином (1,0 г в 1-7-14-й дни). Предложенный курс дробной терапии по 1,0 г с интервалом в 1 неделю способен «перекрыть» от 6 до 8 жизненных циклов С. trachomatis. Такого эффекта невозможно добиться при использовании ни одного из известных в настоящее время макролидов или тетрациклинов, применяющихся в терапии хламидиоза (4).
Уреамикоплазменная инфекция – азитромицин 500 мг 2 раза в сутки 7 дней.
К дополнительным достоинствам азитромицина следует отнести его хорошую переносимость и низкий уровень побочных эффектов (один из самых низких среди известных для макролидов), что определяет его выбор для лечения хламидийной инфекции у беременных, так как многие другие антибиотики могут оказывать эмбрио- или тератогенный эффект и фетотоксическое действие. В руководстве CDC (2006 г.) азитромицин впервые включен в перечень рекомендуемых препаратов для лечения хламидийной инфекции у беременных.
Рекомендуемые схемы при УГХ у беременных – азитромицин 1 г внутрь однократно или амоксициллин 500 мг внутрь 3 раза в день в течение 7 сут.
Альтернативные схемы – эритромицин основание 500 мг внутрь 4 раза в день в течение 7 сут., или эритромицин этилсукцинат 400 мг внутрь 4 раза в день в течение 14 сут., или эритромицин этилсукцинат 800 мг 4 раза в день в течение 7 сут.
Оценка эффективности лечения
Первый контроль – сразу после завершения лечения (исключая иммунологические методы диагностики возбудителей). У женщин контрольные исследования проводятся во время трех ближайших менструальных циклов. Также 3 месяца на клинико-лабораторном контроле находятся их половые партнеры.
Иммунологические методы диагностики проводят через 4 недели после окончания лечения, далее по показаниям.
Рекомендовать воздержание от половых контактов до завершения лечения и получения отрицательных результатов.
Через несколько месяцев после окончания терапии, во избежание случаев реинфекции, целесообразно повторное исследование лиц группы риска (подростки, молодые женщины).
При наличии полового контакта с больным хламидийной инфекцией в течение предшествующих 60 суток проводить обследование и лечение.
Прогноз
При своевременном выявлении и адекватном лечении – благоприятный.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.