Ведение беременных с диабетической ретинопатией, осложненной диабетическим макулярным отеком
- Аннотация
- Статья
- Ссылки
- English




Введение
Сахарный диабет (СД) относится к группе метаболических заболеваний, сопровождающихся гипергликемией, в результате чего нарушается действие и/или секреция инсулина [1]. Лабильное течение СД при беременности характеризуется повышенной склонностью к кетоацидозу и гипогликемии, что негативно отражается на беременности, родах и развитии плода [2]. Перестройка гормонального фона во время беременности влечет за собой изменения сосудистой и микрососудистой регуляции [3], а волнообразный характер гликемии способствует прогрессированию микрососудистых осложнений, таких как ретинопатия, нефропатия и полинейропатия. Как следствие, в 75,5% случаев возникает диабетическая фетопатия у беременных с СД 1-го типа [4].
У беременных с СД в результате рециклинга глюкозы плодом, заключающемся в более быстрой (в два-три раза) ее утилизации, чем во взрослом организме [5], развивается феномен «ускоренного голодания» из-за неуклонного роста уровня базального и постпрандиального инсулина. Такая патологическая вариабельность гипер- и гипогликеми инициирует развитие окислительного стресса и сосудистых осложнений СД. Именно поэтому беременность рассматривают как фактор риска манифестации и/или прогрессирования диабетической ретинопатии (ДР) [6].
Одни авторы отмечают, что у 30–33% беременных с СД 1-го типа усиливается тяжесть ДР и нефропатии [7, 8] или офтальмоскопируются первичные проявления ДР, которые диагностируются у 9,7% беременных [6]. Другие авторы, напротив, указывают на отсутствие прогрессирования ДР [9] и ее регресс в послеродовом периоде [9, 10]. Однако имеются данные [11], что прогрессирование ДР во время беременности иногда протекает агрессивно и в отсутствие своевременного лечения приводит к критическим морфофункциональным изменениям.
Различные стадии ДР статистически чаще диагностируются во время беременности, чем в популяции небеременных с СД, – в 57,8 и 52,3% случаев соответственно [12]. Тем не менее частота пролиферативной диабетической ретинопатии (ПДР) в первом триместре беременности составляет 6,1%, практически соответствуя показателю у небеременных – 6,81%, и прогрессивно увеличивается к третьему триместру, достигая после родов 8,2% [12]. Совокупный показатель прогрессирования значительно выше у беременных с ДР, чем у беременных без ДР, на ранних сроках гестации [9]. В относительно небольшом проценте случаев риск развития ДР во время беременности выше у женщин с СД 1-го типа, чем у женщин с другими типами СД. Тем не менее если у женщины уже есть ДР, то вероятность прогрессирования ДР во время беременности одинакова [9]. В исследовании отмечалось увеличение риска ухудшения состояния глазного дна во время беременности в 1,63 раза по сравнению со статусом до беременности и в 2,48 раза по сравнению с небеременными [10].
У 5–25% беременных с СД 1-го типа и 4% беременных с СД 2-го типа развивается диабетический макулярный отек (ДМО). Макулярный отек, определяемый как утолщение сетчатки, возникает при накоплении жидкости в межклеточном пространстве нейроэпителия вследствие нарушения гематоретинальных барьеров и несоответствия между транссудацией жидкости и ее способностью к реабсорбции клетками пигментного эпителия. Макулярный отек, способный развиться на любой стадии ДР, ассоциируется с высоким риском потери зрительных функций. К сожалению, данные о частоте развития ДМО во время беременности скудны и противоречивы – 5–25 и 4–12% пациенток с СД 1-го и 2-го типов соответственно [13]. У 33–80% больных имеет место билатеральный характер поражения [14, 15]. Нарушение зрения, вызванное ДМО и ДР, приводит к выраженному снижению качества жизни, в том числе затруднению ведения домашнего хозяйства, досрочному прекращению профессиональной деятельности [16].
Стандартом лечения беременных с клинически значимым ДМО остается лазерная коагуляция макулы [17]. В последнее время стандартная пороговая лазерная коагуляция сетчатки (ЛКС) в заднем полюсе применяется гораздо реже, поскольку после данной процедуры на макуле остаются рубцы, которые постепенно увеличиваются в размере и могут привести к вторичному снижению зрения [18].
Большинство исследований СД у беременных сосредоточены исключительно на компенсации СД 1-го типа и демонстрируют, что ДМО может либо прогрессировать до значительного уровня, требующего вмешательства, либо спонтанно регрессировать после родов [19].
На современном этапе ведения пациентов с ДМО препаратами первой линии считаются анти-VEGF-препараты. Но во время беременности их применение ограничено в силу тератогенного эффекта и развития пороков развития. Речь идет о гастрошизисе, диафрагмальной и пупочной грыжах, пороках развития центральной нервной системы, неполном окостенении, сверхнормативных ребрах и эктродактилии [20]. Врачам следует принять меры предосторожности, если беременной рекомендовано подобное лечение. Прежде всего необходимо провести тщательную оценку риска и пользы. Имеются сообщения о потере беременности при приеме этих препаратов на ранних сроках гестации [21].
Согласно Резолюции экспертов по профилю «Офтальмология. Витреоретинальная хирургия», принятой на рабочем совещании «Биомаркеры воспаления. Новые возможности дифференцированного подхода к терапии диабетического макулярного отека», в случае ДМО безопасной альтернативой является интравитреальное применение глюкокортикостероидов со второго триместра беременности [22]. Однако необходимо учитывать местные побочные эффекты таких препаратов, поскольку на фоне их применения не исключено развитие катаракты и стероидной глаукомы [23].
В настоящее время у пациентов с СД в качестве предикторов прогрессирования ДР активно изучаются изменения сосудистой оболочки глаза. Дополнительное исследование изменений сосудистой оболочки у беременных с СД 1-го и 2-го типов способствует выявлению критериев манифестации и прогрессирования диабетической микроангиопатии. У пациенток при увеличении толщины сосудистого слоя цилиарного тела (ССЦТ) на 10% и более в одной и более точках наблюдаются признаки прогрессирования ДР при последующих плановых осмотрах по сравнению с результатами исследования, проведенного в первом триместре беременности. Количественный анализ ССЦТ определяет дополнительно переход в следующую стадию ДР, когда метод фоторегистрации глазного дна еще не выявляет явных признаков трансформации в другую стадию заболевания [24].
Представляем два клинических случая, демонстрирующих индивидуальный подход к ведению беременных с ДР, осложненной ДМО. Исследование проводилось на основании подписанного пациентами информированного добровольного согласия, одобрено независимым этическим комитетом при ГБУЗ МО МОНИКИ им. М.Ф. Владимирского (выписка из протокола заседания от 29.06.2023 № 11).
Клинический случай 1
Пациентка К., 34 года, с СД 1-го типа наблюдалась в отделении офтальмологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского с девятой недели беременности. Длительность СД 1-го типа – 22 года. В течение девяти лет – ПДР, диабетическая нейропатия, дистальный тип, сенсорная форма, в течение пяти лет – артериальная гипертензия 2-й степени. В анамнезе в 2013 г. выполнены панретинальная лазерная коагуляция сетчатки (ПРЛКС) обоих глаз, интравитреальное введение (ИВВ) Луцентиса в оба глаза по две инъекции. До беременности постоянно получала гипотензивную терапию – индапамид 2,5 мг и бисопролол 5 мг в сутки. Акушерский анамнез отягощен: год назад у пациентки произошел самопроизвольный выкидыш на сроке семь недель на фоне декомпенсированного СД. Текущая беременность незапланированная, наступила на фоне гипергликемии. Целевой уровень гликированного гемоглобина (HbA1c) — менее 7,0%. До девятой недели беременности применялись аналоги инсулина: Деглудек длительного действия один раз в сутки и Аспарт ультракороткого действия перед основными приемами пищи. На шестой неделе беременности отмечалось появление «черного пятна» перед правым глазом, к офтальмологу до девятой недели не обращалась. Для контроля артериальной гипертензии после наступления беременности была переведена на альфа-метилдопу 250 мг/сут с неудовлетворительным контролем артериального давления. У пациентки имело место ожирение 2-й степени (индекс массы тела – 36,7 кг/м2). СД был декомпенсированным: HbA1c на сроке девять недель – 9,1%. На девятой неделе беременности пациентку перевели на Детемир 37 Ед/сут, доза инсулина Аспарт увеличена (перед завтраком из расчета на 1 ХЕ 3 Ед инсулина, перед обедом и ужином на 1 ХЕ 2,5 Ед инсулина). При обследовании выявлены диабетическая нефропатия, хроническая болезнь почек (скорость клубочковой фильтрации в пробе Реберга – 94,05 мл/мин, суточная протеинурия – 0,92 г).
Офтальмологический осмотр на девятой неделе беременности:
- OD (правый глаз) = 0,1 sph (-1,25 D) = 0,3;
- OS (левый глаз) = 0,1 sph (-3,0 D) = 0,2;
- Р0 OD – 20 мм рт. ст.;
- Р0 OS – 22 мм рт. ст.
Биомикроскопия обоих глаз выявила начальные помутнения в кортикальных слоях хрусталика. Офтальмоскопически на обоих глазах обнаружена ретинальная сосудистая пролиферация на средней периферии по ходу нижнетемпоральной аркады, занимающая 2 dДЗН с локальным фиксированным гемофтальмом в нижнем отделе. Проведена оптическая когерентная томография (ОКТ) SPECTRALIS HRA + OCT (HEIDELBERG ENGINERING GmbH, Германия).
Данные ОКТ: на правом глазу определялся диффузно-кистозный макулярный отек, центральная толщина сетчатки (ЦТС) – 470 мкм, объем – 10,43 мм3, скопление гиперрефлективных очажков (ГРО) во внутренних слоях сетчатки. На левом глазу определялось формирование парафовеалярного локального «губкообразного» отека, ЦТС – 310 мкм, объем – 8,39 мм3, скопление ГРО во внутренних слоях сетчатки.
До инстилляции мидриатиков проводили ОКТ (Swept Source ОКТ с мультимодальной визуализацией глазного дна DRI OCT Triton) с использованием специальной насадки (Anterior Segment Attachment Kit AA-1) для исследования переднего отрезка глаза, режим сканирования line. Оценивали толщину ССЦТ [24]. ОКТ осуществляли с направлением сканирующего луча перпендикулярно в 3 мм от лимба. Исследование выполнялось на 3 и 9 часах: 3 часа на правом глазу соответствуют внутреннему отделу ССЦТ, 9 часов – наружному отделу, на левом глазу – наружному и внутреннему отделам ССЦТ соответственно. OD: толщина ССЦТ во внутреннем отделе – 36 мкм, в наружном – 35 мкм, OS: 34 и 35 мкм соответственно.
Проведена дополнительная ПРЛКС обоих глаз в условиях офтальмологического отделения ГБУЗ МО МОНИКИ им. М.Ф. Владимирского на 13-й неделе беременности.
Во время повторного осмотра через месяц после ПРЛКС на 17-й неделе беременности выявлено снижение остроты зрения обоих глаз:
- OD = 0,09 sph (-1,5 D) = 0,1;
- OS = 0,08 sph (-2,5 D) = 0,1;
- Р0 OD – 18 мм рт. ст.;
- Р0 OS – 20 мм рт. ст.
Офтальмоскопически определялись рассасывание гемофтальма и частичный регресс ретинальной неоваскуляризации. Несмотря на уменьшение сосудистой пролиферации до 1/2 dДЗН, ДМО увеличился на обоих глазах.
По данным ОКТ, на обоих глазах персистировал кистозный субфовеальный отек: OD – ЦТС – 774 мкм, объем – 12,99 мм3, OS – ЦТС – 554 мкм, объем – 10,84 мм3, увеличились размер и количество кист, а также количество ГРО как во внутренних, так и в наружных слоях сетчатки.
OD: толщина ССЦТ во внутреннем отделе – 33 мкм, в наружном – 32 мкм, OS: 32 и 32 мкм соответственно.
Во втором триместре беременности проведена инъекция имплантата дексаметазона 0,7 мг в витреальную полость правого глаза после предварительного согласования с лечащим врачом-гинекологом и эндокринологом.
При осмотре на 24-й неделе беременности выявлено повышение остроты зрения обоих глаз:
- OD = 0,2 sph (-2,0 D) = 0,6;
- OS = 0,1 sph (-2,25 D) = 0,3;
- Р0 OD – 18 мм рт. ст.;
- Р0 OS – 20 мм рт. ст.
По данным ОКТ отмечалась положительная динамика количественных характеристик правого глаза (ЦТС – 343 мкм, объем – 9,42 мм3) и левого глаза (ЦТС – 351 мкм, объем – 9,78 мм3), уменьшился размер кист на уровне нейросенсорной части сетчатки фовеолярной локализации, однако количество ГРО во внутренних слоях сетчатки не изменилось. OD: толщина ССЦТ во внутреннем отделе – 29 мкм, в наружном – 30 мкм, OS: 29 и 28 мкм соответственно.
На 30-й неделе беременности пациентка была госпитализирована в МОНИИАГ в связи с неконтролируемой артериальной гипертензией (230 /110 мм рт. ст.). Во время госпитализации показатели гликемии сохранялись в пределах целевого уровня, HbA1c – 6,0%. Белок в суточной моче не определялся. Маркеры преэклампсии sFlt-1/PlGF – 37,4 (высокий риск развития преэклампсии). Проводились инсулинотерапия (Детемир 51 Ед/сут, Аспарт перед едой в зависимости от количества углеводов), антиагрегантная терапия (ацетилсалициловая кислота 150 мг/сут), антианемическая терапия (сульфат железа 100 мг три раза в сутки), антигипертензивная терапия (альфа-метилдопа 1500 мг/сут, бисопролол 5 мг/сут, MgSO4 через инфузомат 1 г/ч по 1 г/сут № 5), терапия, направленная на улучшение функции фетоплацентарного комплекса (инфузия пирацетама № 3). Во время терапии ухудшились зрительные функции на правом глазу.
Офтальмологический осмотр на 34-й неделе беременности выявил снижение зрительных функций правого глаза:
- OD = 0,1 sph (-1,5 D) = 0,3;
- OS = 0,09 sph (-2,0 D) = 0,3;
- Р0 OD – 21 мм рт. ст.;
- Р0 OS – 19 мм рт. ст.
При офтальмоскопии обнаружена полная резорбция имплантата в витреальной полости правого глаза, на глазном дне визуализировалось усиление геморрагической активности, более 20 кровоизлияний по типу «точка – пятно» в каждом квадранте без признаков неоваскуляризации на обоих глазах. По данным ОКТ, на правом глазу персистировал кистозный субфовеальный отек: ЦТС – 640 мкм, объем – 11,32 мм3, левый глаз – ЦТС – 335 мкм, объем – 9,65 мм3, увеличился размер и количество кист, а также количество ГРО как во внутренних, так и в наружных слоях сетчатки правого глаза. Количественные характеристики левого глаза существенно не изменились, однако при морфологической оценке наблюдалось прогрессивное увеличение ГРО во внутренних слоях сетчатки. OD: толщина ССЦТ во внутреннем отделе – 39 мкм, в наружном – 38 мкм, OS: 37 и 36 мкм соответственно.
Учитывая отрицательную динамику зрительных функций, морфологические данные и количественную оценку полученных сканов ОКТ, а также четырехмесячный интервал после введения лекарственного вещества, совместно с акушером-гинекологом мы приняли решение об ИВВ имплантата дексаметазона 0,7 мг в левый глаз.
При осмотре на 35-й неделе беременности увеличилась максимальная корригированная острота зрения (МКОЗ) обоих глаз:
- OD = 0,1 sph (-1,5 D) = 0,4;
- OS = 0,09 sph (-2,0 D) = 0,5;
- Р0 OD – 21 мм рт. ст.;
- Р0 OS – 19 мм рт. ст.
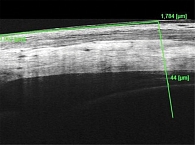
Данные ОКТ спустя неделю после ИВВ показали частичную резорбцию макулярного отека на обоих глазах. OD: толщина ССЦТ во внутреннем отделе – 44 мкм (рис. 1), в наружном – 42 мкм, OS: 39 и 40 мкм соответственно.
На 36-й неделе беременности пациентка была госпитализирована в МОНИИАГ. После обследования был сделан вывод, что в связи с декомпенсацией фетоплацентарной недостаточности, прогрессированием гемодинамических нарушений в системе фетоплацентарного комплекса, нарастающим риском острой гипоксии плода, развитием преэклампсии длительное пролонгирование беременности противопоказано. Во время госпитализации показатели гликемии сохранялись в пределах целевого уровня, HbA1c – 6,0%. На 36-й неделе беременности была выполнена операция кесарева сечения. В послеоперационном периоде пациентка получала утеротоническую, антибактериальную, антианемическую, антигипертензивную терапию, а также инсулинотерапию. Проводилась профилактика тромбоэмболических осложнений.
Анализ полученных данных офтальмологического осмотра через месяц после родоразрешения продемонстрировал увеличение МКОЗ обоих глаз:
- OD = 0,2 sph (-1,5 D) = 0,6;
- OS = 0,1 sph (-2,0 D) = 0,5;
- Р0 OD – 20 мм рт. ст.;
- Р0 OS – 20 мм рт. ст.
Данные ОКТ показали частичный регресс макулярного отека на правом глазу (ЦТС – 340 мкм, объем – 9,39 мм3) и полный на левом глазу (ЦТС – 259 мкм, объем – 8,59 мм3).
В данном случае мы наблюдали положительную динамику в ответ на проведенное лечение. OD: толщина ССЦТ во внутреннем отделе – 27 мкм, в наружном – 26 мкм, OS: 27 и 26 мкм соответственно. Динамика ЦТС по неделям беременности представлена на рис. 2, остроты зрения – на рис. 3.
Клинический случай 2
Пациентка С., 24 года, с СД 1-го типа наблюдалась в отделении офтальмологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского на 11-й неделе беременности. Длительность СД 1-го типа – 18 лет. В течение двух лет – диабетическая полинейропатия, сенсорная форма, дистальный тип. Сопутствующие заболевания: язвенная болезнь двенадцатиперстной кишки, вне обострения, псориаз. Данная беременность первая, незапланированная. С 2016 г. в связи с декомпенсацией углеводного обмена эндокринологом скорректирована интенсифицированная инсулинотерапия, установлен углеводный коэффициент перед завтраком, обедом 1 ХЕ: 1,7 Ед, перед ужином 1 ХЕ: 1,8 Ед, инсулин Левемир 22 Ед на ночь. HbA1c на этом фоне – до 10 ммоль/л. В последующие годы дозы инсулина титровались. По словам пациентки, HbA1c до беременности – 10%, после наступления беременности не проверяла. По назначению гинеколога принимала дидрогестерон 20 мг в обед и на ночь, колекальциферол 2000 МЕ/сут, витаминный комплекс для беременных. На 11-й неделе СД был декомпенсированным: HbA1c – 8,2%. Целевой уровень HbA1c – менее 7,0%. На 11-й неделе беременности пациентка была переведена на инсулин Лизпро из расчета перед завтраком 1 ХЕ: 1,5 Ед, перед обедом и ужином 1 ХЕ: 1 Ед за 20 минут до еды, инсулин Детемир 6 Ед в 09.00 и 4 Ед в 21.00.
Офтальмологический осмотр на 11-й неделе беременности:
- OD = 0,7 sph (-1,5 D) = 1,0;
- OS = 0,7 sph (-1,5 D) = 1,0;
- Р0 OD – 24 мм рт. ст.;
- Р0 OS – 23 мм рт. ст.
Биомикроскопия показала начальные помутнения в кортикальных слоях хрусталика.
Офтальмоскопически на правом глазу определялись твердые экссудаты в парафовеолярной области, множественные микроаневризмы, мягкие экссудаты на средней периферии в верхнетемпоральном отделе. На средней периферии в каждом квадранте – единичные перистые геморрагии, не больше трех в каждом квадранте.
На левом глазу множественные макроаневризмы в парафовеолярной области, на средней периферии – макро- и микроаневризмы.
В нейроэпителии парафовеолярно визуализировались кистозные полости и ГРО (ЦТС – 384 мкм, объем – 10,03 мм3), на левом глазу архитектоника слоев сетчатки не изменена (ЦТС – 360 мкм, объем – 9,61 мм3).
OD: толщина ССЦТ во внутреннем отделе 26 мкм, в наружном – 25 мкм, OS: 25 и 24 мкм соответственно.
На 17-й неделе беременности проходила обследование в МОНИИАГ: HbA1c – 5,8%, маркеры преэклампсии sFlt-1/PlGF – 16,24.
При повторном осмотре на 22-й неделе беременности выявлено снижение остроты зрения обоих глаз:
- OD = 0,5 sph (-1,75 D) = 0,6;
- OS = 0,6 sph (-1,75 D) = 0,9;
- Р0 OD – 25 мм рт. ст.;
- Р0 OS – 24 мм рт. ст.
Офтальмоскопически определялись твердые экссудаты в парафовеолярной области, множественные микроаневризмы, мягкие экссудаты на средней периферии в верхнетемпоральном отделе. На средней периферии – единичные микроаневризмы, свежие интраретинальные геморрагии по типу «точка – пятно» не больше пяти в каждом квадранте на правом глазу и множественные макроаневризмы в парафовеолярной области, на средней периферии – макро- и микроаневризмы, свежие интраретинальные геморрагии по типу «точка – пятно» не больше трех в каждом квадранте на левом глазу. По данным ОКТ на правом глазу отмечались увеличение кистозных полостей в области ГРО (ЦТС – 449 мкм, объем – 10,13 мм3) и появление единичных кистозных полостей на левом глазу (ЦТС – 366 мкм, объем – 9,74 мм3). OD: толщина ССЦТ во внутреннем отделе – 30 мкм, в наружном – 30 мкм, OS: 30 и 29 мкм соответственно.
На 25-й неделе беременности при обследовании в условиях МОНИИАГ HbA1c – 5,6%, маркеры преэклампсии sFlt-1/PlGF – 10,34 (риск развития преэклампсии низкий).
Осмотр на 31-й неделе беременности выявил дополнительное снижение остроты зрения обоих глаз:
- OD = 0,2 sph (-1,75 D) = 0,5;
- OS = 0,4 sph (-1,75 D) = 0,6;
- Р0 OD – 23 мм рт. ст.;
- Р0 OS – 23 мм рт. ст.
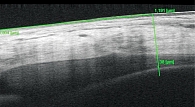
Офтальмоскопически на правом глазу определялись твердые экссудаты в парафовеолярной области, множественные микроаневризмы, мягкие экссудаты на средней периферии в верхнетемпоральном отделе. Выявлена ретинальная сосудистая пролиферация по ходу верхнетемпоральной аркады 1 dДЗН, свежие интраретинальные геморрагии по типу «точка – пятно» больше 20 в каждом квадранте, четкообразность вен. На левом глазу множественные макроаневризмы в парафовеолярной области, на средней периферии – макро- и микроаневризмы, множественные свежие интраретинальные геморрагии по типу «точка – пятно» больше 30 в каждом квадранте, интраретинальные микрососудистые аномалии во всех квадрантах, четкообразность вен и сосудистая пролиферация по ходу нижнетемпоральной аркады 1/2 dДЗН. По данным ОКТ определялось увеличение количества и размера кистозных полостей на правом глазу (ЦТС – 499 мкм, объем – 10,37 мм3) и увеличение количества кистозных полостей на левом глазу (ЦТС – 377 мкм, объем – 9,89 мм3). OD: толщина ССЦТ во внутреннем отделе – 37 мкм, в наружном – 38 мкм, OS: 38 (рис. 4) и 38 мкм соответственно.
Проведена ПРЛКС на обоих глазах на 32-й неделе беременности в условиях офтальмологического отделения ГБУЗ МО МОНИКИ им. М.Ф. Владимирского.
Осмотр на 35-й неделе беременности:
- OD = 0,2 sph (-1,75 D) = 0,5;
- OS = 0,4 sph (-1,75 D) = 0,6;
- Р0 OD – 20 мм рт. ст.;
- Р0 OS – 20 мм рт. ст.
Офтальмоскопически выявлен частичный регресс неоваскуляризации. По данным ОКТ, на обоих глазах персистировал кистозный субфовеальный отек: OD – ЦТС – 516 мкм, объем – 10,44 мм3, OS – 467 мкм и 10,24 мм3 соответственно. OD: толщина ССЦТ во внутреннем отделе – 32 мкм, в наружном – 31 мкм, OS: 30 и 29 мкм соответственно.
При осмотре на 37-й неделе беременности выявлено дополнительное снижение остроты зрения:
- OD = 0,09 sph (-2,0 D) = 0,2;
- OS = 0,1 sph (-2,0 D) = 0,4;
- Р0 OD – 20 мм рт. ст.;
- Р0 OS – 20 мм рт. ст.
Офтальмоскопически определялся полный регресс неоваскуляризации, однако, по данным ОКТ, персистировал кистозный субфовеальный отек на правом (ЦТС – 561 мкм, объем – 10,59 мм3) и левом (552 мкм и 10,56 мм3 соответственно) глазу. OD: толщина ССЦТ во внутреннем отделе – 29 мкм, в наружном – 29 мкм, OS: 29 и 28 мкм соответственно.
Мы приняли решение вести выжидательную тактику, хотя и наблюдали увеличение отека сетчатки. Было решено провести ИВВ имплантата дексаметазона 0,7 мг после родов при условии сохранения макулярного отека. Рекомендовано родоразрешение с помощью операции кесарева сечения. На 38-й неделе беременности произошло абдоминальное родоразрешение в условиях МОНИИАГ в плановом порядке. В послеоперационном периоде пациентка получала утеротоническую, антибактериальную, антианемическую терапию, а также инсулинотерапию. Проводилась профилактика тромбоэмболических осложнений.
Анализ полученных данных офтальмологического осмотра через месяц после родоразрешения продемонстрировал увеличение МКОЗ обоих глаз:
- OD = 0,6 sph (-1,25 D) = 0,9;
- OS = 0,7 sph (-1,25 D) = 0,9;
- Р0 OD – 22 мм рт. ст.;
- Р0 OS – 21 мм рт. ст.
Офтальмоскопически визуализировались пигментированные лазеркоагуляты в панретинальном объеме. Геморрагических явлений и признаков пролиферации на обоих глазах не выявлено.
Данные ОКТ: полная резорбция интраретинального отека на обоих глазах. Правый глаз (ЦТС – 379 мкм, объем – 9,81 мм3), левый глаз (376 мкм и 9,87 мм3 соответственно). OD: толщина ССЦТ во внутреннем отделе – 23 мкм, в наружном – 22 мкм, OS: 22 и 23 мкм соответственно.
Показаний к интравитреальной инъекции имплантата дексаметазона 0,7 мг на момент осмотра не было. Динамика ЦТС по неделям беременности представлена на рис. 5, остроты зрения – на рис. 6.
Обсуждение
Представленные случаи демонстрируют, что патогенез прогрессирования ДР и ДМО могут отличаться. Каждый случай требует индивидуального подхода. У пациентки К. имелось несколько факторов риска прогрессирования ДР: декомпенсированный СД 1-го типа на момент наступления беременности, ПДР в анамнезе, неконтролируемая артериальная гипертензия, развившаяся преэклампсия, повторная беременность. Необходимо отметить, что проведенная ПРЛКС с достижением многолетней регрессии ретинопатии в прегестационном периоде не может сохранить зрительные функции и предотвратить развитие ретинальной пролиферации на протяжении беременности. Быстрая компенсация гликемии и сопутствующая артериальная гипертензия привели к лавинообразному прогрессированию неоваскуляризации и расширению зон неперфузии с формированием макулярного отека. Выполненная в ускоренном режиме дополнительная ЛКС в панретинальном объеме не привела к регрессу ретинопатии, макулярного отека и уменьшению толщины ССЦТ, хотя и способствовала изменению количественных данных пролиферативного процесса сетчатки и ССЦТ. Показатель ССЦТ после ПРЛКС уменьшился на 14% по сравнению с исходным, возникший неконтролируемый подъем артериального давления на фоне гипотензивной терапии привел к мысли о формировании преэклампсии. Своевременное направление в МОНИИАГ предотвратило развитие преэклампсии, что было подтверждено увеличением объективных маркеров преэклампсии (sFlt-1/PlGF – 37,4). ДМО потребовал дополнительного ИВВ имплантата дексаметазона 0,7 мг. Динамически мониторированное увеличение толщины ССЦТ, несмотря на регресс неоваскуляризации после проведенной ПРЛКС, нами расценено как ответ на эпизод неконтролируемой артериальной гипертензии и развитие преэклампсии.
Во втором случае, у пациентки С., главным фактором риска прогрессирования ДР стал декомпенсированный СД на момент наступления беременности. Компенсация гликемии в периоде гестации привела к развитию неоваскуляризации в третьем триместре беременности. Своевременно проведенная ПРЛКС помогла достичь регресса ретинальной сосудистой пролиферации, а в послеродовом периоде произошел регресс ДМО. У пациентки наблюдалось постепенное увеличение толщины ССЦТ на фоне прогрессирования ДР с его последующим уменьшением более чем на 26% по сравнению с исходным на фоне полного регресса неоваскуляризации после проведенной ПРЛКС, что соответствует выводам, сделанным во время исследования динамических изменений толщины ССТЦ в периоде гестации [24].
Выводы
У данных пациенток отмечалась вариабельность клинического течения ДР в различные триместры беременности. У обеих пациенток одним из ведущих факторов риска было улучшение компенсации СД – снижение HbA1c на 3,1% у пациентки К. и на 2,4% у пациентки С. в первом триместре беременности. Этому способствовали не только физиологические процессы на фоне беременности, но и повышение комплаентности. У пациентки К. более агрессивное прогрессирование ДМО, вероятно, было обусловлено высоким уровнем HbA1c, неконтролируемой артериальной гипертензией и развитием преэклампсии. Влияние этих факторов рисков можно было уменьшить или предотвратить в случае планирования беременности. В данной ситуации в планировании беременности должны принимать участие акушер-гинеколог, эндокринолог, офтальмолог, терапевт/кардиолог, поскольку эффективность лечения ДР зависит от компенсации сопутствующей патологии. Беременные с ДР должны наблюдаться в специализированных офтальмологических клиниках с высокотехнологичным оборудованием (фундус-фотографирование, ОКТ переднего и заднего отрезков, ОКТ-ангиография) с минимальной частотой один раз в триместр. Но при наличии ПДР и ДМО частота наблюдения зависит от конкретной клинической ситуации.
Отсутствие прегравидарной подготовки и декомпенсация СД у женщины до беременности/в первом триместре повышает риск развития ДР. К концу второго триместра наблюдаются наиболее выраженные патологические состояния, характеризующиеся различными типами течения. Сочетание СД и артериальной гипертензии увеличивает вероятность агрессивного развития ДР и ДМО, что обусловливает мониторирование данных пациенток с применением мультимодальной диагностики и своевременной комбинированной терапии.
Финансирование: авторы не получали конкретный грант на данное исследование от какого-либо финансирующего агентства в государственном, коммерческом и некоммерческом секторах.
Ye.N. Khomyakova, PhD, A.A. Afanasyeva
M.F. Vladimirsky Moscow Regional Scientific Research Institute
Contact person: Anna A. Afanasyeva, anna_amor@mail.ru
The labile course of diabetes mellitus in pregnancy is characterized by an increased propensity to ketoacidosis and hypoglycemia, which adversely affects the course of pregnancy, delivery and fetal development. Pregnant women with diabetes mellitus develop the phenomenon of ‘accelerated starvation’ due to a steady increase in basal and postprandial insulin levels, such pathological variability of hyper- and hypoglycemia initiates the occurrence of oxidative stress and the development of vascular complications of diabetes mellitus, so pregnancy is considered as a risk factor for the manifestation and/or progression of diabetic retinopathy in pregnant women with diabetes mellitus. The cumulative rate of progression, is significantly higher in pregnant women with existing diabetic retinopathy than in women without diabetic retinopathy in early gestation. Between 5–25% of pregnant women with type 1 diabetes mellitus and 4–12% of pregnant women with type 2 diabetes mellitus develop diabetic macular edema. Most investigators have concluded that diabetic macular edema can either progress to a significant level requiring intervention or spontaneously regress after delivery. Standards of treatment for this pathology vary, physicians should take precautions if treatment is recommended for a pregnant woman. First of all, a careful assessment of risk and benefit for both mother and fetus should be made. Two clinical cases will be presented below to demonstrate an individualized approach to the management of pregnant women with diabetic retinopathy complicated by diabetic macular edema.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.