Современные подходы к реперфузионной терапии при ишемическом инсульте
- Аннотация
- Статья
- Ссылки
Церебральный инсульт является чрезвычайно значимой медицинской и социальной проблемой вследствие высоких показателей заболеваемости, смертности и инвалидизации населения. Новые технологии лечения ишемического инсульта предусматривают применение современных высокоэффективных методов реперфузии вещества головного мозга в первые часы заболевания, направленных на восстановление кровотока в пораженном сосуде, что позволяет предотвратить развитие необратимого повреждения мозга, то есть минимизировать степень выраженности остаточного неврологического дефицита.
Системная тромболитическая терапия (ТЛТ) с использованием рекомбинантного тканевого активатора плазминогена (rt-PA) является эффективным и безопасным методом лечения ишемического инсульта в первые 4,5 часа от начала развития симптоматики в соответствии с рекомендациями Европейской инсультной организации (ESO) (класс доказательности I, уровень А) и Американской инсультной ассоциации (ASA) (класс доказательности I, уровень В) [1, 2].
Эффективность и безопасность системного тромболизиса при ишемическом инсульте при помощи rt-PA изучались в ряде крупных рандомизированных плацебоконтролируемых клинических испытаний. Впервые безопасность и эффективность системной тромболитической терапии с применением rt-PA в первые три часа от начала развития заболевания были доказаны в исследовании National Institute of Neurological Disorders and Stroke (NINDS). Вероятность отсутствия нарушений дееспособности или сохранения минимальных неврологических расстройств спустя 3 месяца после инсульта была как минимум на 30% больше у пациентов, получавших rt-PA, чем у больных, получавших плацебо.
Несмотря на увеличение частоты симптомной геморрагической трансформации у пациентов, получавших rt-PA, по сравнению с больными, получавшими плацебо (6,4% против 0,6%; p = 0,001), достоверных различий уровней летальности выявлено не было (при использовании rt-PA – 17% и плацебо – 21%; р = 0,3) [3]. Результаты данного исследования позволили Управлению по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) США одобрить системную ТЛТ с помощью rt-PA в качестве метода лечения ишемического инсульта.
В рандомизированных плацебоконтролируемых исследованиях European Cooperative Acute Stroke Study (ECASS) I и II оценивались безопасность и эффективность применения rt-PA в разных дозах (ECASS I – 1,1 мг/кг; ECASS II – 0,9 мг/кг) в сроки до 6 часов от начала развития ишемического инсульта [4, 5]. Результаты ECASS I и ECASS II в отношении безопасности применения rt-PA были сопоставимы с таковыми, полученными в исследовании NINDS, однако при изучении эффективности не было выявлено достоверных различий между основной группой и группой плацебо. На основании данных исследования ECASS I [4] высказано предположение о том, что применение rt-PA в дозах, превышающих 0,9 мг/кг массы тела, может приводить к увеличению частоты развития внутричерепных кровоизлияний и быть причиной более высокой летальности.
Две части (А и В) исследования Alteplase ThromboLysis for Acute Noninterventional Therapy in Ischemic Stroke (ATLANTIS) проводились с целью оценки безопасности и эффективности применения rt-PA в дозе 0,9 мг/кг в сроки до 5 часов от начала развития заболевания. При этом не было выявлено существенного положительного эффекта rt-PA по сравнению с плацебо [6]. В подгруппах пациентов, которые получали rt-PA или плацебо в течение 3 часов от начала развития инсульта, применение rt-PA сопровождалось большей вероятностью благоприятного исхода через 90 дней (р = 0,01).
Метаанализ исследований NINDS, ECASS I и II, ATLANTIS A и В [7] показал, что применение rt-PA у пациентов с ишемическим инсультом в интервале до 3 часов от начала заболевания приводит к снижению вероятности летального исхода или нарушения дееспособности больного к концу 90-х суток. Шанс остаться независимым в повседневной жизни после применения rt-PA в означенные сроки (≤ 3 ч от начала заболевания) увеличивается на 50% (по сравнению с плацебо). Было также показано, что применение rt-PA у больных с ишемическим инсультом в рамках 3-часового «терапевтического окна» не сопровождается повышением частоты смертельных исходов, несмотря на увеличение числа случаев развития внутричерепных кровоизлияний (по сравнению с плацебо). Объединенный анализ продемонстрировал, что вероятность благоприятного исхода в случае применения rt-PA тем выше, чем раньше была начата ТЛТ. За пределами 3-часового «терапевтического окна» (до 4,5 часов от начала заболевания) сохранялась вероятность благоприятного исхода (отношение шансов (ОШ) 1,34; 95% доверительный интервал (ДИ) 1,04–1,72); позднее (от 4,5 до 6 часов) тромболизис был неэффективен (ОШ 1,04; 95% ДИ 0,84–1,29). Данное теоретическое обоснование эффективности системной ТЛТ в первые 4,5 часа явилось предпосылкой проведения следующего исследования острого инсульта – ECASS III, завершенного в 2008 г. [7].
Как показали результаты данного исследования, применение rt-PA в сроки до 4,5 часов от начала заболевания увеличивает количество пациентов с благоприятными функциональными исходами по сравнению с плацебо (52,4% против 45,2%; ОШ 1,34; 95% ДИ 1,0–1,65; р < 0,05) [8]. Частота развития внутричерепных кровоизлияний была значительно выше у лиц, получивших rt-PA, по сравнению с таковыми, получившими плацебо (27,0% против 17,6%; р = 0,001); частота развития симптомных внутричерепных кровоизлияний также была выше у получивших rt-PA в сравнении с плацебо (2,4% против 0,2%; р = 0,008). По частоте развития летальных исходов существенных различий между группами rt-PA и плацебо выявлено не было (7,7% против 8,4%; р = 0,68). В соответствии с результатами исследования ECASS III был осуществлен пересмотр европейских и американских рекомендаций по лечению ишемического инсульта с увеличением продолжительности «терапевтического окна» при проведении системного тромболизиса до 4,5 часов [1, 2]. Соответствующие изменения в инструкцию к препарату Актилизе в Российской Федерации были внесены 25 мая 2011 г.; согласно им выполнение системной ТЛТ стало возможным в первые 4,5 часа от начала развития заболевания. Исследования (Multicentre Acute Stroke Trial – Italy (MAST-I), Multicentre Acute Stroke Trial – Europe Study Group (MAST-E), Australian Streptokinase Trial Study Group (AST)), в которых для проведения тромболизиса при инсульте использовалась стрептокиназа, были остановлены досрочно из-за высокой частоты развития симптомных геморрагических трансформаций [9–11].
Изучение другого фибринолитика, полученного из слюны летучих мышей (десмотеплазы), более фибринспецифичного и менее нейротоксичного по сравнению с rt-PA, проводилось в исследованиях Dose Escalation of Desmoteplase for Acute Ischemic Stroke (DEDAS) [12], Desmoteplase in Acute Ischemic Stroke Trial (DIAS) I [13] и DIAS II [14]. Десмотеплаза вводилась в период от 3 до 9 часов от начала заболевания в случаях выявления области перфузионно-диффузионного несоответствия (DWI-PWI mismatch) с помощью магнитно-резонансной томографии (МРТ) головного мозга перед началом лечения. Первая часть исследования DIAS I, в которой пациенты получали 25; 37,5 или 50 мг препарата либо плацебо, была досрочно остановлена из-за высокой частоты симптомных внутричерепных кровоизлияний в группе десмотеплазы (26,7%). Во второй части исследования использовались меньшие дозы препарата (62,5; 90 или 125 мкг/кг), что привело к значительному снижению частоты симптомной геморрагической трансформации (2,2%).
Реканализация окклюзированной артерии в группе, получавшей десмотеплазу (125 мкг/кг), наблюдалась в 71,4% случаев, в то время как в группе плацебо – только в 19,2% случаев (p = 0,0012). Благоприятные исходы заболевания к 90-му дню в группе плацебо были выявлены у 22,2% пациентов, в основной группе – в 13,3% случаев при применении дозы 62,5 мкг/кг (p = 0,757), у 60,0% больных – при введении дозы 125 мкг/кг (p = 0,0090). Таким образом, было показано, что применение десмотеплазы во временном промежутке от 3 до 9 часов от начала развития ишемического инсульта у пациентов с верифицированным с помощью МРТ перфузионно-диффузионным несоответствием ассоциируется с большей частотой реканализации и хорошими клиническими исходами заболевания по сравнению с группой плацебо. В исследовании DEDAS [12], в которое было включено 37 пациентов, больные получали десмотеплазу в дозе 90 или 125 мкг/кг либо плацебо. Обязательным критерием включения в исследование также было наличие перфузионно-диффузионного несоответствия (по данным МРТ головного мозга). Реканализация наблюдалась у 37,5% пациентов, получивших плацебо, у 18,2% пациентов, получивших десмотеплазу в дозе 90 мкг/кг, и у 53,3% пациентов, получивших данный препарат в дозе 125 мкг/кг.
Однако при дальнейшем исследовании десмотеплазы в рамках рандомизированного плацебоконтролируемого испытания DIAS II [14] не были подтверждены безопасность и эффективность данного фибринолитика. В исследование было включено 186 пациентов с ишемическим инсультом в пределах 9 часов от начала развития симптоматики. Больные были рандомизированы в три группы и получали десмотеплазу в дозе 95 мкг/кг (n = 57) либо 125 мкг/кг (n = 66) или плацебо (n = 63). Благоприятные клинические исходы заболевания к 90-му дню в группах больных, получивших десмотеплазу в дозах 95 мкг/кг и 125 мкг/кг, наблюдались у 47% (n = 27) и 36% (n = 24) пациентов соответственно. В группе плацебо благоприятные клинические исходы к 90-му дню заболевания выявлялись у 46% (n = 29) пациентов. Частота симптомных внутричерепных кровоизлияний при использовании десмотеплазы в дозах 95 мкг/кг и 125 мкг/кг составила 3,5% и 4,5% соответственно. В группе плацебо данное осложнение не наблюдалось ни у одного пациента. Таким образом, в настоящее время rt-PA является единственным препаратом с доказанными безопасностью и эффективностью применения в лечении ишемического инсульта.
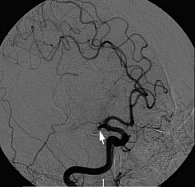
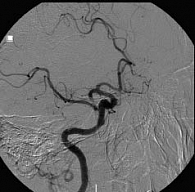
Наиболее радикальными подходами к лечению острого ишемического инсульта являются разрабатываемые в последнее время методы селективного внутриартериального тромболизиса и тромбоэмболэктомии. Данные методики базируются на возможностях и технологических приемах церебральной ангиографии, с помощью которой осуществляются не только диагностические исследования, но и различные рентгенохирургические вмешательства на сосудах мозга. Селективный тромболизис является методом выбора в тех случаях, когда фибринолитическая терапия может быть начата в период от 4,5 до 6 часов от начала заболевания при каротидном ишемическом инсульте и до 9–12 часов – при окклюзии основной артерии, а также в ситуациях, когда системный тромболизис оказывается неэффективным (не наблюдается клинического улучшения к концу его проведения). В качестве примера приведем следующий клинический случай. Больному К. (56 лет) с диагнозом «ишемический инсульт в бассейне правой средней мозговой артерии» была проведена диагностическая ангиография правой внутренней сонной артерии. На рисунке 1 видна окклюзия М1-сегмента правой СМА с «культей» и неоднородным контрастированием начала окклюзии без заполнения дистального русла. После проведения внутриартериального ТЛТ кровоток по правой СМА полностью восстановился (рис. 2).
Внутриартериальное введение rt-PA и других фибринолитиков изучалось в ряде исследований: Pro-Urokinase for Acute Cerebral Thromboembolism (PROACT) [15], Emergency Management of Stroke (EMS) [16], Interventional Management of Stroke (IMS) [17], IMS II [19]. Первым исследованием, доказавшим эффективность и безопасность внутриартериальной ТЛТ при ишемическом инсульте, было двойное слепое рандомизированное плацебоконтролируемое исследование PROACT [15], в ходе которого активатор плазминогена (рекомбинантная проурокиназа, r-pro-UK) вводился внутриартериально пациентам в первые 6 часов от начала развития заболевания. В исследование было включено 40 больных с ишемическим инсультом с ангиографически подтвержденной окклюзией проксимального сегмента средней мозговой артерии (СМА) – М1- или М2-сегмента. Симптомные внутричерепные кровоизлияния в основной группе зарегистрированы в 15,4% случаев и в 7,1% случаев в группе плацебо. Частичная или полная реканализация артерии в течение 120 минут от начала терапии была достигнута в группе лиц, получивших рекомбинантную проурокиназу, в 15 из 26 случаев (57,7%), в группе плацебо – только в 2 из 14 (14,3%).
По данным ангиографии, у 5 пациентов основной группы была достигнута полная реканализация, в то время как в группе плацебо ее не удалось добиться ни в одном случае. Исследование показало, что частота реканализаций в основной группе была выше, чем в группе плацебо; статистически значимых межгрупповых различий по частоте геморрагических трансформаций, явившихся причиной неврологического ухудшения, выявлено не было. На основании этого констатировано, что внутриартериальное введение рекомбинантной проурокиназы при ишемическом инсульте в течение 6 часов от начала развития симптоматики является эффективным и безопасным методом лечения.
Целью исследования EMS [16] явилось сравнение эффективности комбинированной ТЛТ с внутриартериальной. Была доказана безопасность комбинированной ТЛТ при лечении ишемического инсульта. В нерандомизированном исследовании IMS [17], в которое было включено 80 пациентов, оценивались безопасность и эффективность комбинированной ТЛТ. Летальность в течение 90 дней после ее проведения составила 16% и была значительно более низкой, чем в группе плацебо (24%), и сопоставимой с соответствующим показателем, полученным в основной группе исследования NINDS (17%). Симптомные внутричерепные кровоизлияния наблюдались в 6,3% случаев, что также оказалось сопоставимым с данными исследования NINDS, где подобное осложнение регистрировалось в 6,6% случаев. У лиц, включенных в исследование IMS, отмечалось большее количество благоприятных исходов по сравнению с группой плацебо в исследовании NINDS. Летальность и частота развития симптомных внутричерепных кровоизлияний в исследовании IMS (16,0% и 6,3%) были сравнимы с таковыми в NINDS (17,0% и 6,4% соответственно).
С целью дальнейшего изучения безопасности комбинированного тромболизиса при ишемическом инсульте было проведено открытое сравнительное нерандомизированное исследование IMS II [18], в которое был включен 81 больной. Трехмесячный уровень летальности в этом исследовании составил 16%. Частота симптомных внутричерепных кровоизлияний (9,9%) оказалась сопоставимой с таковой в ходе исследования NINDS (6,6%). Было показано, что в результате комбинированного применения тромболизиса в большем числе случаев наблюдается хорошая степень функционального восстановления (по сравнению с основной группой исследования NINDS). Целью продолжающегося в настоящее время исследования IMS III является сравнение эффективности комбинированной ТЛТ и системного тромболизиса.
Метаанализ 27 исследований, опубликованный в 2001 г., подтвердил, что в группе внутриартериальной ТЛТ чаще по сравнению с плацебо отмечались лучшие функциональные исходы (41,5 против 23% соответственно) [19]. И хотя частота симптомных внутримозговых кровотечений в группе тромболизиса оказалась более высокой (9,5% в основной группе, 3% в группе плацебо), показатели летальности в группах были противоположными (40% в группе плацебо, 27,2% в группе ТЛТ). Результаты последнего метаанализа [20] убедительно доказали, что проведение внутриартериального фибринолиза достоверно чаще обеспечивает хорошую степень функционального восстановления (0–2 балла по модифицированной шкале Рэнкина) и приводит к увеличению количества больных с очень хорошим восстановлением нарушенных неврологических функций (0–1 балл по модифицированной шкале Рэнкина). Несмотря на более высокую частоту развития внутричерепных геморрагий в основной группе, включая симптомные, достоверных различий между группами не наблюдалось.
В настоящее время более эффективной по сравнению с внутриартериальным тромболизисом является методика механической реканализации пораженного участка артерии специальным инструментом – тромбоэмболэктомия. Данное вмешательство выполняется в условиях рентген-операционной. Преимуществами механической реканализации являются минимизация риска системных геморрагических осложнений, а также возможность воздействия на тромб или эмбол после безуспешного внутривенного тромболизиса. К настоящему времени опубликованы результаты исследований с использованием таких механических устройств для реканализации, как MERCI, PENUMBRA, CATCH и др. [21–23]. На российском рынке в настоящее время представлено устройство CATCH.
Впервые в России методы системного и селективного внутриартериального тромболизиса были внедрены в клинике НИИ цереброваскулярной патологии и инсульта РГМУ им. Н.И. Пирогова на базе ГКБ № 31 в 2005–2006 гг. [24, 25]. Метод ТЛТ был одобрен Федеральной службой по надзору в сфере здравоохранения и социального развития как новая медицинская технология (разрешение на применение новой медицинской технологии ФС № 2008/169 от 01.08.2008). С 2008 г. тромболизис является неотъемлемой составляющей оказания медицинской помощи больным с инсультом в условиях первичных сосудистых отделений и региональных сосудистых центров, созданных в рамках реализации комплекса мероприятий по снижению смертности от сосудистых заболеваний [26].
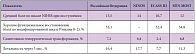
Результаты безопасности и эффективности внедрения метода ТЛТ в Российской Федерации сопоставимы с результатами наиболее крупных исследований и регистра Safe Implementation of Thrombolysis in Stroke-Monitoring Study (SITS-MOST) (табл. 1). Более высокие показатели симптомной геморрагической трансформации и летальности по сравнению с ECASS III и SITS-MOST, вероятно, связаны с исходно более тяжелым неврологическим дефицитом по шкале инсульта National Institutes of Health Stroke Scale (NIHSS) при поступлении (13,5 баллов против 10,7 и 12 соответственно). Таким образом, новые технологии реперфузионной терапии в первые часы ишемического инсульта активно внедряются в нашей стране, качественно изменяя подходы к лечению и достоверно улучшая исходы заболевания, обусловливая снижение летальности и увеличение числа больных с хорошей степенью восстановления нарушенных неврологических функций.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.