Нарушение функции щитовидной железы и церебральные расстройства
- Аннотация
- Статья
- Ссылки
- English
Сосудистые заболевания головного мозга являются острым и нерешенным вопросом современного здравоохранения и важной медико-социальной проблемой. Несмотря на колоссальные усилия фундаментальных и клинических наук, с каждым годом увеличиваются распространенность сердечно-сосудистых заболеваний, в том числе цереброваскулярных заболеваний (ЦВЗ), и их доля в структуре смертности в мире в целом и Российской Федерации в частности [1].
В последние годы все большее звучание приобретает глобальная синдемия – совокупность кластеров болезней в популяции, которые негативно влияют друг на друга. Результаты клинической и исследовательской работы, проводимой в Российском центре неврологии и нейронаук в последние десятилетия, позволили предложить новую супранозологическую концепцию – цереброметаболическое здоровье. Это определение характеризует высококоординированную структуру физиологического взаимодействия широкого спектра сигнальных механизмов и, в свою очередь, ассоциацию гуморальных расстройств с развитием патологии головного мозга [2].
В широком спектре современных эндокринопатий заболевания щитовидной железы (ЩЖ) являются наиболее часто встречающимися в популяции. Так, распространенность субклинического гипотиреоза может достигать 10%. Глобальная распространенность гипертиреоза оценивается в 0,2–2,5% [3].
Тиреоидные гормоны (ТГ) играют важную роль в онтогенезе и функционировании центральной нервной системы (ЦНС). В последние годы показана роль нарушения тиреоидной функции при разных заболеваниях головного мозга, в первую очередь сосудистых.
Влияние тиреоидных гормонов на центральную нервную систему
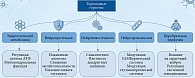
Тиреоидные гормоны воздействуют почти на все ядерные клетки и критически важны для роста, развития и энергетического метаболизма головного мозга, влияя на нейрогенез преимущественно через активацию ядерных рецепторов ТГ, потребление кислорода, интенсивность процессов окислительного фосфорилирования и синтеза аденозинтрифосфата на клеточном уровне [4, 5]. В центральной нервной системе ТГ и их метаболиты воздействуют на множество процессов: морфогенез и дифференцировку нервных структур, нейрональный и глиальный метаболизм, модуляцию апоптоза, нейропластичность нейронов, стимуляцию ангио- и нейрогенеза, локальный и системный иммунный ответ, модуляцию динамики цитоскелета и внутриклеточный транспорт в нейронах и популяциях глиальных клеток, возможно, на гемостаз, а также на защиту от ишемического и реперфузионного повреждения (рис. 1) [6]. Данные гормоны также могут оказывать потенциальное нейропротективное воздействие на области мозга, отвечающие за обучение и память [7].
Молекулярное действие ТГ обусловлено широким спектром геномных и негеномных механизмов, которые регулируют работу митохондрий, ангио- и нейрогенез, аксональный транспорт и поддержание цитоскелета, а также влияют на работу ионных каналов, активацию и экспрессию ряда специфических белков [8]. Геномные механизмы включают связывание трийодтиронина (Т3) с ядерными рецепторами ТГ, что приводит к регуляции транскрипции генов, участвующих в нейрогенезе, дифференцировке, миелинизации, митохондриальном биогенезе, синтезе нейротрофинов (например, мозгового нейротрофического фактора (BDNF)), а также в поддержании цитоскелета и синаптической пластичности. Трийодтиронин усиливает экспрессию генов, ответственных за антиапоптотические белки (Bcl-2), и подавляет экспрессию проапоптотических белков (Bax) [8]. Негеномные механизмы церебральных эффектов ТГ реализуются через мембранные рецепторы, такие как интегрин αVβ3, и включают активацию внутриклеточных сигнальных путей (MAPK, PI3K), модуляцию ионных каналов и транспортеров (Na+/K+-АТФаза, Ca2+-АТФаза), а также быстрое влияние на нейротрансмиссию (ГАМКергическую и глутаматергическую системы). Тироксин (Т4) и тиронамины также проявляют активность, независимую от преобразования в Т3 [9].
Таким образом, определены различные эффекты, которые способны оказывать ТГ на ЦНС благодаря своему многофакторному влиянию на широкий спектр физиологических процессов. Трийодтиронин участвует в регуляции энергетического метаболизма и митохондриальной функции, нормализуя окислительное фосфорилирование, стимулируя β-окисление жирных кислот в астроцитах, увеличивая синтез АТФ и противодействуя митохондриальной дисфункции [10]. Известно и о способности Т3 модулировать эксайтотоксичность через усиление экспрессии астроцитарных транспортеров глутамата, что способствует его клиренсу и снижает активность ионотропных рецепторов глутамата, селективно связывающих N-метил-D-аспартат (NMDA-рецепторов), а также о его иммуномодулирующем и противовоспалительном эффектах. В частности, Т3 демонстрирует способность снижать уровень провоспалительных цитокинов (интерлейкинов (ИЛ) 1 и 6, фактора некроза опухолей α) и подавлять активацию сигнального пути TLR4/NF-κB. Помимо этого, ТГ обладают антиоксидантным и антиапоптотическим действием, влияя на окислительный стресс. Однако их воздействие может быть двунаправленным. Известно, что Т3 подавляет апоптоз через регуляцию ДНК-метилирования, активацию факторов транскрипции (например, KLF9) и секрецию нейротрофических факторов [11]. Еще одной немаловажной ролью ТГ является стимулирование нейропластичности и ангиогенеза за счет эффектов на реорганизацию актинового цитоскелета, увеличения плотности дендритных шипиков и синаптических белков, а также за счет стимуляции церебрального ангиогенеза через активацию фактора роста эндотелия сосудов и фактора роста фибробластов 2 [12].
Влияние нарушения функции щитовидной железы на риск развития, тяжесть течения и функциональные исходы нарушений мозгового кровообращения
В исследованиях, проведенных на большой популяционной когорте, показано, что как гипер-, так и гипотиреоз связаны с повышенным риском инсульта. Однако есть исследования, результаты которых не подтверждают наличия связи между нарушением функции ЩЖ и риском развития инсульта в общей популяции [13].
Гипотиреоз (особенно манифестный) является значимым фактором риска ишемического инсульта вследствие его связи с атеросклерозом, дислипидемией, артериальной гипертензией и инсулинорезистентностью [14]. Субклинический гипотиреоз увеличивает частоту транзиторных ишемических атак. При этом обсуждается гипотеза улучшения адаптации к гипоксии за счет влияния на феномен ишемического прекондиционирования: повышенная жесткость артерий и усиление сублетальной ишемии стимулируют образование коллатералей и снижают метаболические запросы ткани [15].
Гипертиреоз, согласно результатам исследования, проведенного в Корее в 2020 г., связан с повышенным риском ишемического инсульта (ИИ) независимо от наличия сердечно-сосудистых факторов риска [16]. Эти данные также подтверждаются данными исследования, проведенного с использованием метода менделевской рандомизации в 2024 г. [17]. Гипертиреоз ассоциирован с повышенным риском инсульта главным образом из-за связи с развитием фибрилляции предсердий и гиперметаболического состояния, сопровождающегося усиленным образованием активных форм кислорода [18]. Повышенный уровень ТГ также может приводить к увеличению сосудистого сопротивления и развитию церебрального атеросклероза [19]. Помимо этого, гипертиреоз может способствовать агрегации тромбоцитов и тромбозу, тем самым повышая риск развития ИИ [20].
Несмотря на большое количество проведенных клинических исследований, систематических обзоров и метаанализов, связь между тиреоидной функцией и риском развития, тяжестью течения и функциональным исходом ишемического инсульта остается предметом изучения. Анализ прогностической ценности уровней ТГ в отношении тяжести течения и функциональных исходов перенесенного инсульта, включивший 30 оригинальных исследований, демонстрирует устойчивую связь между низким уровнем свободного или общего Т3 при поступлении и тяжелым неврологическим дефицитом, более высокой смертностью и неблагоприятными функциональными исходами ИИ [21].
Данные о влиянии субклинического гипотиреоза на прогноз инсульта противоречивы и зависят от возраста больного. В ряде работ субклинический гипотиреоз ассоциирован с повышенным риском неблагоприятных исходов. Субклинический гипотиреоз увеличивает риск инсульта, фатального инсульта в более молодых популяциях. Так, совокупные коэффициенты риска инсульта составили 3,32 при 95%-ном доверительном интервале (ДИ) 1,25–8,80 для лиц в возрасте 18–49 лет. Риск фатального инсульта в возрастных группах от 18 до 49 лет и от 50 до 64 лет также был повышен – 4,22 (95% ДИ 1,08–16,55) и 2,86 (95% ДИ 1,31–6,26) соответственно [22].
Как и в случае с гипотиреозом, в некоторых эпидемиологических исследованиях показано негативное влияние гипертиреоза на прогноз и тяжесть инсульта [21]. Субклинический гипертиреоз может быть ассоциирован с повышенным риском плохого функционального исхода через три месяца после нарушения мозгового кровообращения (НМК), особенно у получавших реперфузионную терапию, что обусловлено повышенной частотой фибрилляции предсердий и кардиоэмболических инсультов [5]. Однако нужно отметить, что не во всех исследованиях отражена независимая прогностическая значимость ТГ [23].
В 2023 г. было проведено проспективное исследование динамики функции ЩЖ в разные фазы ишемического инсульта и ее связи с тяжестью неврологического дефицита [24]. По результатам данного исследования выявлена транзиторная супрессия тиреоидной функции в острейшую и острую фазы инсульта с последующим ее восстановлением в хронической фазе. При этом тяжесть НМК при поступлении, оцененная по NIHSS, достоверно была ассоциирована со снижением уровня свободного Т3 в остром периоде. Предполагаемые механизмы наблюдаемых изменений включают подавление гипоталамо-гипофизарно-тиреоидной оси вследствие выброса кортикостероидов в ответ на инсультиндуцированный стресс и уменьшение активности дейодиназ, ответственных за конверсию Т4 в активный Т3, под влиянием системного воспалительного ответа и других факторов острого повреждения [24]. Таким образом, снижение уровня свободного Т3, обычно ассоциированное с худшим функциональным исходом и повышенной смертностью после ИИ, может быть связано с тяжестью инсульта. Низкий уровеньТ3 может служить маркером степени повреждения, однако нельзя исключать возможность порочного круга, при котором тяжелый инсульт вызывает снижение уровня Т3, которое, в свою очередь, может усугублять повреждение мозга (например, за счет снижения астроцитарного захвата глутамата и усиления цитотоксического отека), ухудшая функциональный исход [24]. Тиреоидные гормоны могут оказывать благоприятное воздействие при ишемии мозга, ингибируя апоптоз и подавляя воспалительные реакции. Кроме того, эти гормоны оказывают нейропротективное влияние, уменьшая реактивный глиоз и увеличивая экспрессию нейротрофического фактора [25].
Результаты исследования, посвященного поиску связи между аутоантителами к ЩЖ и тяжестью ИИ, демонстрируют, что повышенный уровень тиреоидных аутоантител ассоциирован с большей тяжестью острого ИИ и показателями внутрибольничной смерти среди пациентов с нормальной функцией ЩЖ. Полученные данные позволили авторам исследования предположить, что аутоиммунный процесс, связанный с тиреоидными антителами, может усугублять повреждение эндотелия и атеросклероз, тем самым отягощая течение инсульта [26].
Связь нарушения тиреоидной функции с изменением липидного метаболизма и атеросклерозом
Гиперлипидемия, ассоциированная с гипотиреозом, характеризуется повышенными уровнями липопротеинов низкой плотности (ЛПНП), липопротеинов очень низкой плотности и триглицеридов в крови – модифицируемыми факторами риска развития атеросклероза [27]. Известно, что гормоны ЩЖ регулируют экспрессию ключевых ферментов, участвующих в метаболизме липидов. Как гипотиреоз, так и гипертиреоз связаны с изменением уровня липидов [28]. Патогенез гипотиреозассоциированной гиперлипидемии многофакторный. Он обусловлен комплексным воздействием как дефицита ТГ, так и повышенного уровня тиреотропного гормона (ТТГ) на метаболизм липидов. У пациентов с гипотиреозом наблюдается характерный атерогенный липидный профиль [29].
Дефицит ТГ приводит к глубоким нарушениям на этапах метаболизма липидов. Поскольку ТГ являются регуляторами экспрессии рецепторов к ЛПНП (ЛПНП-Р) на гепатоцитах, их недостаток сказывается на синтезе и клиренсе ЛПНП, приводя к снижению количества ЛПНП-Р и, как следствие, клиренса ЛПНП из кровотока [30]. Кроме того, ТГ модулируют активность ключевых транскрипционных факторов липогенеза [31]. Гипотиреоз влияет на метаболизм триглицеридов путем подавления активности липопротеинлипазы и параллельно протекающей стимуляции экспрессии ингибиторов липопротеинлипазы, что усугубляет гипертриглицеридемию [32]. Помимо этого, ТГ участвуют в регуляции экспрессии транспортеров, задействованных в обратном транспорте холестерина и изменении активности ферментов, модифицирующих липопротеины высокой плотности (ЛПВП), что приводит к формированию дисфункциональных ЛПВП-частиц и нарушению обратного транспорта холестерина [33].
Кроме того, ТТГ обладает независимым от Т3 и Т4 прямым воздействием на метаболизм липидов. Так, ТТГ, связываясь со своим рецептором на адипоцитах и гепатоцитах и активируя cAMP/PKA-сигнальный путь, может стимулировать липолиз, увеличивать экспрессию 3-гидрокси-3-метилглютарил-кофермента А редуктазы (ГМГ-КоА-редуктазы) и повышать уровень пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9) [34]. Это происходит под влиянием высокого уровня ТТГ и низких концентраций ТГ и относится к числу недавно выявленных биомаркеров, задействованных в патогенезе дислипидемии при гипотиреозе [35].
Таким образом, гиперлипидемия при гипотиреозе является следствием сложного взаимодействия гормональных сигналов, приводящего к дисрегуляции ключевых путей синтеза, катаболизма и транспорта липидов.
В ряде исследований также указывается на связь гипо- и гипертиреоза с повышенным риском развития атеросклероза вследствие ремоделирования артериальной стенки [36]. Согласно данным систематического обзора, существует зависимость между субклиническим и манифестным гипотиреозом и увеличением толщины комплекса «интима – медиа» [36]. К механизмам таковой относят эндотелиальную дисфункцию, а именно нарушение эндотелийзависимой вазодилатации, опосредованное снижением синтеза оксида азота [37]. Важную роль также играет хроническое субклиническое воспаление, обусловленное как циркулирующими антителами, так и связыванием ТТГ со своими рецепторами на иммунных клетках (макрофагах), гладкомышечных клетках сосудов и эндотелиальных клетках. Это активирует провоспалительные сигнальные пути и приводит к высвобождению цитокинов (например, ИЛ-6), которые стимулируют образование и дестабилизацию атеросклеротических бляшек [38]. Кроме того, описаны повышение жесткости сосудистой стенки и прямое влияние на гладкомышечные клетки и синтез коллагена [39].
Влияние тиреоидных гормонов на когнитивные функции
Проблема когнитивных нарушений (КН) является одной из самых чувствительных для современного здравоохранения в частности и общества в целом. Так, сосудистая деменция составляет от 20 до 40% всех видов деменции [40]. В пожилом возрасте КН чаще всего имеют полиэтиологическую природу. У пациентов с ЦВЗ дисфункция ЩЖ может быть потенциальной причиной ухудшения когнитивных способностей.
Явный гипотиреоз ассоциирован с нарушениями вербальной памяти, внимания, исполнительных функций, а также с депрессивной и тревожной симптоматикой [41]. Пожилой возраст и длительность заболевания усугубляют когнитивный дефицит [42]. Результаты метаанализов указывают на связь гипотиреоза со снижением когнитивных функций у лиц моложе 75 лет [43].
Явный гипертиреоз характеризуется снижением внимания и памяти [41, 42]. Субклинический гипертиреоз ассоциирован с повышенным риском деменции у пожилых [44]. И повышение, и снижение концентрации свободного Т4 с течением времени приводит к более быстрому развитию КН у людей среднего и пожилого возраста, несмотря на отсутствие манифестного дистиреоза [45].
Отдельное внимание уделяется роли аутоиммунных антител к тиреопероксидазе (анти-ТПО) и рецепторам ТТГ, ассоциированных с КН, предположительно, в связи с прямым воздействием на нейроны и глию, васкулопатией, активацией провоспалительных цитокинов и перекрестной реактивностью с нейрональными антигенами.
Важным методом прижизненной идентификации нарушений мозга является нейровизуализация – компьютерная и магнитно-резонансная томографии (МРТ) головного мозга. Описаны нейровизуализационные паттерны патологии ЩЖ. Согласно результатам МРТ головного мозга, при гипотиреозе фиксируются изменения в перфузии и активации фронтальных зон [46]. При гипертиреозе по МРТ-данным отмечается атрофия гиппокампа и височных долей, а по данным позитронно-эмиссионной томографии – снижение метаболизма глюкозы в лимбической системе [47].
Нарушение перфузии мозга является установленным фактором риска развития деменции и транзиторных ишемических атак. Результаты, полученные в рамках Роттердамского исследования, свидетельствуют о том, что как гипо-, так и гипертиреоидные состояния, а также аутоиммунный тиреоидит ухудшают церебральную гемодинамику как на уровне глобальной перфузии мозга, так и на уровне микроциркуляции. При низких значениях свободного T4 и высоком уровне ТТГ отмечено развитие сердечной недостаточности и снижение сердечного выброса, что также может ухудшать перфузию мозга. В случае хронического аутоиммунного тиреоидита ухудшение гемодинамики может быть обусловлено эндотелиальной дисфункцией и повышением артериального давления [48].
Роль тиреоидных нарушений в развитии расстройств тревожно-депрессивного спектра
Расстройства настроения широко распространены у пациентов с инсультом, причем во всех возрастных группах [49]. Постинсультная депрессия и тревога затрагивают каждого третьего, выжившего в первый год после НМК [50].
Патогенез постинсультной депрессии сложен, включая дисрегуляцию гипоталамо-гипофизарно-тиреоидной оси [51].
К предполагаемым механизмам связи относят нарушение регуляции серотонинергической нейропередачи и системы ГАМК под влиянием ТГ, а также их роль в нейропротекции, метаболизме нейронов и окислительном стрессе после инсульта [52].
Дистиреоз оказывает значимое влияние на развитие депрессии и тревоги через гормональные, аутоиммунные, сосудистые и нейротрансмиттерные механизмы [41]. Продемонстрирована устойчивая связь гипотиреоза с депрессивными симптомами, особенно при снижении уровней свободных T3 и T4 и повышении уровня анти-ТПО [53]. Субклинический гипотиреоз ассоциирован со значимыми структурными и функциональными изменениями в мозге, особенно в лобных и затылочных областях, что может объяснять более высокие, чем в популяции, показатели депрессии и тревожности [54].
Влияние дисфункции ЩЖ при тревожных расстройствах остается менее изученным. Согласно результатам систематического обзора, посвященного анализу функционирования гипоталамо-гипофизарно-тиреоидной оси при тревожных расстройствах, имеет место значимая коморбидность для тревожных расстройств и заболеваний щитовидной железы [55]. В систематическом обзоре и метаанализе показано, что аутоиммунный тиреоидит является значимым фактором риска развития психоэмоциональных нарушений: 23,8% пациентов страдают депрессией, 41,6% – тревожными расстройствами [56].
Взаимосвязь нарушения функции щитовидной железы и приверженности лечению
У пациентов с гипотиреозом приверженность заместительной терапии левотироксином варьируется от низкой до умеренной. Среди неприверженных лечению большинство (93%) были классифицированы как ненамеренно неприверженные, то есть они забывали о приеме препарата или были небрежны в его применении [57]. Выявлена статистически значимая корреляция между субъективно оцениваемыми проявлениями так называемого мозгового тумана, симптомокомплекса, включающего в том числе когнитивную дисфункцию и мнестические расстройства, и снижением приверженности терапии пациентов с гипотиреозом [58]. В то же время соблюдение режима заместительной гормональной терапии может уменьшать риск развития деменции, особенно у пациентов пожилого возраста с впервые выявленным гипотиреозом [59].
Приверженность терапии – ключевой фактор, определяющий эффективность лечения. Однако при ЦВЗ данная проблема требует дальнейшего изучения, особенно в отношении влияния коморбидных расстройств, таких как патология щитовидной железы [60].
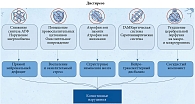
Анализ современных научных данных убедительно демонстрирует существование тесной и многогранной связи между функцией щитовидной железы и церебральным здоровьем. Такие нарушения, как гипо- и гипертиреоз, включая их субклинические формы, могут рассматриваться в качестве модифицируемых факторов риска развития и неблагоприятного течения цереброваскулярных заболеваний и когнитивных расстройств (рис. 2).
Основные механизмы этого влияния носят комплексный характер и включают:
- прямое воздействие на мозг. Тиреоидные гормоны являются критическими регуляторами энергетического метаболизма, нейропластичности, нейропротекции, антиоксидантной защиты и нейротрансмиссии в ЦНС. Их дефицит или избыток нарушает эти процессы, повышая уязвимость мозга к ишемическому повреждению и затрудняя восстановление;
- опосредованный сердечно-сосудистый эффект. Дисфункция ЩЖ способствует развитию и прогрессированию атеросклероза через индукцию дислипидемии, эндотелиальной дисфункции, хронического воспаления и повышения жесткости сосудистой стенки. Гипертиреоз дополнительно увеличивает риск кардиоэмболических инсультов вследствие фибрилляции предсердий;
- воздействие на церебральную гемодинамику. Как гипо-, так и гипертиреоидные состояния ассоциированы с ухудшением перфузии головного мозга, что создает дополнительный риск развития ишемии и снижения когнитивных функций;
- влияние аутоиммунитета. Наличие тиреоидных аутоантител (антител к тиреопероксидазе и тиреоглобулину) само по себе является независимым фактором риска более тяжелого течения инсульта и нарушения когнитивных функций, вероятно, за счет усугубления эндотелиальной дисфункции и системного воспаления.
Заключение
Значимость дистиреоза в клинике широкого спектра патологических состояний может указывать на целесообразность интеграции оценки функции ЩЖ в алгоритмы ведения как лиц с ЦВЗ, так и лиц с высоким риском их развития. Расширение концепции цереброметаболического здоровья за счет включения оценки тиреоидного статуса открывает перспективы для разработки более эффективных стратегий первичной и вторичной профилактики заболеваний головного мозга, а также для реализации персонализированного подхода к лечению неврологических пациентов. Особого внимания заслуживает изменение тиреоидного статуса в остром периоде инсульта, которое может быть как маркером тяжести повреждения мозга, так и самостоятельным патогенетическим звеном, формирующим порочный круг и ухудшающим функциональный исход.
Дисфункция ЩЖ вносит значительный вклад в развитие КН, депрессии и тревожных расстройств, существенно снижая качество жизни больных. Низкая приверженность лечению, в том числе связанная с когнитивными нарушениями, является дополнительным барьером на пути к достижению эффективного контроля как тиреоидной, так и цереброваскулярной патологии. Дальнейшие исследования должны быть направлены на уточнение причинно-следственных связей и клинических особенностей течения ЦВЗ в комплексе с тиреоидной патологией, а также на оценку потенциальной пользы коррекции тиреоидных нарушений для улучшения неврологического прогноза.
K.V. Antonova, PhD, T.S. Shishkina, O.V. Lagoda, PhD, M.M. Tanashyan, Academician of the RASci., PhD, Prof.
Russian Сenter of Neurology and Neurosciences
Contact person: Ksenia V. Antonova, antonova@neurology.ru
Cerebrovascular diseases and the cognitive disorders that often accompany them represent an unresolved problem for modern healthcare in particular and society as a whole. The modification of metabolic risk factors is considered a key factor in preserving brain health. Thyroid diseases, which are widespread in the population, can influence the development and functioning of the central nervous system. This review highlights the negative impact of thyroid dysfunction on the risk of development and prognosis of stroke, cognitive, and other disorders. The article discusses the mechanisms of the influence of thyroid hormones on brain function and presents a wide range of effects of both hypo- and hyperthyroidism on structural and functional impairments of cerebral structures; potential pathways for neuroprotection are also outlined.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.