Современные представления об инфекции органов мочевой системы у новорожденных и детей раннего возраста
- Аннотация
- Статья
- Ссылки
- English

Возникновению нарушений органов мочевой системы у детей раннего возраста способствует морфофункциональная незрелость почек, особенно при наличии у ребенка обструктивных уропатий, инфекции, гипоксических состояний, предшествующих реанимационных мероприятий [1, 2]. Малосимптомность и неспецифичность клинических проявлений заболеваний почек и мочевыводящих путей у новорожденных и детей первых трех лет жизни затрудняет своевременную диагностику, что способствует хронизации процесса из-за позднего проведения адекватной терапевтической коррекции [3, 4, 5]. Особенностью заболеваний почек у новорожденных и грудных детей является своеобразный фон – морфологическая незрелость почечной ткани и недифференцированность нефронов в функциональном отношении [6, 7]. У новорожденных детей стали чаще встречаться латентные формы нефропатий, поздно диагностируемые и рано приводящие к развитию хронической болезни почек и инвалидизации пациентов.
Гипоксия и наступающие вследствие этого расстройства микроциркуляции в почечной ткани являются одним из ведущих факторов развития инфекционно-воспалительного процесса в почках [3]. На долю инфекционно-воспалительных заболеваний органов мочевой системы приходится большинство нозологических форм нефропатий в детском возрасте. Данные ежегодных популяционных исследований свидетельствуют о неуклонном нарастании частоты инфекции органов мочевой системы в детском возрасте. Среди детей раннего возраста (первых трех лет жизни) эта патология встречается чаще, чем острая респираторная инфекция [1, 8, 9].
Определение и классификация инфекции органов мочевой системы
Сложностями в определении локализации патологического процесса, особенно у новорожденных и детей раннего возраста, обусловлено появление в отечественной и зарубежной литературе термина «инфекция органов мочевой системы», под которым понимается инфицированность и воспалительные изменения любых отделов мочевой системы без специального указания на ее уровень (мочевыделительный тракт или почечная паренхима) [1]. Инфекция органов мочевой системы, объединяющая пиелонефрит, инфекцию мочевыводящих путей, цистит, уретрит и асимптоматическую бактериурию, обнаруживается у новорожденных наиболее часто из всех нефропатий (в 37% случаев) [10].
Пиелонефрит – инфекционно-воспалительное заболевание почек с преимущественным поражением чашечно-лоханочной системы, канальцев и интерстиция; с клинической картиной инфекционного заболевания, особенно у детей раннего возраста; характеризуется лейкоцитурией и бактериурией и обязательным нарушением функционального состояния почек. По данным J. Winberg (1988) [11], в перечне наиболее значимых заболеваний почек в индустриально развитых странах пиелонефрит занимает первое место и встречается у детей первого года жизни с частотой 1:100. В последние годы пиелонефрит относят к инфекционному (бактериальному) варианту тубулоинтерстициального нефрита, что нашло отражение в шифрах Международной классификации болезней 10-го пересмотра (МКБ-10) «Болезни мочеполовой системы».
Цистит – воспалительное заболевание мочевого пузыря. У детей раннего возраста возникновению цистита способствуют особенности анатомического строения стенки мочевого пузыря, а именно:
- малый объем мочевого пузыря;
- более тонкая слизистая оболочка и меньшее (по сравнению со взрослыми) развитие желез слизистого слоя;
- богатая васкуляризация стенки;
- разрастание интерстициальной ткани;
- слабое развитие мышечной оболочки и сфинктеров;
- короткий интрамуральный отдел мочеточников.
Эквивалентом дизурических явлений у новорожденного ребенка могут быть выраженное беспокойство перед мочеиспусканием и во время него, плач, натуживание, покраснение лица, прерывистость мочеиспускания, слабость мочевой струи [12].
Асимптоматическая бактериурия – бактериурия в отсутствие лейкоцитурии и выраженной клинической манифестации – характеризует течение инфекционно-воспалительного процесса в нижних отделах мочевой системы преимущественно у новорожденных детей, нередко диагностируется у относительно здоровых новорожденных. При асимптоматической бактериурии большое значение имеет иммунный статус. Патогенез асимптоматической бактериурии достаточно сложен, в последнее время высказывается предположение об ее эндогенном происхождении. Источником бактериурии может быть кишечник. Асимптоматическая бактериурия является фактором риска развития пиелонефрита и других инфекционных заболеваний органов мочевой системы [13].
Общепринятой признана классификация инфекции мочевой системы по J. Winberg (1987):
- Уровень поражения:
- инфекция верхних мочевых путей (пиелонефрит);
- инфекция нижних мочевых путей (цистит, уретрит).
- Клинические проявления:
- симптоматическая;
- бессимптомная (изолированная бактериурия).
- Наличие факторов, осложняющих течение и способствующих рецидивированию инфекций мочевых путей:
- осложненная;
- неосложненная.
- Течение:
- острое;
- хроническое:
а) редко рецидивирующее;
б) часто рецидивирующее;
в) непрерывно рецидивирующее.
В периоде новорожденности пиелонефрит чаще встречается у мальчиков, в грудном возрасте частота заболевания у детей обоего пола примерно одинакова. В дальнейшем пиелонефрит встречается у девочек в 6–10 раз чаще, чем у мальчиков, что объясняется особенностями мочевых путей девочек [1, 13].
Этиология
По данным разных авторов, этиологическим фактором развития пиелонефрита у детей первых трех лет жизни чаще всего являются различные штаммы кишечной палочки (до 75%), реже обнаруживаются клебсиелла, протей, энтерококки, стафилококк и другие бактерии. Однако развитие пиелонефрита определяется не только количественными характеристиками бактериурии, но и особенностями микро- и макроорганизма. Уропатогенные штаммы микробов отличаются способностью к адгезии (прилипанию) к эпителию мочевыводящих путей. Для них характерны высокие темпы роста. Затяжное и рецидивирующее течение пиелонефрита может быть связано с воздействием микоплазм, хламидий, грибов рода Candida.
У детей раннего возраста пиелонефрит развивается, как правило, при нарушении уродинамики или нестабильности цитомембран. Дисрегуляция системы кишечного микробиоценоза со снижением колонизационной резистентности кишечника и увеличением условно-патогенной флоры считается одним из научно обоснованных механизмов инфицирования мочевого тракта у детей первых трех лет жизни [1, 8, 13–18]. Особенности макроорганизма в известной степени предопределяют высокий риск инфекционно-воспалительных заболеваний мочевой системы. Прежде всего это наличие малых или больших врожденных аномалий органов мочевой системы и нарушения уродинамики. Установлено, что в 90,3% случаев в основе развития пиелонефрита лежат морфологические аномалии развития мочевого тракта. В связи с этим понятен интерес исследователей к изучению врожденных пороков развития органов мочевой системы, составляющих от 1/10 до 1/3 всех аномалий органов в популяции [1, 13].
Однако наличие обструкций в мочевой системе реализуется в пиелонефрит только в условиях неблагоприятных внешних воздействий [19]. Известно огромное разнообразие различных мутагенов, тератогенов, включая ряд лекарственных препаратов, оказывающих губительное влияние на развитие плода в целом и органов мочевой системы в частности. На возникновение пиелонефрита у новорожденных влияют такие предрасполагающие факторы, как позднее прикладывание к груди, ранний перевод на смешанное и искусственное вскармливание. Исследованиями последних лет доказано, что бактериальные инфекции органов мочевой системы у новорожденных чаще возникают при нарушении микрофлоры кишечника. Большое значение в возникновении пиелонефрита у детей имеет нейрогенная дисфункция мочевого пузыря [1, 8, 12, 16].
Патогенез
Наиболее характерным для детского возраста является восходящий путь проникновения инфекции в мочевую систему. Гематогенное инфицирование свойственно новорожденным и детям первых месяцев жизни со сниженным иммунитетом. Убедительных данных о наличии лимфогенного пути передачи инфекции до настоящего времени нет. Важным фактором, способствующим развитию инфекции мочевой системы, является периуретральная колонизация. Периуретральная флора, представленная в основном грамотрицательными бактериями, включает микроорганизмы, преимущественно вызывающие инфекцию мочевыводящей системы у детей раннего возраста: Escherichia coli – 40–60–90%, Klebsiella – 7–20%, Proteus mirabilis – 9–16%. Грамположительная кокковая флора (энтерококки, стафилококки, стрептококки) при симптоматической бактериурии определяется в 10–20% случаев. Нередко встречаются ассоциации микроорганизмов (E. coli + Proteus, E. coli + Klebsiella, E. coli + Entеrococci), вирусная инфекция (аденовирусы, энтеровирусы Коксаки В и др.) [13, 15]. Микроорганизмы также могут проникать в мочевой пузырь, минуя уретру, путем так называемой транслокации из кишечника [20]. Исследования последних лет свидетельствуют о генетической предрасположенности к воспалительным заболеваниям органов мочевой системы. Мутации генов Рах2 и АТ2 приводят к формированию врожденных аномалий мочевой системы как на органном, так и на тканевом уровне, что, в свою очередь, снижает местную резистентность к инфекции и способствует развитию воспаления [20–23]. Тем не менее ведущую роль в развитии микробно-воспалительного процесса в почках играют нарушения уродинамики, из них наиболее часто встречается пузырно-мочеточниковый рефлюкс [12, 24, 25].
Клиническая картина
Наиболее часто пиелонефрит у детей раннего возраста протекает латентно, без явных клинических проявлений или малосимптомно, что приводит к поздней диагностике, когда уже имеют место тяжелые повреждения почечной паренхимы и формируется хроническая почечная недостаточность [1, 10, 26, 27]. Возможность латентного течения пиелонефрита во многом объясняется слабостью иммунной системы детского организма. В раннем возрасте ребенок склонен к генерализации инфекции. Поскольку инфекция органов мочевой системы у детей первого года жизни характеризуется малосимптомностью течения, а также более высоким уровнем потенциального развития повреждения почечной ткани, чем у детей старшего возраста, врач должен проявлять повышенную настороженность. Быстрая и значительная деструкция ткани у новорожденных происходит вследствие даже острого воспалительного пиелонефритического процесса. Рядом авторов показано, что ранняя диагностика и адекватная терапия инфекционно-воспалительного заболевания у новорожденных и детей первого года жизни предотвращают дальнейшее повреждение почек и тем самым уменьшают вероятность хронизации процесса и инвалидизации пациентов [1, 4, 28, 29].
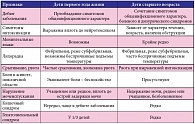
Инфекция органов мочевой системы в неонатальном периоде редко течет изолированно, и клиническая картина у новорожденных обычно обусловлена сопутствующими нарушениями. В клинической картине у большинства новорожденных доминируют неспецифические признаки: симптомы интоксикации, субфебрилитет, слабое сосание, недостаточная прибавка массы тела, дисфункция кишечника. Клиническая картина пиелонефрита у детей раннего возраста достаточно полиморфна (табл. 1). Первые симптомы чаще появляются на 2–4-й неделе жизни. У новорожденных детей в постреанимационном периоде заболевания органов мочевой системы редко бывают изолированными. Яркая клиническая картина возникает обычно только при грубых пороках развития почек. На первый план выступают симптомы поражения центральной нервной системы, явления дыхательной и сердечно-сосудистой недостаточности [1, 3, 5, 13, 16].
Диагностика
Основными лабораторными анализами, подтверждающими диагноз пиелонефрита, являются: 1) общий анализ мочи, в котором выявляются лейкоцитурия от 15–20 лейкоцитов в поле зрения (что более характерно для патологии дистальных отделов мочевой системы) до покрытия лейкоцитами сплошь всего поля зрения (наиболее часто встречается при пиелонефрите), бактериурия, а также отмечается нейтральная или щелочная реакция мочи, мутность мочи, наличие солей, умеренная протеинурия от следовой до 0,06 г/л (однако при пороках развития почек, наличии пузырно-мочеточникового рефлюкса протеинурия может быть более выраженной); 2) посев мочи, в котором наиболее часто высеваемым возбудителем является кишечная палочка, реже встречаются клебсиелла, синегнойная палочка, протей; 3) общий анализ крови, в котором подтверждается воспалительный характер патологического процесса: лейкоцитоз и увеличение скорости оседания эритроцитов (СОЭ).
Для инфекции органов мочевой системы прежде всего характерна бактериурия. Рост более 100 000 колониеобразующих единиц (КОЕ) в свежевыделенной моче является основным отличием истинной бактериурии от простой контаминации.
Назовем основные принципы оценки результатов посева мочи у детей раннего возраста:
- За рубежом у детей первого года жизни распространено исследование мочи, полученной путем надлобковой пункции мочевого пузыря. Любой рост бактерий, выявляемый при данном методе забора мочи, считается значимым в отношении развития инфекции мочевой системы. В России данный метод не нашел широкого распространения.
- Диагностически значимым является выделение 102 КОЕ/мл мочи, полученной при катетеризации мочевого пузыря.
- При выделении микроорганизма в монокультуре из свежевыделенной мочи (собранной в стерильную емкость при свободном мочеиспускании) в титре > 105 КОЕ/мл этот возбудитель может считаться этиологически значимым, даже в случае отсутствия характерной клинической картины инфекции мочевой системы.
- Если образец взят у ребенка с симптомами инфекции органов мочевой системы или на фоне приема антибактериальных препаратов, то выделение возбудителя даже в титре > 102 КОЕ/мл может считаться этиологически значимым.
- У новорожденных этот уровень не достигается по причине более короткого времени присутствия бактерий в моче. В этой связи повторный высев одного и того же возбудителя у детей первых трех месяцев жизни, независимо от количества, должен рассматриваться как бактериурия, особенно при наличии других симптомов инфекции органов мочевой системы [28, 30, 31].
Необходимым условием достоверности результатов бактериологического исследования мочи является сбор анализов до начала антибактериальной терапии. Отсутствие бактериурии при проведении посевов может быть связано с влиянием антибактериальной терапии, образованием L-форм, наличием микроорганизмов, не выявляемых при обычном микробиологическом исследовании [14, 16].
К дополнительным методам обследования детей относят выявление более редких возбудителей инфекции (хламидии, микоплазма, уреаплазма, грибы, микобактерии туберкулеза), исследование гуморального и клеточного иммунитета. Пиелонефритический процесс позволяют определить и такие дополнительные исследования, как биохимическое исследование мочи, выявляющее нарушения канальцевых функций почек (снижение ацидоаммониогенеза, оксалурия, уратурия, фосфатурия и кальцийурия); биохимический анализ крови, благодаря которому можно определить степень активности воспалительного процесса и функцию почек (белок и белковые фракции, мочевина, С-реактивный белок); ультразвуковое исследование почек, позволяющее обнаружить аномалии развития почек. По данным ультразвукового исследования (УЗИ) может выявляться увеличение почек, снижение (в острую фазу) или повышение эхогенности паренхимы почек, осуществляется оценка интраренальной гемодинамики (дуплексное допплеровское сканирование и допплерография почечных сосудов). Высокая чувствительность метода позволяет выявить инфильтративно-склеротические процессы в почечной паренхиме на ранних этапах и обеспечивает возможность длительного динамического наблюдения больных с пиелонефритом [20, 32, 33]. При цистографии устанавливается наличие пузырно-мочеточникового рефлюкса и клапана задней уретры; по данным урографии и реносцинтиграфии почек определяется нарушение функции почек [16, 28, 30, 31, 34]. Результаты исследования A. Hoberman и соавт. [35], в частности, подтвердили высокую распространенность уродинамических нарушений у детей раннего возраста – у 39% детей с инфекцией органов мочевой системы был обнаружен пузырно-мочеточниковый рефлюкс. Динамическая нефросцинтиграфия проводится для визуализации и оценки функционального состояния почек (степени перфузии органа, скорости клубочковой фильтрации, выделительной функции). Статическую сцинтиграфию рекомендуют для определения количества функционирующей паренхимы, наличия очаговых образований (рубцов) в почке, позволяющих диагностировать рефлюкс-нефропатию [35, 36].
Ряд исследователей обратили внимание на значительное повышение уровня прокальцитонина (procalcitonin, РСТ) в плазме у детей с инфекцией органов мочевой системы [37]. При этом для инфекции мочевой системы этот метод является высокоспецифичным – 89,7%; для сравнения: специфичность метода определения С-реактивного белка составляет 18,5%. РСТ также может использоваться как высокочувствительный маркер формирования нефросклероза. У детей с нефросклерозом концентрация РСТ в плазме в 1,5 раза превышает таковую у больных без структурных изменений в почках.
Наибольшие трудности у новорожденных детей представляет дифференциальная диагностика пиелонефрита с инфекцией мочевыводящих путей. Важную роль здесь играет определение ферментурии и уровня бета-2-микроглобулина (Б-2-МГ) в крови и моче, поскольку без вовлечения в процесс почечной ткани активность ферментов и нарастание значений Б-2-МГ у пациентов с инфекцией мочевыводящих путей выражены незначительно. При пиелонефрите повышается активность всех ферментов мочи, за исключением холинэстеразы. Наиболее значительно повышен уровень лактатдегидрогеназы (в 6 раз превышает норму), а также гамма-глутамилтрансферазы (в 3 раза выше нормы). Наблюдается также значительное увеличение содержания Б-2-МГ в моче (в 20–25 раз), при этом в сыворотке крови уровень Б-2-МГ повышается только в 1,3 раза [10]. Следовательно, инфекцию мочевыводящих путей (как инфекционно-воспалительное заболевание нижних отделов мочевой системы, не затрагивающее почки) можно предположить у детей неонатального периода при выявлении только мочевого синдрома в виде лейкоцитурии, протеинурии и бактериурии и в отсутствие изменений по данным рентгенологических и ультразвуковых методов исследования, метаболических нарушений, изменения воспалительного характера в анализе крови, а также нарастания ферментурии и увеличения уровня Б-2-МГ в крови и моче. В случае обнаружения нарушения уродинамики, наличия аномалий развития почек, воспалительных изменений в крови, мочевого синдрома, бактериурии, метаболических изменений, снижения концентрационной функции почек, выявления значительной ферментурии и повышения Б-2-МГ в моче можно предположить развитие вторичного (обструктивного) пиелонефрита.
Еще раз подчеркнем: по причине недостаточно выраженных клинических проявлений инфекции органов мочевой системы у детей раннего возраста, а также учитывая более высокий риск развития повреждения почечной ткани, чем у старших детей, дети раннего возраста с инфекцией органов мочевой системы должны находиться под пристальным наблюдением педиатров и нефрологов.
Американская академия педиатров (American Academy of Pediatrics – AAP) разработала следующие рекомендации по диагностике и лечению инфекции органов мочевой системы у новорожденных и детей раннего возраста (1999):
- наличие инфекции органов мочевой системы должно быть заподозрено у всех детей в возрасте от 2 месяцев до 2 лет с необъяснимой лихорадкой, у таких детей должно быть проведено обследование;
- детям раннего возраста с необъяснимой лихорадкой (без катаральных явлений) рекомендуется достаточно быстро назначать антимикробную терапию (до получения результатов посева мочи), а при выраженной степени интоксикации, дегидратации и снижении способности перорального усвоения питания – парентеральное введение антибактериальных средств;
- сбор мочи для посева у детей первого года жизни рекомендовано осуществлять через катетеризацию мочевого пузыря, а также методом надлобковой пункции (данный метод используется за рубежом, но не нашел широкого применения в нашей стране – Прим. авт.);
- при отсутствии положительного клинического ответа у детей раннего возраста с инфекцией органов мочевой системы на проводимую в течение 2 суток антимикробную терапию необходимо повторное исследование мочи;
- дети в возрасте от 2 месяцев до 2 лет с инфекцией органов мочевой системы, получавшие парентеральное введение антибиотика, должны после этого пройти 7–14-дневный курс пероральной антибактериальной терапии;
- после 7–10-дневного курса антибактериальной терапии и санации мочи детям раннего возраста с инфекцией органов мочевой системы необходимо назначить прием антимикробных препаратов в терапевтических или профилактических дозах в течение 3–4 недель [28].
Лечение инфекции органов мочевой системы у детей раннего возраста
Инфекции мочевой системы рецидивируют у большей части пациентов в ближайшие 3 месяца после первого эпизода, в связи с чем нередко требуется проведение повторных курсов антибактериальной терапии. От того, насколько правильно выбрана стартовая антимикробная терапия инфекции мочевой системы, в конечном итоге зависят эффективность лечения и прогноз болезни [38]. Основное место в терапии инфекции органов мочевой системы занимают антибактериальные препараты широкого спектра действия, способные подавлять как грамотрицательную, так и грамположительную флору – в первую очередь цефалоспорины II и III поколения и защищенные пенициллины [14, 16, 28, 30, 31, 38]. Цефиксим – это цефалоспорин III поколения для приема перорально, обладающий повышенной устойчивостью к гидролизу под действием бета-лактамаз. Характеризуется высоким проникновением в ткань почек, создает в ткани почек и моче концентрации, во много раз превышающие минимальную подавляющую концентрацию (МПК) в отношении E. coli. У детей возможно применение в виде гранул для приготовления суспензии и диспергируемых таблеток. Цефиксим (препарат Супракс®) обладает хорошими органолептическими свойствами, его можно принимать 1 раз в день, вне связи с приемом пищи.
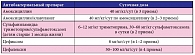
Дозы антибактериальных препаратов для лечения инфекции органов мочевой системы у детей раннего возраста указаны в табл. 2 и 3.
Возможна «ступенчатая» схема лечения (один препарат назначается сначала парентерально, а затем перорально) [8, 16]. В последнее время, согласно результатам ряда недавних исследований, у детей раннего возраста преобладает грамотрицательная флора, малочувствительная к цефалоспоринам II поколения, что диктует необходимость постоянного мониторинга микрофлоры мочи для коррекции антибактериальной терапии. Необходимым звеном рациональной терапии инфекции мочевой системы является определение чувствительности выделенного возбудителя к антибактериальным препаратам. При необходимости производится смена антибактериального препарата. Курс лечения при пиелонефрите составляет 10–14 дней, при цистите – 7 дней [16, 30, 34].
Профилактика инфекционно-воспалительных заболеваний органов мочевой системы
После окончания антибактериальной терапии и санации мочи рекомендуется назначение уроантисептиков. У детей раннего возраста наиболее часто применяется фуразидин в дозе 6–8 мг/кг/сут в течение 2–4 недель. При наличии пузырно-мочеточникового рефлюкса большинство исследователей склоняются к длительной антимикробной терапии в профилактических дозах (например, нитрофурантоин 1–2 мг/кг однократно в сутки). Спорным остается вопрос о необходимости длительного назначения детям с атакой пиелонефрита, но имеющим нормальные результаты реносцинтиграфии и цистографии, профилактических доз антимикробных препаратов. Профилактика может быть рекомендована у детей младше 6 месяцев жизни с повторяющимися эпизодами инфекции органов мочевой системы и у детей с пузырно-мочеточниковым рефлюксом [30, 31, 34, 38]. В табл. 4 указаны основные препараты, применяемые для профилактики инфекции органов мочевой системы у детей раннего возраста.
При антибактериальной терапии рекомендуется применение десенсибилизирующих препаратов и препаратов, способствующих восстановлению микрофлоры кишечника [16].
Детям старше 1 года жизни, при отсутствии аллергических реакций, назначается курс противорецидивной фитотерапии.
При развитии интеркуррентных заболеваний показано проведение противорецидивного курса уроантисептиками и фитотерапии [8]. Однако в ходе многоцентрового рандомизированного контролируемого исследования влияния первичного пузырно-мочеточникового рефлюкса и антибактериальной профилактики обострений пиелонефрита на формирование нефросклероза, проведенного E.H. Garin и соавт. (2006), были получены противоречивые данные. При обследовании 218 детей в возрасте от 3 месяцев до 18 лет через год после первой атаки пиелонефрита было установлено, что пузырно-мочеточниковый рефлюкс легкой и средней степени не влиял на частоту обострений воспалительного процесса в мочевой системе и не способствовал формированию нефросклероза. Не было получено убедительных данных и о положительном влиянии антибактериальной профилактики обострений инфекции на частоту рецидивов заболевания и образование рубцов в почечной паренхиме [39].
При лечении пиелонефрита у детей раннего возраста необходимо учитывать, что почти в 70% случаев болезнь дебютирует хроническим циститом, нередко с латентным течением, в 49% случаев – нейрогенной дисфункцией мочевого пузыря по гипо- или гиперрефлекторному типу. В 45% случаев пиелонефрит развивается при пузырно-мочеточниковом рефлюксе и имеет затяжное или хроническое течение. При длительном или хроническом течении пиелонефрита в раннем возрасте рекомендуется проведение полного нефро-урологического обследования с целью выявления признаков функциональной или органической обструкции. УЗИ почек можно делать во время активности инфекционно-воспалительного процесса, при этом следует помнить, что нормальные результаты антенатальной сонографии не исключают наличия врожденных пороков развития органов мочевой системы. Микционная цистография и экскреторная урография проводятся не ранее, чем через 1–2 недели после стихания воспалительного процесса. Урографию можно проводить детям в возрасте не младше 3 недель. Если результаты обследования оказались отрицательными, рекомендуется исследование мочи на микоплазмы, уреаплазмы, хламидии с введением в терапию (при положительных результатах) антибиотиков из группы макролидов [28, 30]. Отметим, что идеального протокола для наблюдения детей после перенесенной инфекции органов мочевой системы нет. Так, к преимуществам «агрессивного протокола» (с проведением полного рентгеноурологического обследования) относят то, что с его помощью можно добиться высокого процента выявления пузырно-мочеточникового рефлюкса и предотвращения сморщивания почки, а к недостаткам – высокую стоимость и большую лекарственную нагрузку на пациента уросептиками [34].
Сократить риск возникновения инфекции мочевой системы у детей раннего возраста может помочь следование следующим правилам: 1) устранение расстройств мочеиспускания и запоров; 2) потребление адекватного количества жидкости; 3) режим принудительных мочеиспусканий.
Терапия обструктивного пиелонефрита проводится совместно с детским урологом. Решается вопрос о показаниях к оперативному вмешательству. Дети с пузырно-мочеточниковым рефлюксом I–II и III степени в течение многих лет подлежат консервативному ведению, основанному, главным образом, на длительной профилактике уросептиками. Мероприятия, направленные на нормализацию функции нижних мочевых путей, являются частью лечения больного с пузырно-мочеточниковым рефлюксом. В том числе проводится эндоскопическая коррекция пузырно-мочеточникового рефлюкса трансуретральным подслизистым введением различных материалов [40]. В последние годы показаниями к оперативному лечению пузырно-мочеточникового рефлюкса служат высокая степень рефлюкса (IV–V) и непрерывно-рецидивирующее течение пиелонефрита. Показанием к оперативному лечению в раннем возрасте считаются все виды обструктивных уропатий, приводящих к задержке созревания почечной ткани, развитию вторичного пиелонефрита, который может приводить к возникновению уросепсиса.
Необходимо учитывать, что в раннем возрасте пиелонефрит протекает при выраженной нестабильности цитомембран и дисметаболических нарушений, поэтому уже через 3–4 дня после начала антибактериальной терапии целесообразно совместное назначение нижеперечисленных антиоксидантов и мембраностабилизаторов курсом не менее месяца: 1) витамин Е 2 мг/кг 1 раз в сутки в дневное время; 2) витамин В6 1 мг/кг 1 раз в сутки в утреннее время; 3) Ксидифон (этидроновая кислота) 2%-ный раствор по 1 чайной ложке 3 раза в день перед едой; 4) Веторон (бета-каротин) по 1 капле на каждый год жизни.
Пробиотики применяются после окончания антибактериальной терапии, а специфические фаги – при длительном высевании однотипного возбудителя из кишечника и мочи.
Появление у детей неонатального периода, особенно у новорожденных с тяжелой перинатальной патологией, после реанимационного лечения даже малой грибковой инфекции (кожа, слизистые, грибы в моче) является показанием для назначения флуконазола в дозе 6 мг/кг для профилактики генерализации кандидозной инфекции. Наряду с этим следует проводить более углубленное обследование мочевой системы, включающее УЗИ почек и цистографию. Лечебные дозы флуконазола у новорожденных составляют 8–12 мг/кг/сут перорально или парентерально в течение 4–6 недель под контролем клинических и биохимических анализов крови, общих анализов мочи, результатов посева мочи [41].
Течение пиелонефритического процесса протекает наиболее благоприятно в случае ранней диагностики, адекватной терапии и в отсутствие грубых пороков развития почек (мультикистоза, поликистоза, гидронефроза). Так, по нашим данным, на фоне профилактических и лечебных мероприятий длительная клинико-лабораторная ремиссия пиелонефритического процесса наблюдалась у 76,5% пациентов с инфекцией органов мочевой системы [4, 10]. Проведение УЗИ почек детям начиная с рождения позволяет рано диагностировать пиелоэктазию, гипоплазию и начинающуюся гидронефротическую трансформацию почек. В дальнейшем выявленный по данным цистографии пузырно-мочеточниковый рефлюкс, на фоне которого развился пиелонефрит, подвергается лечению еще на первом году жизни.
Приведем план диспансерного наблюдения детей с инфекцией органов мочевой системы:
- Осмотры:
- педиатр – 1 раз в 1–2 месяца;
- нефролог – 1 раз в 3 месяца.
- Анализы мочи: клинический – 1 раз в 1 месяц и при интеркуррентных заболеваниях.
- Лечение вульвита, уретрита и др.
- Длительность наблюдения – 6 месяцев.
Ниже указана примерная схема диспансерного наблюдения детей с пиелонефритом:
- Осмотры:
- педиатр – 1 раз в месяц в течение первого года, далее – 1раз в 3 месяца;
- нефролог – 1 раз в 3 месяца в течение первого года, далее – 1 раз в 6 месяцев (при снижении почечных функций – 1 раз в 3 месяца);
- окулист – 1 раз в 6 месяцев.
- Анализы мочи:
- клинический – 1 раз в 10–14 дней в течение первых 6 месяцев, затем – 1 раз в месяц и при интеркуррентных заболеваниях;
- посев мочи – 1 раз в 3–6 месяцев;
- биохимическое исследование мочи – 1 раз в 6–12 месяцев.
- Анализы крови:
- клинический – 1 раз в 6 месяцев и при интеркуррентных инфекциях;
- биохимический – 1 раз в год.
- Ультразвуковое исследование почек и мочевого пузыря – по показаниям от 1 раза в месяц до 1 раза в 3–6 месяцев.
- Рентгеноурологическое обследование – по показаниям.
Основные пути оздоровления: режим, диета, этапный метод лечения, при интеркуррентных заболеваниях – курс уросептиков 5–7 дней.
Снятие с учета не ранее чем через 5 лет полной клинико-лабораторной ремиссии после обследования в нефрологическом стационаре.
Current overview of the urinary system infection in newborns and infants
O.L. Chugunova, M.V. Shumikhina, S.V. Dumova
State Budgetary Educational Institution for Higher Professional Education ‘Russian National Research Medical University named after N.I. Pirogov’ of the Ministry of Health of Russia, Moscow
Contact person: Olga Leonidovna Chugunova, ol_chugunova@mail.ru
In infants, many diseases, especially urinary system diseases, are characterized by atypical course due to morphological and functional immaturity of organs and systems. In newborns, rapid progression of inflammatory process is common resulting in tissues necrosis and sclerosis in kidneys and other organs. Nevertheless, in case of timely diagnosis and treatment, high tissues plasticity of newborns promotes complete recovery of lesions unless they are genetically based. In children aged from 2 months to 2 years with fever, urinary system infection should be always kept in mind (frequency about 5%) owing to the higher risk of kidney tissues involvement compared to older children. Antimicrobial therapy may be initiated immediately or after the urine culture results are ready. For the diagnosis, appropriate urine collection and culture are essential; clinical urinalysis is used for screening only. Diagnostic imaging is recommended in all children with urinary system infection. Indications for long-term antimicrobial prophylaxis in children with history of pyelonephritis but without changes in cystography and renal scintigraphy are disputable.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.