Рациональная терапия острой респираторной вирусной инфекции у новорожденных и детей первого года жизни
- Аннотация
- Статья
- Ссылки
- English
Введение
Исследования, посвященные проблеме острой респираторной вирусной инфекции (ОРВИ) у детей, актуальны и на современном этапе, поскольку разработка специфической противовирусной терапии и средств профилактики достаточно сложна в силу этиологической гетерогенности, высокой контагиозности возбудителей и изменчивости антигенных свойств вирусов [1, 2].
ОРВИ у новорожденных и детей раннего возраста представляет серьезную проблему из-за высокого риска развития осложнений, приводящих в ряде случаев к летальному исходу [2, 3].
Иммунный ответ у детей грудного возраста
Сниженные показатели иммунного ответа у детей грудного возраста – это защитный механизм от слишком бурных цитокиновых реакций. Часть пассивной защиты берет на себя материнский иммунитет посредством иммуноглобулинов, содержащихся в грудном молоке. Но этого бывает недостаточно. Развитие иммунной системы продолжается на протяжении всего периода детства. В процессе развития иммунной системы ребенка выделяют критические периоды, когда риск развития инфекционных заболеваний, связанных с недостаточностью функций иммунной системы, максимален [4, 5].
В процессе становления иммунитета у детей грудного возраста выделяют два критических периода. Первый – период новорожденности (до 29 дней жизни), когда организм ребенка защищен фактически только материнскими антителами, полученными через плаценту и с грудным молоком. Чувствительность новорожденного к бактериальным и вирусным инфекциям в этот период крайне высока. Все звенья иммунного ответа новорожденного существенно отличаются от таковых взрослых и детей старшего возраста.
Иммунный ответ в период новорожденности имеет свои особенности [6]:
1) врожденный иммунный ответ:
-
сниженная продукция интерферона (ИФН);
-
выработка несостоятельного, так называемого раннего ИФН-альфа;
-
склонность к незавершенному фагоцитозу;
-
слабая реакция на бактериальные антигены;
2) адаптивный иммунный ответ:
а) клеточное звено:
-
избыточный уровень супрессорных Т-клеток;
-
низкая цитотоксическая активность CD8+-лимфоцитов и естественных киллеров (NK-клеток);
-
сниженное число плазматических клеток при нормальном содержании В-лимфоцитов;
б) гуморальное звено:
-
отсроченный синтез антител;
-
циркуляция материнских иммуноглобулинов G (IgG) – до шести месяцев;
-
недостаточность IgA-синтезирующих плазматических клеток.
Группу повышенного риска развития инфекций среди новорожденных составляют недоношенные дети [7].
Второй критический период (четыре – шесть месяцев жизни) характеризуется утратой полученных от матери антител. Способность к продукции собственных антител ограничивается слабым синтезом только IgM. Недостаточность местной защиты слизистых оболочек связана с более поздним накоплением секреторного IgA. В связи с этим чувствительность ребенка ко многим воздушно-капельным и кишечным инфекциям в данный период очень высока.
Иммунитет у детей грудного возраста характеризуется:
-
восстановлением уровня IgM;
-
синтезом собственного IgG только к шести месяцам;
-
повышенным соотношением CD4+/CD8+-лимфоцитов;
-
относительной незрелостью Т-клеток;
-
низкой способностью к формированию клеток памяти;
-
относительным дефицитом IgA.
Иммунный ответ у новорожденных
Повышенное количество гранулоцитов в крови новорожденных в определенной степени компенсирует недостаточную активность их защитных функций. Хотя абсолютное количество моноцитов крови у новорожденных выше, чем у детей более старшего возраста, эти клетки крови также отличаются низкой защитной активностью. Низкое содержание основных компонентов системы комплемента в крови новорожденных становится причиной недостаточной вспомогательной активности сыворотки крови при фагоцитозе.
Таким образом, у новорожденных резко ослаблены основные механизмы неспецифической защиты организма от патогенных бактерий и вирусов. Именно этим объясняется высокая чувствительность новорожденных (особенно недоношенных и детей с задержкой внутриутробного развития) и детей первого года жизни к бактериальным и вирусным инфекциям.
Причины этиологической значимости вирусов в развитии патологии у детей
Согласно данным Роспотребнадзора, в 2014 г. ОРВИ переболело 20% населения Российской Федерации. Максимальные показатели заболеваемости были зарегистрированы в детской популяции. Надо заметить, что такая ситуация складывается на фоне увеличения охвата населения профилактическими прививками [8].
В связи с этим целесообразно выделить основные причины этиологической значимости вирусов в развитии патологии у детей [9]:
-
особенности созревания иммунной системы ребенка (достигает уровня развития взрослого человека к 10–12 годам);
-
высокая контагиозность вирусных инфекций;
-
нестойкий иммунитет к ряду возбудителей;
-
разнообразие вирусных сероваров;
-
феномены антигенного шифта и дрейфа, характерные для ряда вирусов (вирусы гриппа А и В);
-
подавляющее действие ряда вирусов на продукцию ИФН посредством блокирования ИФН-рецепторов.
Наиболее частыми возбудителями инфекций респираторного тракта (ОРВИ), протекающих с более или менее однотипными клиническими симптомами, прежде всего воспалением верхних дыхательных путей, являются вирусы парагриппа, респираторно-синцитиальный (РС) вирус, рино-, адено-, коронавирусы, а также недавно открытые бока- и метапневмовирус человека. Сходными свойствами обладают вирусы гриппа [10, 11].
Основные возбудители ОРВИ у детей представлены в таблице.
Метапневмовирус человека – РНК-парамиксовирус, открытый в 2001 г., имеет две антигенные подгруппы, инфицирует только человека и вызывает зимой и весной вспышки, совпадающие по времени с активизацией PC-вируса. К пятилетнему возрасту практически все дети имеют антитела к вирусу. Метапневмовирус часто выявляется вместе с другими вирусами. Инкубационный период – три – пять дней. Основные клинические проявления: ринит, бронхиолит, круп. С учетом высокой частоты смешанной инфекции роль каждого вируса оценить трудно.
Выбор терапии у новорожденных и детей первого года жизни
Все перечисленные аргументы, а именно несостоятельность иммунной системы, выраженное разнообразие и изменчивость возбудителей, высокая восприимчивость к инфекционным заболеваниям, в том числе ограниченное количество применяемых лекарственных препаратов, требуют взвешенного подхода к выбору терапии у новорожденных и детей первого года жизни. Лекарственные средства, применяемые для лечения ОРВИ в этой популяции, должны обладать доказанной эффективностью и благоприятным профилем безопасности.
В рутинной практике, выбирая рациональную терапию ОРВИ у детей, врачи учитывают следующие критерии:
-
ограниченный возрастной диапазон использования препаратов;
-
незрелость иммунной защиты;
-
невозможность своевременной этиологической диагностики;
-
изменчивость и резистентность респираторных вирусов;
-
большое число возбудителей ОРВИ при неспецифичности клинических проявлений.
Данные обстоятельства диктуют необходимость применения этиопатогенетически обоснованной неспецифической противовирусной и иммунной терапии.
Учитывая особенности реагирования иммунной системы в раннем детском возрасте и патогенез вирусных инфекций, можно определить основные принципы терапии ОРВИ:
-
этиотропные препараты (элиминация возбудителя);
-
патогенетические средства (дезинтоксикация, противовоспалительная терапия, повышение неспецифической защиты, купирование иммунодефицитного состояния, возникающего в результате течения респираторной инфекции, профилактика осложнений);
-
симптоматические средства (улучшение самочувствия пациента).
При этом этиотропная терапия, направленная на прекращение репликации возбудителя и его элиминацию из организма, должна быть одним из ключевых звеньев проводимого лечения.
Наиболее изученной группой иммуномодулирующих препаратов, разрешенных к применению у детей с рождения, признаны ИФН с выраженным противовирусным действием [12–14].
В период новорожденности (0–28 дней) в сыворотке крови циркулирует значительное количество «раннего» ИФН. От ИФН, синтезируемых клетками взрослого организма, «ранние» ИФН отличаются физико-химическими и, что особенно важно, биологическими свойствами. Они более гидрофобны, имеют сниженные противовирусные, антипролиферативные и иммуномодулирующие свойства. Однако именно быстрые ИФН-альфа вносят основной вклад в противовирусную защиту организма.
«Поздние» ИФН-гамма, начинающие работать через несколько часов после инфицирования, характеризуются менее выраженным противовирусным эффектом. Они играют роль основного связующего звена между компонентами врожденного и адаптивного иммунного ответа. У новорожденных в становлении противоинфекционной защиты организма участвует только гамма-звено интерфероновой защиты, активность которого в ряде случаев значительно снижена, особенно у недоношенных детей [15].
Сказанное во многом определяет рекомендации для использования ИФН при ОРВИ у детей раннего возраста. Противовирусный эффект и иммуномодулирующее влияние на клеточное и гуморальное звено иммунитета ИФН-альфа с успехом используются российскими педиатрами в клинической практике свыше 40 лет. Именно в России был разработан и внедрен в 1967 г. человеческий лейкоцитарный ИФН. Многие годы зарубежные исследователи отрицали, что ректальные или пероральные ИФН могут оказывать системное воздействие на иммунную систему пациента. В то же время в нашей стране с успехом применяли ректальные препараты ИФН. Однако в последние годы японскими учеными были проведены работы, результаты которых подтвердили клиническую эффективность ректальных и пероральных препаратов ИФН [16, 17]. В свете этого дальнейшее изучение терапевтических эффектов ИФН при вирусных инфекциях и разработка новых схем применения в детской практике приобретают еще большую актуальность.
Современные препараты рекомбинантного ИФН, созданные методом генной инженерии, в отличие от первого лейкоцитарного ИФН позволяют получить более высокое содержание чистого действующего вещества в лекарственной форме, исключают возможность передачи гемотрансфузионных нескринируемых инфекций, обеспечивают точность дозирования для нивелирования дозозависимых нежелательных реакций.
Механизм действия интерферонов
ИФН оказывают универсальное прямое противовирусное действие – индуцируют синтез фермента, останавливающего транскрипцию и трансляцию, а следовательно, репликацию вируса. Кроме того, ИФН:
-
усиливают фагоцитоз, повышают киллерный потенциал эффекторных клеток;
-
стимулируют продукцию секреторного IgA;
-
способствуют нормализации цитокинового баланса;
-
препятствуют заражению здоровых клеток.
ИФН также обладают опосредованным антибактериальным эффектом за счет иммуномодуляции [18].
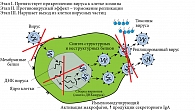
ИФН являются гуморальными факторами врожденного звена иммунитета. Быстрые ИФН 1-го типа, такие как ИФН-2-альфа, оказывают противовирусный эффект уже в первые часы после заражения. Их основная роль состоит в индукции синтеза белков, оказывающих прямое противовирусное действие на трех этапах: прикрепление вируса к мембранам клеток, синтез вирусных частиц и выход готовых вирионов из клетки [19] (рис. 1 и 2).
Кроме того, ИФН-2-альфа стимулирует активность эффекторных клеток, участвуя в запуске каскада адаптивного иммунитета и формировании долгосрочной иммунной защиты против герпесвирусной инфекции [20].
Генферон лайт – новая суппозиторная форма со сниженным содержанием рекомбинантного человеческого ИФН-альфа-2b
Российской фармацевтической компанией БИОКАД была разработана новая суппозиторная форма со сниженным содержанием рекомбинантного человеческого ИФН-альфа-2b Генферон лайт. В отличие от других детских суппозиторных форм в состав Генферона лайт вместо аскорбиновой кислоты, способствующей развитию оксалурии, входит таурин. Масло какао, широко используемое в качестве основы для приготовления свечей, заменено тугоплавким жиром, не вызывающим местных аллергических реакций. Таурин – незаменимая аминокислота, образующаяся в ходе метаболизма цистеина [21]. Таурин играет существенную роль в иммунном ответе при инфекционном процессе: обладает иммунотропным действием, противовоспалительной, антиоксидантной активностью, повышает устойчивость клеток к неблагоприятным условиям очага воспаления, предотвращает их гибель [22]. Таурин также способен потенцировать специфическое действие ИФН, что в целом обеспечивает повышение эффективности комбинированного лекарственного препарата. Как самостоятельное вещество таурин многие годы используется в офтальмологии, эндокринологии и неонатологии как антиоксидант [23, 24]. Кроме того, таурин оказывает регулирующее влияние на центральную нервную систему, что позволяет применять его в неврологической практике в комплексной терапии судорожного синдрома и минимальной мозговой дисфункции [25, 26].
В состав одного суппозитория препарата Генферон лайт, применяемого у детей от ноля до семи лет, входят ИФН-альфа-2b 125 000 МЕ и таурин 5 мг.
В состав одного суппозитория препарата Генферон лайт, применяемого у детей старше семи лет, входят ИФН-альфа-2b 250 000 МЕ и таурин 5 мг.
Генферон лайт применяется у детей с первых дней жизни, разрешен к использованию во время беременности (с 13-й недели), не содержит масло какао и витамин С. Схема применения в острый период инфекции – по одной свече два раза в день с интервалом 12 часов ежедневно в течение пяти дней [27].
В 2014 г. было проведено многоцентровое открытое сравнительное рандомизированное проспективное клиническое исследование эффективности и безопасности препарата Генферон лайт в дозе 125 000 МЕ и другого суппозиторного препарата ИФН-альфа в дозе 150 000 МЕ с антиоксидантами в лечении гриппа и других ОРВИ у новорожденных и грудных детей. Помимо оценки безопасности и эффективности проводимой терапии целью исследования было сопоставление двух разных доз ИФН-альфа. В исследовании участвовали 102 ребенка от ноля до шести месяцев [2] со среднетяжелыми формами ОРВИ различной локализации (преимущественно ринит, фарингит, бронхит). Дети основной группы получали препарат Генферон лайт 125 000 МЕ по схеме один суппозиторий два раза в сутки в течение пяти дней. Дети группы сравнения – препарат ИФН-альфа с антиоксидантами в дозе 150 000 МЕ по одному суппозиторию два раза в сутки в течение пяти дней. В ходе исследования оценивали динамику клинических и лабораторных показателей, характеризовавших течение ОРВИ у детей.
Результаты исследования показали, что количество детей, достигших реконвалесценции к пятому-шестому дню наблюдения, в основной группе, где Генферон лайт применялся в сниженной дозе, было сопоставимо и не имело статистически значимых различий с группой сравнения – более 90% в каждой группе.
В целом эффективность двух препаратов ИФН в купировании клинических симптомов ОРВИ у новорожденных и детей грудного возраста была аналогичной, несмотря на то, что суммарная доза рекомбинантного ИФН-альфа-2b в группе Генферона лайт была ниже на 16,7% [2].
Ректальное введение суппозиториев препарата Генферон лайт не вызывало местных и общих патологических реакций.
Таким образом, данные клинического исследования показали, что Генферон лайт характеризуется хорошей переносимостью и безопасностью при применении у детей в возрасте от ноля до шести месяцев, страдающих ОРВИ, что обеспечивает возможность применения данного препарата в педиатрической практике у новорожденных и детей первого года жизни.
Заключение
Применение препарата рекомбинантного ИФН-альфа-2b Генферон лайт патогенетически обосновано на разных стадиях течения ОРВИ у детей. Использование препарата Генферон лайт позволяет подобрать оптимальную дозу ИФН в зависимости от возраста и веса ребенка и избежать лишней лекарственной нагрузки.
Включение в состав суппозитория таурина, обладающего антиоксидантным свойством, исключает необходимость дополнительного применения витамина C, потенцирует и пролонгирует эффект ИФН, а также оказывает регулирующее действие на центральную нервную систему, что особенно важно у новорожденных и детей раннего возраста.
O.L. Chugunova, Ye.V. Melekhina
Russian National Research Medical University named after N.I. Pirogov
Central Research Institute of Epidemiology Russian Federal Service for Surveillance on Consumer Rights Protection and Human Wellbeing
Contact person: Olga Leonidovna Chugunova, ol_chugunova@mail.ru
The paper is dedicated to an issue of acute respiratory viral infection in newborns and children under one year by discussing etiology, pathogenesis, contributory causes, features of age-related clinical, early diagnostics and modern treatment tactics.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.