- своевременная и точная постановка диагноза, определение тяжести процесса;
- раннее выявление и, по возможности, устранение факторов, осложняющих течение инфекционно-воспалительного процесса в почке и/или снижающих эффективность антибиотикотерапии;
- собственно рациональная антибиотикотерапия.
В этой статье мы не будем подробно останавливаться на современных подходах к диагностике пиелонефрита. Отметим лишь, что помимо оценки клинических проявлений заболевания, которые общеизвестны, обязательными диагностическими тестами являются общий анализ крови и мочи, посев мочи и ультразвуковое исследование почек. Роль бактериологического исследования (посева) мочи при остром пиелонефрите трудно переоценить, поскольку этот метод позволяет не только подтвердить наличие мочевой инфекции, но и своевременно скорректировать антибиотикотерапию в случае, если эмпирически назначенный препарат оказался неэффективным. В соответствии с клиническими рекомендациями Европейской ассоциации урологов посев мочи также необходимо повторять у всех больных на 5–10-е сутки терапии пиелонефрита. При подозрении на сепсис показаны также исследование уровня прокальцитонина сыворотки крови и посев крови.
Нельзя не упомянуть, что в 2010 г. Международным консультативным советом по урологическим заболеваниям (ISUD) была представлена новая классификация инфекций мочевых путей (ИМП), позволяющая в значительной степени индивидуализировать диагноз. Эта классификация была впервые опубликована в монографии Urogenital infections в 2010 г. [1], а затем – в клинических рекомендациях Европейской ассоциации урологов 2011 г. [2], которые находятся в открытом доступе на сайте www.uroweb.org. Особое внимание в данной классификации уделяется индивидуальной оценке имеющихся у больного факторов риска, которые для удобства подразделены на несколько групп и указываются в диагнозе определенной буквой в соответствии со следующими критериями:
- O – факторов риска нет;
- R – есть факторы риска рецидивирования, но без риска тяжелого исхода;
- E – экстрагенитальные факторы риска с вероятным тяжелым исходом (например, сахарный диабет или иммуносупрессивное состояние);
- N – нефропатические факторы риска с вероятным тяжелым исходом (например, абсцесс почки или почечная недостаточность);
- U – корригируемые/изменяемые урологические факторы риска с вероятным тяжелым исходом (например, наличие конкрементов или обструкции мочевых путей);
- C – катетер-ассоциированные, или некорригируемые, урологические факторы риска (например, при наличии стентов или дренажей в мочевых путях).
Очевидно, что коррекция осложняющих факторов играет первостепенную роль в успешном лечении пациентов с инфекциями мочевых путей. Так, при нарушенном оттоке мочи у больного с пиелонефритом обязательным является срочное дренирование верхних мочевых путей, при формировании абсцесса – его дренирование пункционным или открытым способом, при декомпенсированном сахарном диабете – нормализация уровня глюкозы крови и т.д. Подчеркнем, что без подобного «купирования» осложняющих факторов значимо снижается вероятность выздоровления/выживания пациента, а также повышается риск неполной эрадикации возбудителя, что, в свою очередь, ведет к рецидивированию инфекционного процесса и появлению резистентных штаммов.
Собственно рациональная антибиотикотерапия представляется нам комплексным понятием. Оптимальное лечение антибиотиками, в отличие от лечения препаратами большинства других групп, должно не только обеспечивать выздоровление/выживание пациента, но и как минимум не повышать вероятности возникновения и распространения резистентных микроорганизмов. Следовательно, для выбора оптимального антимикробного препарата при остром пиелонефрите и/или уросепсисе необходимо знать основные характеристики уропатогенов и принципы формирования резистентной флоры, в особенности в условиях урологического стационара.
У госпитализированных больных возбудители ИМП можно условно разделить на 2 большие группы: негоспитальные (амбулаторные) микроорганизмы и госпитальные. Как известно, характеристики этих возбудителей имеют существенные отличия. Знание особенностей современных амбулаторных возбудителей ИМП особенно важно для врача урологического стационара, поскольку вызванные ими инфекции тяжелого и осложненного течения в подавляющем большинстве требуют обязательной госпитализации и стационарного, а порой и хирургического лечения. В отношении амбулаторных возбудителей ИМП московского региона, к сожалению, в настоящее время имеются единичные современные исследования.
Наиболее интересным и показательным представляется исследование В.В. Рафальского и соавт., проведенное в 2005 г. в Москве, которое показало, что основным возбудителем амбулаторных инфекций по-прежнему остается E. coli (72,5% случаев) [3]. При этом E. сoli являлась возбудителем неосложненных инфекций у 80,9% больных, а при наличии осложняющих факторов (мочекаменная болезнь, сахарный диабет) E. сoli идентифицирована только у 53% пациентов. При осложненных инфекциях статистически значимо чаще выявлялись P. aeruginosa (4,5% против 0%) и E. faecalis (9,1% против 4,2%).
Неосложненные инфекции нижних и верхних мочевых путей, вызванные E. сoli, характеризовались низкой резистентностью к фторхинолонам (6,3%), цефотаксиму (0%) и амоксициллину/клавуланату (6,3%). Немаловажно, что в ранее проведенных исследованиях (UTIAP 1 и UTIAP 2) устойчивость E. coli к фторхинолонам и ингибитор-защищенному амоксициллину не превышала 3%. У E. coli, вызвавшей ИМП с сопутствующими осложняющими факторами, устойчивость к антибактериальным препаратам была существенно выше и составила 16,3% у ципро-/норфлоксацина, 2,3% у цефотаксима и 14% у амоксициллина/клавуланата.
В настоящее время актуальность приобрела проблема распространения внебольничных штаммов E. coli (типа CTX-M), продуцирующих бета-лактамазы расширенного спектра (БЛРС) [4]. Важно осознавать, что обычные схемы лечения неосложненных ИМП оказываются неэффективными в случае, если возбудителем инфекции является БЛРС-продуцирующий микроорганизм, что существенно повышает риски тяжелого и/или осложненного течения заболевания и госпитализации. Так, по данным C. Qi и соавт., с 2003 по 2008 г. в Чикаго отмечено увеличение доли БЛРС-продуцирующей E. сoli у амбулаторных урологических пациентов с 0,21% до 2,99%, то есть более чем на порядок [5]. В то же время данные опубликованного в 2007 г. метаанализа свидетельствуют о том, что относительный риск смертности у больных c бактериемией, вызванной БЛРС-продуцирующими штаммами Enterobacteriaceae (по отношению к бактериемии не-БЛРС-продуцентами), составляет 1,85, то есть, другими словами, от бактериемии, вызванной БЛРС-продуцирующим возбудителем, умирают почти в 2 раза чаще [6].
Ряд работ позволил установить факторы риска инфицирования БЛРС-продуцирующими Enterobacteriaceae. Так, D.L. Paterson и соавт. обнаружили корелляцию с предыдущим введением оксиимино-бета-лактам-содержащих антибиотиков (цефуроксима, цефотаксима, цефтриаксона, цефтазидима, азтреонама), связанным с бактериемией БЛРС-продуцентами [7]. По данным J. Rodríguez-Baño и соавт. [8], вероятность инфицирования БЛРС-продуцентами выше у больных, ранее находившихся в лечебных учреждениях, подвергавшихся катетеризации, принимавших фторхинолоны или бета-лактамные антибиотики, а также у пациентов с сахарным диабетом, терминальными или тяжелыми сопутствующими заболеваниями. Другое исследование J. Rodríguez-Baño и соавт. [9] в то же время показало, что у пациентов с БЛРС-продуцирующими возбудителями ИМП, получавших эмпирическую терапию карбапенемами, смертность была ниже, чем среди пациентов, исходно принимавших цефалоспорины и фторхинолоны.
Особенности современных госпитальных возбудителей инфекций мочевых путей, и в частности острого пиелонефрита, представляют особый интерес, поскольку эти уропатогены способны вызывать наиболее тяжелые и трудноизлечимые формы болезни. По данным клиники урологии им. Р.М. Фронштейна Первого МГМУ им. И.М. Сеченова за 2010 г., ведущими возбудителями госпитальных инфекций мочевых путей являются Enterobacteriaceae (E. coli, Klebsiella spp. и др.) – 44%, Enterococcus – 27,2% и неферментирующие грамотрицательные бактерии (P. aeruginosa, Acinetobacter spp.) – 13,6%. Госпитальные уропатогены в настоящее время характеризуются:
- высокой распространенностью P. aeruginosa (до 10%);
- устойчивостью P. aeruginosa к фторхинолонам (по нашим данным, около 70%);
- ростом устойчивости P. aeruginosa к карбапенемам (по нашим данным, до 40%);
- наличием Enterobacteriaceae с БЛРС-продуцентами (до 50%), соотвественно, устойчивыми ко всем цефалоспоринам;
- устойчивостью Enterobacteriaceae к фторхинолонам (более 50%);
- устойчивостью БЛРС-продуцентов Enterobacteriaceae к фторхинолонам (около 90%).
Теперь, когда нам стал известен ряд закономерностей формирования неблагоприятного профиля возбудителей мочевых инфекций в стационаре, следует признать, что представленные характеристики госпитальных уропатогенов свидетельствуют о нерациональном использовании антибактериальных препаратов ранее. Рассмотрим, каковы же эти закономерности и пути коррекции неоптимальной эпидемиологической ситуации с уропатогенами в стационаре.
Исследования E. Lautenbach и соавт. (2001) [10] и M.F. Lin и соавт. (2003) [11] выявили прямую зависимость между частотой использования цефалоспоринов III поколения и распространением в урологическом стационаре Enterobacteriaceae (E. coli, Klebsiella spp.), продуцирующих БЛРС и устойчивых ко всем цефалоспоринам и к некоторым другим классам антибиотиков, например, к фторхинолонам. Работы J.E. Patterson и соавт. (2000) [12] и C.A. Lesch и соавт. (2001) [13] также убедительно доказали, что снижению частоты выделения БЛРС-продуцентов в стационаре способствует ограничение использования цефалоспоринов III поколения для эмпирической терапии. В то же время в исследовании M.F. DiNubile и соавт. (2005) [14] было показано, что использование эртапенема, в отличие от цефалоспоринов III поколения, не сопровождается селекцией БЛРС-продуцирующих Enterobacteriaceae.
В настоящее время карбапенемы обладают почти 100% эффективностью в отношении БЛРС-продуцентов [15], что уже сейчас привело к широкому применению в стационарах различных препаратов этой группы у больных острым пиелонефритом. Однако нельзя не упомянуть и о другой негативной тенденции, отмеченной у современных госпитальных возбудителей ИМП, а именно о существенном росте распространенности в стационарах (по нашим данным, до 40%) P. aeruginosa с устойчивостью к ранее активным по отношению к ней карбапенемам (имипенему, меропенему и дорипенему).
Принимая во внимание результаты приведенных исследований, можно без преувеличения сказать, что эртапенем (Инванз) является уникальным препаратом как с точки зрения высокой эффективности по отношению к Enterobacteriaceae (включая БЛРС-продуцентов!), так и по способности «сберегать» антисинегнойную активность карбапенемов резерва (имипенема, дорипенема и меропенема). Таким образом, при выборе эмпирической антибиотикотерапии больным с ИМП в стационаре чрезвычайно важно оценить, во-первых, риск наличия БЛРС-продуцентов, а во-вторых – вероятность инфицирования P. aeruginosa. Исходя из этого, при выборе антибиотика при ИМП целесообразно руководствоваться следующими принципами.
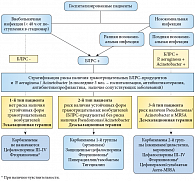
- При отсутствии факторов риска (нет предыдущих контактов с лечебными учреждениями, антибиотикотерапия ранее не проводилась, молодой возраст, нет серьезных сопутствующих заболеваний) препаратами выбора для стартовой эмпирической терапии являются цефалоспорины III поколения, фторхинолоны и комбинация цефалоспоринов II поколения с аминогликозидом.
- При наличии у больного факторов риска БЛРС-продуцентов, таких как контакты с лечебными учреждениями (уход на дому, недавняя госпитализация без проведения инвазивных процедур), недавно проводившаяся антибиотикотерапия (в особенности фторхинолонами или цефалоспоринами), пожилой возраст или значимые сопутствующие заболевания (например, сахарный диабет) препаратом выбора является карбапенем без антисинегнойной активности – эртапенем (Инванз).
- При наличии у больного факторов риска инфицирования P. aeruginosa, Acinetobacter spp., в частности при длительной госпитализации или инвазивных урологических процедурах, операций в анамнезе, отсутствии эффекта от антибиотикотерапии, тяжелом состоянии пациента, наличия дренажей или катетеров, операции и/или пребывании в отделении реанимации и интенсивной терапии, препаратами выбора для эмпирической терапии являются карбапенемы 2-й группы – имипинем/циластатин (Тиенам) или меропенем (Меронем).
Подробный алгоритм подбора эмпирической антибиотикотерапии у больных, госпитализированных по поводу острой инфекции верхних мочевых путей, представлен на рисунке 1.
Заключение
Во всем мире, включая Россию, отмечается рост резистентности возбудителей ИМП за счет:
- Enterobacteriaceae (E. coli, Klebsiella spp.), продуцирующих БЛРС (включая внебольничные инфекции);
- Enterobacteriaceae и P. aeruginosa с резистентностью ко фторхинолонам;
- P. aeruginosa, устойчивой к карбапенемам.
Представленные данные указывают на связь неадекватной антибиотикотерапии инфекций с увеличением смертности из-за роста резистентности. Понимание этих закономерностей должно определять выбор препарата для эмпирической терапии ИМП с учетом известных факторов риска резистентности микроорганизмов. Такой подход позволяет не только эффективно лечить больных острым пиелонефритом и/или уросепсисом, но и предотвращать рост резистентности возбудителей ИМП.