Современные возможности эндоскопической диагностики целиакии: от макроскопических признаков до искусственного интеллекта
- Аннотация
- Статья
- Ссылки
- English
Введение
Целиакия, ранее считавшаяся редким заболеванием с исключительно детской манифестацией, в настоящее время признана достаточно распространенной патологией с популяционной частотой около 1%. Современные эпидемиологические данные свидетельствуют о возможности дебюта клинических проявлений в любом возрастном периоде, включая пожилой возраст [1]. Основные подходы к диагностике уточнены и оформлены в согласительных документах и клинических рекомендациях профильных сообществ [2, 3]. Тем не менее заболевание по-прежнему остается недодиагностированным, прежде всего в группах так называемой неклассической или бессимптомной целиакии, не только ввиду слабой выраженности или неспецифичности кишечных симптомов, но и в силу отсутствия настороженности узких специалистов в отношении внекишечных проявлений, которые могут превалировать в клинической картине или же быть единственным симптомом заболевания. В то время как своевременная диагностика и одномоментный переход на безглютеновый рацион в большинстве случаев позволяют добиться быстрого регресса симптомов и восстановления слизистой тонкого кишечника. Повысить выявляемость целиакии при малосимптомном или «неклассическом» течении могла бы более детальная оценка врачом-эндоскопистом комплекса визуальных признаков заболевания с обязательной биопсией у пациентов, обратившихся для проведения рутинного эндоскопического исследования по поводу диспепсии или для скрининга.
Клинические проявления
Целиакия рассматривается как постоянная иммуноопосредованная реакция на глютен, содержащийся в пшенице, ячмене и ржи [4]. Первоначально целиакия считалась однородным заболеванием с клиническими проявлениями поражения желудочно-кишечного тракта, проявляющимися прежде всего симптомами мальабсорбции – диареей, стеатореей, задержкой роста и потерей веса. Такая клиническая картина глютеновой энтеропатии исторически описывалась в литературе как «типичная», а нарушения со стороны других органов и систем – как «атипичная» целиакия. Сегодня целиакия уже не рассматривается как изолированное кишечное расстройство, скорее, как заболевание, имеющее широкий спектр клинических проявлений, когда в патологический процесс может вовлекаться практически любой орган или система организма. И несмотря на то что диарея и вздутие живота продолжают рассматриваться как типичные симптомы целиакии, большинство пациентов имеют другие, не гастроинтестинальные проявления, такие как остеопороз, анемия, бесплодие, частая головная боль и мигрень, нейропсихиатрические симптомы или необъяснимое повышение уровня печеночных ферментов [5–10]. Частота встречаемости данных признаков в совокупности превосходит частоту встречаемости диареи как основного симптома целиакии, что логично привело к смене терминологии. Целиакия не рассматривается более как типичная и атипичная, но определяются ее классическая и неклассическая формы. Отсутствие какого-либо характерного клинического симптома целиакии обусловливает комплексный подход в диагностике данного заболевания, включая серологические тесты и гистологический анализ биоптатов тонкого кишечника у лиц с признаками или симптомами, подозрительными на целиакию. За прошедшие годы было выявлено несколько серологических маркеров целиакии, обладающих различной диагностической точностью, но только три из них – антитела к тканевой трансглутаминазе, антиэндомизиальные и антитела к деамидированным пептидам глиадина в настоящее время оцениваются в повседневной клинической практике [11]. Сывороточный иммуноглобулин A (IgA) к тканевой трансглутаминазе признан как наиболее чувствительный тест и рекомендован в качестве скринингового маркера в международных и отечественных руководствах [12]. Антиэндомизиальные антитела IgA, почти на 100% специфичные для целиакии, менее чувствительны, дороги и более зависимы от оператора, что делает данный маркер идеальным тестом второй линии серологической диагностики [13]. Диагностическая ценность антител класса IgА к тканевой трансглутаминазе и эндомизию резко ограничена у пациентов с сопутствующим дефицитом общего IgA, в связи с чем требуется изучение у данной группы пациентов соответствующих антител класса IgG. Кроме того, до 2% пациентов с целиакией вообще не имеют циркулирующих серологических маркеров чувствительности к глютену, что определяется как серонегативная целиакия [14]. Все диагностические серологические исследования должны проводиться у пациентов, находящихся на диете, содержащей глютен. Генетическое исследование предполагает выявление наличия у пациента характерных аллелей HLA-DQ2/DQ8. Отрицательный результат генетического типирования имеет высокую прогностическую ценность, позволяя с высокой долей вероятности исключить целиакию. До 40% здорового населения имеют гаплотипы HLA-DQ2/DQ8, поэтому генетическое типирование может быть использовано только для исключения целиакии в сложных диагностических случаях и не может применяться в качестве скринингового метода диагностики [15]. В то же время показана потенциальная роль и редких комбинаций аллелей, что еще больше снижает прогностическую ценность данного метода диагностики [16]. Серологический скрининг позволяет выявлять людей с атипичными или едва заметными симптомами или даже бессимптомные случаи. Но из-за разнообразных клинических проявлений целиакии пациенты могут обращаться к другим специалистам, помимо гастроэнтерологов и педиатров, в том числе и для проведения рутинного эндоскопического исследования. И в этой ситуации нацеленность врача-эндоскописта на выявление минимальных/характерных макроскопических проявлений глютеновой энтеропатии может стать основой для ранней диагностики заболевания.
Эндоскопическая диагностика
Современная эндоскопическая диагностика занимает важное место в выявлении макроскопических изменений тонкого кишечника, характерных для целиакии. Совершенствование методов эндоскопической визуализации позволило определить комплекс визуальных признаков заболевания, обладающих высокой диагностической значимостью по показателям чувствительности и специфичности.
Исторически первый макроскопический признак целиакии – исчезновение складок тонкой кишки – был идентифицирован почти 100 лет назад, в 30-х годах XX века, при помощи контрастной рентгенографии [17]. Однако качественный прорыв в диагностике заболевания произошел лишь с внедрением эндоскопических методов, позволивших осуществлять прямую визуализацию слизистой оболочки и выполнять прицельный забор биопсийного материала из двенадцатиперстной кишки (ДПК) для морфологической верификации диагноза. Первыми описанными эндоскопическими признаками целиакии были фестончатость и исчезновение складок ДПК [18].
За время изучения целиакии диагностические подходы претерпели значительные изменения. Первоначально всем пациентам с неспецифическими гастроинтестинальными жалобами выполняли дуоденальную биопсию во время эндоскопического исследования, однако впоследствии такой подход был признан неоптимальным. Исследование M.T. Bardella и соавт. продемонстрировало низкую диагностическую значимость рутинной биопсии ДПК у пациентов с диспепсией: атрофия ворсинок была выявлена лишь в 0,5% случаев (трое из 517 пациентов) [19]. Сходные результаты были получены в другом исследовании, где рутинная дуоденальная биопсия позволила подтвердить диагноз целиакии только у 0,7% из 5347 пациентов с диспепсией и у 0,6% из 2974 пациентов с симптомами рефлюкса [17]. На основании полученных данных рутинное проведение дуоденальной биопсии у пациентов с неспецифическими желудочно-кишечными симптомами и низкой априорной вероятностью целиакии было признано нецелесообразным ввиду низкой диагностической эффективности и высоких экономических затрат.
Современные эндоскопические критерии целиакии включают такие структурные изменения, как атрофия слизистой (с визуализацией подслизистого сосудистого рисунка), мозаичный или микронодулярный рельеф, наличие трещин (линейных углублений между складками), уменьшение или полное исчезновение складок, а также уплощение или фестончатость складок Керкринга. Для каждого из этих признаков установлены соответствующие показатели чувствительности и специфичности [20]. Наиболее характерные изменения, как правило, локализуются в нисходящем отделе ДПК, тогда как патологические изменения в луковице описаны менее детально и оцениваются в меньшей степени в диагностических алгоритмах [19].
Следует отметить, что наблюдаемые макроскопические изменения слизистой оболочки не являются патогномоничными для целиакии и могут встречаться при других патологических состояниях. К их числу относятся: инфекционные заболевания (синдром избыточного бактериального роста (СИБР), ВИЧ-ассоциированная энтеропатия, лямблиоз); медикаментозные воздействия (прием олмесартана, микофенолата мофетила, метотрексата); аутоиммунные процессы (аутоиммунная энтеропатия, болезнь Крона); другие нозологии (тропическая спру, коллагеновая спру, общий вариабельный иммунодефицит, неклассифицированная спру) [21]. Таким образом, интерпретация эндоскопической картины требует дифференциального подхода с учетом возможных альтернативных диагнозов.
Что касается диагностической эффективности каждого маркера в отдельности, по данным ряда исследований, наиболее надежными признаками целиакии являются зубчатый вид складок, мозаичность (узловатость) слизистой и вид исчерченности, трещин слизистой оболочки. Высокая диагностическая точность указанных признаков заставила некоторых авторов сделать вывод о том, что их отсутствие исключает диагноз целиакия [22].
Среди эндоскопических маркеров целиакии наименьшей диагностической надежностью обладает уменьшение или полное исчезновение складок в дистальном отделе ДПК. Как продемонстрировали S. Niveloni и соавт., согласованность в оценке данного признака между эндоскопистами оказалась существенно ниже (каппа = 0,41), чем для таких критериев, как мозаичный рисунок слизистой (каппа = 0,76) или фестончатость складок (каппа = 0,83) [23]. Эти данные согласуются с результатами исследования H. Reyes и соавт., подтвердившего, что изолированное выявление уменьшения дуоденальных складок при отсутствии других характерных эндоскопических признаков не может служить достоверным диагностическим критерием целиакии [24].
Помимо классических эндоскопических признаков целиакии описаны поражения слизистой луковицы ДПК в виде красных пятен, которые представляют собой небольшие, дискретные «красные пятна» без явных изменений окружающей слизистой. По сравнению с известными эндоскопическими маркерами целиакии поражения в виде «красных пятен» имели сопоставимую чувствительность, специфичность, положительную прогностическую ценность и отрицательную прогностическую ценность 31, 94, 80 и 64% соответственно [25].
При эндоскопической диагностике целиакии специалисты сталкиваются с существенными диагностическими ограничениями, поскольку макроскопические изменения слизистой оболочки часто отсутствуют при начальных стадиях заболевания (гистологические изменения Marsh 1–2) и могут быть минимально выражены даже при частичной атрофии ворсин (Marsh 3a). Более того, неравномерное распределение патологических изменений по слизистой ДПК дополнительно снижает чувствительность визуальной оценки. Соответственно, нельзя в полной мере полагаться только на визуальные данные, а стратегия отказа от биопсии при нормальном виде ДПК пока не может быть принята [26]. Гистологическое исследование остается обязательным компонентом диагностического алгоритма при любом клиническом подозрении на целиакию, независимо от наличия или отсутствия эндоскопических маркеров заболевания.
Тем не менее распознавание эндоскопических маркеров целиакии остается важным. Согласно недавнему исследованию, почти у 10% пациентов с впервые установленным диагнозом целиакии в течение пяти лет, предшествующих верификации заболевания, проводилось как минимум одно эндоскопическое исследование, в ходе которого не были обнаружены характерные изменения слизистой оболочки и не осуществлялся забор биоптатов [27]. Вероятно, у части этих пациентов присутствовали эндоскопические признаки целиакии, которые остались нераспознанными во время исследования, что могло способствовать отсроченной диагностике заболевания [28]. Кроме того, документирование наличия данных маркеров при эндоскопическом исследовании может играть важную роль в разрешении диагностических противоречий между результатами серологических и гистологических методов исследования.
Современные эндоскопические методики позволяют повысить точность визуализации признаков целиакии. Одним из широко используемых подходов является метод водной иммерсии, который заключается в заполнении просвета тонкого кишечника водой. Данная методика отличается простотой выполнения, безопасностью и отсутствием дополнительных финансовых затрат. Техника проведения включает аспирацию воздуха с последующим введением 90–150 мл воды в просвет ДПК. Это обеспечивает оптическое увеличение, улучшающее детализацию рельефа слизистой оболочки и визуализацию атрофии ворсинок. Процедура увеличивает длительность эндоскопии всего на 25–30 секунд по сравнению со стандартным исследованием. Метод водной иммерсии обладает значительным диагностическим потенциалом: повышает точность визуализации атрофических изменений, что может сократить количество необходимых биопсий; и, благодаря высокой специфичности метода, позволяет избежать биопсии у пациентов с высокой предтестовой вероятностью целиакии и эндоскопически подтвержденной полной атрофией ворсинок [29].
Следует отметить, что из-за простоты и быстроты выполнения, а также из-за высокой надежности методики в оценке ворсинок ДПК метод водной иммерсии потенциально может использоваться в качестве рутинной процедуры во время традиционной эндоскопии верхних отделов желудочно-кишечного тракта. В проспективном исследовании 396 пациентов с диспепсией чувствительность, специфичность, положительная и отрицательная прогностическая ценность метода водной иммерсии для выявления атрофии ворсинок составили 90,9; 99,5; 83,3 и 99,7% соответственно [30].
Хромоэндоскопия
Хромоэндоскопия с использованием различных красителей широко используется и доказала свою эффективность (для улучшения визуализации различных патологических изменений слизистой верхних и нижних отделов желудочно-кишечного тракта) прежде всего в диагностике ранних неоплазий и предраковых состояний, однако ее эффективность в диагностике целиакии остается недостаточно изученной. Имеющиеся данные демонстрируют противоречивые результаты: исследование S. Niveloni и соавт. показало, что применение метиленового синего не обеспечивает преимуществ в визуализации изменений слизистой по сравнению со стандартной эндоскопией [23]. В противоположность этим данным M.W. Bonatto и соавт. разработали эндоскопическую классификацию, основанную на использовании 0,5% раствора индигокармина с увеличением, что позволило улучшить визуализацию атрофии ворсинок. Авторы продемонстрировали повышение уровня соответствия между эндоскопическими и гистологическими заключениями при применении данной методики [31]. Эти противоречивые результаты указывают на необходимость дальнейших исследований для определения: оптимальных красителей для хромоэндоскопии при целиакии; стандартизированных протоколов визуализации; объективных критериев интерпретации полученных данных.
Особый интерес представляет интеграция хромоэндоскопии с технологиями оптического увеличения и цифровой обработки изображений, что может существенно повысить диагностическую эффективность при целиакии. В исследовании P. Iovino и соавт. оценивали диагностическую точность увеличительной эндоскопии и хромоэндоскопии с индигокармином у пациентов с трудной диагностикой (несогласованные результаты серологических тестов и/или влияние безглютеновой диеты, начатой до постановки диагноза целиакии). Была показана высокая точность диагностики целиакии (площадь под ROC = 0,99), в группе со сложной диагностикой точность эндоскопии была ниже (площадь под ROC = 0,83), но она увеличилась после исключения результатов пациентов с целиакией на безглютеновой диете (площадь под ROC = 0,88) [32].
Технологии улучшенного изображения
Современные технологии улучшенного изображения активно применяются в эндоскопической диагностике патологий желудочно-кишечного тракта, включая целиакию. Наиболее изученной является узкоспектральная визуализация NBI (Narrow Band Imaging), однако в клинической практике также используются и другие методы, такие как i-SCAN и FICE, эффективность которых подтверждена рядом исследований.
NBI обычно используется для оценки полипов, пищевода Барретта и раннего рака желудка. Однако ее редко используют для оценки слизистой оболочки ДПК за пределами экспертных центров и клинических исследований. Технология NBI обеспечивает высокую контрастность изображения благодаря избирательному взаимодействию света с тканями: излучение определенной длины волны отражается слизистой оболочкой, но поглощается гемоглобином в сосудах, что подчеркивает их архитектонику. Многочисленные исследования подтверждают диагностическую значимость данного метода, особенно в дифференциации неопластических и доброкачественных поражений желудочно-кишечного тракта. Именно искажение микроструктуры и сосудистого рисунка слизистой ДПК, наблюдаемое при различной степени атрофии ворсинок, имеет потенциал для оптической диагностики целиакии даже на ранних стадиях. В метаанализе было показано, что NBI имеет суммарную чувствительность 93% (95%-ный доверительный интервал (95% ДИ) 81–98%) и суммарную специфичность 95% (95% ДИ 92–98%) для обнаружения атрофии ворсинок [28].
Предварительные исследования современных систем виртуальной хромоэндоскопии демонстрируют их потенциальную эффективность в диагностике целиакии: система Fujinon Intelligent Chromo Endoscopy (FICE) в сочетании с оптическим увеличением показала 100% точность в оценке структуры кишечных ворсин; технология i-SCAN (Pentax Medical, Япония) продемонстрировала высокую диагностическую ценность при выявлении полной атрофии ворсинок [33, 34]. Однако следует отметить, что полученные результаты требуют сторонней валидации. В настоящее время отсутствуют исследования, подтверждающие воспроизводимость этих данных, необходимы масштабные клинические испытания для оценки диагностической эффективности технологий в рутинной практике.
Эндоскопия с увеличением
Новое поколение эндоскопических инструментов – эндоскопы с увеличением (или «зумом») – может обеспечить увеличенные изображения (до 100–135 раз) с высоким разрешением, улучшая детализацию по сравнению с обычной эндоскопией. В нескольких исследованиях оценивали роль эндоскопии с увеличением в диагностике целиакии. Первое исследование, в котором сообщалось о точности эндоскопического увеличения для обнаружения атрофии ворсинок, показало впечатляющие результаты с чувствительностью 95% и специфичностью 99% [30]. В другом исследовании эндоскопия с увеличением имела более высокую чувствительность в обнаружении атрофии ворсинок по сравнению с эндоскопией с высоким разрешением в белом свете (86,4% в сравнении с 78,4%, p = 0,0005) [35].
Роль увеличительной эндоскопии в сочетании с водной иммерсией в диагностике целиакии была проанализирована в рамках исследования R. Badreldin и соавт.: чувствительность составила 90,7%, специфичность – 62,9%, положительная прогностическая ценность – 83% и отрицательная прогностическая ценность – 77,2% для диагностики любой степени атрофии ворсинок [36]. G. Cammarota и соавт. исследовали сочетание эндоскопии с увеличением и техники водной иммерсии у пациентов с подозрением на заболевание ДПК, показав 100% соответствие с морфологическими заключениями для верификации отсутствия или наличия ворсинок. Чувствительность, специфичность, положительная прогностическая ценность и отрицательная прогностическая ценность для обнаружения полной атрофии ворсинок составили 100%, но цифры были значительно ниже для диагностики частичной атрофии ворсинок и нормальных ворсинок [30].
Современные исследования демонстрируют высокий потенциал компьютерного анализа эндоскопических изображений для диагностики различных заболеваний, включая целиакию. A. Molder и соавт. применили алгоритмы машинного обучения и глубокого обучения для диагностики целиакии на основании эндоскопических признаков. При использовании морфологической диагностики в качестве стандарта была отмечена высокая диагностическая точность для всех протестированных алгоритмов, при этом многослойная сверточная нейронная сеть имела наилучшую производительность с чувствительностью 99,67% и положительной прогностической ценностью 98,07% [37].
Клиническое наблюдение
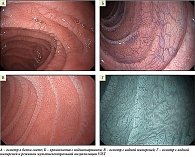
Пациентка 35 лет обратилась с жалобами на хроническую диарею до четырех раз в сутки, выраженный метеоризм. Жалобы имели стойкий рецидивирующий характер, сохранялись, несмотря на многократные курсы антибактериальных препаратов, полиферментов и энтеросорбентов. Гинекологический анамнез: привычное невынашивание беременности – наблюдалась у репродуктолога, проводилась подготовка к ЭКО. По результатам ранее выполненного обследования: фекальный кальпротектин – в пределах нормы, видеоколоноскопия – без органической патологии, диагностирован СИБР в тонком кишечнике (положительный водородно-метановый дыхательный тест). В рамках обследования перед ЭКО выполнена эзофагогастродуоденоскопия. Эндоскопические находки: пищевод и желудок без грубой органической патологии, луковица ДПК – узловатая трансформация слизистой, уплощение складок. Постбульбарные отделы ДПК: выраженный мозаичный рисунок слизистой, субэпителиальные линейные борозды, сглаживание складок. При VIST-визуализации: редукция ворсинок, расширение межворсинчатых пространств (рисунок). С учетом выявленных эндоскопических маркеров, характерных для глютеновой энтеропатии, выполнена мультифокальная биопсия слизистой ДПК. Получено морфологическое заключение: фрагменты слизистой оболочки ДПК с субтотальной атрофией ворсинок и очаговым удлинением крипт, что имеет сходство со структурой слизистой оболочки толстой кишки, сетчатым и мелкоочаговым склерозом, очагово-диффузной, местами густой лимфоцитарно-плазмоцитарной инфильтрацией собственной пластинки слизистой с примесью умеренного числа сегментоядерных лейкоцитов с преобладанием эозинофилов. Отмечается выраженное увеличение числа межэпителиальных лимфоцитов (более 40 на 100 эпителиоцитов). Заключение: гистологическая картина не противоречит диагнозу целиакии, стадия Marsh 3С.
По результатам лабораторного обследования выявлены характерные серологические маркеры целиакии, включая повышенные титры антител к тканевой трансглутаминазе (классов IgA и IgG). Параллельно обнаружены лабораторные признаки латентного железодефицита.
Данное клиническое наблюдение иллюстрирует существующие сложности диагностики целиакии у взрослых пациентов, обусловленные значительным полиморфизмом клинических проявлений данного заболевания. У пациентки отмечается клинический парадокс: при относительно умеренной гастроинтестинальной симптоматике наблюдались серьезные системные последствия в виде репродуктивной дисфункции. Это соответствует современным данным о существовании «молчащих» форм целиакии, при которых кишечные проявления минимальны (вздутие, нерегулярный стул), внекишечные симптомы доминируют (в данном случае – акушерская патология), отсутствуют классические признаки мальабсорбции. Также не была дана должная клиническая оценка СИБР, который стал «диагностической ловушкой»: выявленный избыточный бактериальный рост был, по-видимому, вторичным на фоне моторных нарушений и изменений кишечного микробиоценоза, характерных для целиакии.
Данный клинический случай подчеркивает необходимость междисциплинарного взаимодействия гастроэнтерологов и гинекологов для своевременной диагностики целиакии. Раннее выявление заболевания могло быть достигнуто при комплексной оценке клинико-анамнестических данных, целенаправленном применении современных серологических и инструментальных методов исследования, а также при соблюдении принципов преемственности в ведении пациенток с сочетанной гастроэнтерологической и репродуктивной патологиями.
Заключение
Целиакия продолжает оставаться сложной диагностической проблемой в гастроэнтерологии. Отсутствие патогномоничных симптомов и сходство с другими гастроэнтерологическими заболеваниями обусловливают комплексный подход, включающий спектр серологических тестов и морфологическое исследование слизистой тонкого кишечника. Эндоскопия с биопсией играют решающую роль в диагностике заболевания. Современные эндоскопические методики – технологии контрастного усиления и увеличения – повышают диагностические возможности визуальной оценки тонкого кишечника и точность получения биопсийного материала, что особенно важно в случаях минимальных/мозаичных изменений слизистой. Дальнейшее совершенствование эндоскопических технологий и внедрение алгоритмов машинного обучения помогут сократить время постановки диагноза и улучшить прогноз пациентов с целиакией.
Авторы заявляют об отсутствии конфликта интересов.
S.V. Shchelochenkov, PhD, I.V. Egorova, PhD, D.S. Bordin, PhD, Prof., Е.A. Sabelnikova, PhD, Prof. S.N. Beldiev, PhD
Immanuel Kant Baltic Federal University, Kaliningrad
Omsk State Medical University
Tver State Medical University
A.S. Loginov Moscow Clinical Scientific Center
Russian University of Medicine, Moscow
Contact person: Sergey V. Shchelochenkov, workmedbox@gmail.com
Celiac disease, the prevalence of which reaches 1% in the population, can be manifested at any age, including elderly patients. Despite the developed clinical guidelines and consensus documents, the disease often remains unrecognized for a long time, which is due to both the nonspecificity of clinical manifestations and insufficient alertness of doctors regarding extraintestinal symptoms. At the same time, timely diagnosis and prescription of the gluten-free diet contribute to a rapid improvement in patient’s condition and restoration of the small intestinal mucous as well as to the relief of gastrointestinal and systemic manifestations. An important role in the improved detection of celiac disease belongs to endoscopic examination of the duodenum with mandatory biopsy, which helps to reveal characteristic visual changes. Modern endoscopic methods and machine learning technologies can detect pathological changes in the mucous even in case of partial and uneven atrophy of small intestine villi .
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


