Современные возможности лечения больных остеопорозом с точки зрения доказательной медицины
- Аннотация
- Статья
- Ссылки
- English
![Рис. 1. Сравнительная частота остеопоротических переломов и некоторых социально значимых заболеваний [2–4]](/upload/resize_cache/iblock/819/195_350_1/4_1.jpg)
![Рис. 2. Механизм действия препарата Бивалос (стронция ранелат) [6]](/upload/resize_cache/iblock/7d5/195_350_1/4_2.jpg)
![Таблица 1. Влияние противоостеопоротических препаратов на риск переломов (адаптировано по [8])](/upload/resize_cache/iblock/7cb/195_350_1/4_3.jpg)
Остеопороз (ОП) – системное заболевание скелета, которое характеризуется снижением костной массы и нарушением ее качества (микроархитектоники), что приводит к хрупкости костей и проявляется переломами при незначительной травме. В ряде случаев наблюдаются и атравматичные переломы. ОП является глобальной проблемой общественного здоровья и здравоохранения, поскольку его последствия повышают уровень смертности и инвалидизации населения. По данным Всемирной организации здравоохранения (ВОЗ), ОП занимает 4-е место по значимости среди неинфекционных болезней после сердечно-сосудистых и онкологических заболеваний, а также сахарного диабета. Каждые 3 секунды в мире происходит остеопоротический перелом, а начиная с 50 лет риск остеопоротического перелома появляется у каждой второй женщины и каждого пятого мужчины [1]. По данным ряда исследований [2–4], некоторые виды остеопоротических переломов по частоте превосходят такие социально значимые заболевания, как рак молочной железы, инсульт и ишемическая болезнь сердца (рис. 1). Таким образом, ОП можно рассматривать как важнейший показатель общественного здоровья.
Согласно статистическим данным, в Российской Федерации ОП страдают 14 млн человек (10% населения), еще 20 млн имеют остеопению [1], следовательно, у 34 млн человек отмечается высокий риск переломов. В нашей стране каждую минуту у людей старше 50 лет происходит 7 переломов позвонков, а каждые 5 минут – перелом шейки бедра (ПШБ). Неутешительны и прогнозы: количество больных с ПШБ среди лиц нетрудоспособного возраста в Российской Федерации к 2030 г. может увеличиться в среднем на 23% (с 112 000 в 2009 г. до 144 000).
Среди всех остеопоротических переломов ПШБ самые тяжелые по последствиям. Согласно статистике, в течение первых 6–12 месяцев умирают 20% больных с этим типом перелома. До 80% пациентов с предшествовавшими переломами имеют высокий риск последующих переломов. По данным О.М. Лесняк и соавт. [3], более 25% пациентов с осложнениями ОП в виде ПШБ не обращаются за медицинской помощью, нигде не обследуются и не получают адекватной терапии. Отметим, что в целом таким пациентам присуща низкая приверженность к лечению – пациенты не всегда соблюдают правила приема лекарственных препаратов и режим терапии, часто прекращают лечение слишком рано, что снижает эффективность лекарственных средств в отношении снижения риска переломов. Так, при опросе методом анкетирования 67 пациентов с верифицированным диагнозом ОП и длительностью заболевания более 1 года было выявлено следующее:
- 67,2% больных в качестве лечения получают лишь препараты кальция и активные метаболиты витамина D, считая это достаточным для лечения ОП;
- 34,3% получали терапию, направленную на нормализацию процессов костного ремоделирования, не систематически, максимальными курсами от 6 до 9 месяцев;
- 4,5% больных не могли найти в поликлинике специалиста, занимающегося данной болезнью;
- только 56,6% больных получали полный курс лечебных мероприятий в соответствии с диагнозом и соблюдали все рекомендации врача.
Фармакотерапия потери костной массы показана с целью как первичной, так и, особенно, вторичной профилактики переломов. При принятии решения о назначении лечения важно оценивать индивидуальный риск переломов у пациента, который в настоящее время можно подсчитать с использованием калькулятора FRAX (Fracture Risk Calculator – Калькулятор риска переломов), предложенного группой специалистов ВОЗ под руководством профессора J. Kanis. Программа позволяет рассчитать десятилетний риск ПШБ и других основных видов остеопоротических переломов у лиц в возрасте 40–90 лет с учетом основных факторов риска (или без них) и данных о минеральной плотности костной ткани (МПКТ) шейки бедренной кости. Решение о необходимости противоостеопоротической терапии принимается в зависимости от рассчитанного риска [3, 4]. С января 2012 г. программа FRAX для подсчета абсолютного риска переломов доступна и для жителей России (http://www.shef.ac.uk/FRAX/tool.jsp?country=22). Кроме того, в клинических рекомендациях Российской ассоциации по остеопорозу приведен алгоритм назначения лечения пациентам с факторами риска ОП. В частности, в документе указано, что при состоявшемся низкоэнергетическом переломе женщинам в постменопаузе необходимо рекомендовать противоостеопоротическую терапию даже без проведения денситометрического исследования. Для мужчин проведение денситометрии обязательно, при этом терапия назначается при Т-критерии -1,5 SD (standard deviation – стандартное отклонение) и менее [5].
Исходя из сущности самого заболевания, главная цель терапии – предупреждение переломов – может быть достигнута путем увеличения МПКТ и улучшения ее качества. Пациенту с болевым синдромом необходимо назначать адекватную анальгетическую терапию, особенно это важно для пациентов с поражением позвоночника. Также одной из важнейших задач лечения признано предупреждение падений.
Все препараты для лечения ОП в зависимости от влияния на костную ткань можно разделить на три большие группы: замедляющие костную резорбцию, усиливающие костеобразование и препараты с двойным механизмом действия, влияющие на оба процесса [5].
Согласно рекомендациям Российской ассоциации по остеопорозу 2012 г. [3], препаратами первой линии лечения ОП являются азотсодержащие бисфосфонаты, стронция ранелат и деносумаб [3].
Не все из перечисленных в российских и международных рекомендациях групп лекарственных средств используются в качестве монотерапии или в силу различных причин являются препаратами первой линии выбора при лечении ОП. Так, кальций, витамин D и его активные метаболиты, а также анаболические стероиды применяются как дополнительные средства к основной патогенетической терапии. Кроме того, в соответствии с решением Комитета по лекарственным препаратам для человека (Committee for Medicinal Products for Human Use, СHMP) при Европейском агентстве лекарственных средств (European Medicines Agency, ЕМА) Миакальцик (кальцитонин) больше не должен применяться для лечения ОП.
На сегодняшний день среди рекомендованных к применению противоостеопоротических средств только Бивалос (стронция ранелат) оказывает двойное действие на костный метаболизм и влияет на оба процесса ремоделирования костной ткани: подавляет резорбцию и стимулирует образование новой прочной костной ткани. Бивалос оказывает воздействие на уровне преостеобластов и преостеокластов (рис. 2) [6]. Данный препарат может действовать и через кальцийчувствительные рецепторы, экспрессируемые хондроцитами (стимуляция синтеза матрикса), что обосновывает его применение при остеоартрозе.
Интересна история создания лекарственного препарата, действующим веществом которого является стронция ранелат. В 1790 г. A. Crawford открыл новый минерал – strontianite, названный по месту открытия (Стронциан, Шотландия); позднее, в 1808 г., H. Davy выделил хлорид стронция. Через сто лет, в 1910 г., F. Lehnerdt впервые установил влияние стронция на образование и резорбцию кости. Однако различные соли стронция были впервые синтезированы намного позже, в 1988 г. А в 1990 г. был выделен стронция ранелат и начато его клиническое изучение. В 1991 г. стартовала первая фаза клинических испытаний.
В настоящее время Бивалос обладает обширнейшей доказательной базой. Так, J.-Y. Reginster и соавт. [7] установили, что:
- Бивалос повышает МПКТ на протяжении 8 лет;
- положительная динамика наблюдается при лечении стронция ранелатом не только у пациентов с уже верифицированным диагнозом ОП, но и у лиц с остеопенией;
- частота возникновения переломов позвонков в течение 8 лет терапии снижается по сравнению с группой плацебо. Аналогичные данные получены и по внепозвонковым переломам.
Сравнительные данные по влиянию различных препаратов на риск переломов в зависимости от их локализации представлены в табл. 1 [8]. Важно отметить, что только в отношении стронция ранелата имеются доказательства его влияния на развитие вертебральных и периферических переломов у пациентов обоего пола, молодого возраста и пожилых, как с переломами в анамнезе, так и без них [9].
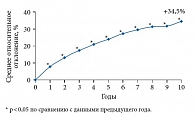
Недавно были опубликованы данные 10-летнего наблюдения, которое показало положительную динамику – прирост МПКТ (на уровне поясничного отдела позвоночника), снижение риска вертебральных и периферических переломов у пациентов на фоне приема Бивалоса. Полученный эффект сохранялся в течение длительного времени при хорошей переносимости препарата (рис. 3) [10].
Интересные данные получили K. Briot и соавт. [11, 12]. Исследователи доказали, что стронция ранелат улучшает геометрию бедренной кости и ее прочность. Положительные изменения наблюдались не только в шейке, но и в диафизарной части бедра. Также было доказано, что стронция ранелат увеличивает площадь поперечного сечения (англ. cross sectional area, CSA) и кортикальную толщину кости – два параметра, которые строго коррелируют с риском переломов бедренной кости.
Таким образом, было показано, что Бивалос не только увеличивает МПКТ, но и улучшает качественные показатели костной ткани, что ведет к снижению риска переломов любой локализации (рис. 4).
Эффективность Бивалоса (стронция ранелат) была подтверждена также данными рутинных лабораторно-инструментальных исследований.
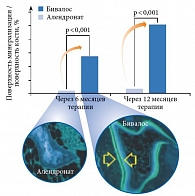
Продолжением изучения действия стронция ранелата на качество кости стало исследование с использованием гистоморфометрии и метода парных биопсий у 387 женщин с постменопаузальным ОП [13]. Особый интерес мирового научного сообщества вызвало сравнение результатов, полученных на фоне применения Бивалоса и алендроната (рис. 5). Новая костная ткань образовывалась только у пациенток, получавших стронция ранелат.
Особого внимания заслуживают результаты исследования, проведенного R. Rizzoli и соавт. [14]. Это первое прямое сравнительное исследование изменений микроархитектоники костной ткани у пациентов, получающих стронция ранелат (Бивалос, или Протелос) или алендронат. Важно отметить, что периферическая количественная микрокомпьютерная томография позволила неинвазивно измерить и оценить структурные изменения и получить трехмерное изображение трабекулярной кости.
В результате проведенных исследований было доказано, что стронция ранелат:
- статистически достоверно и в большей степени, чем алендронат, повышает объем костной ткани и толщину кортикальной кости (на 5,3 и 1,3% соответственно);
- оказывает более значимое положительное влияние на трабекулярную кость (прирост на 2%) по сравнению с алендронатом (прирост на 0,6%);
- положительно влияет на динамику всех параметров микроархитектоники кости по сравнению с исходными данными;
- способствует более высокой скорости отложения минерала в губчатой кости (на 9% больше по сравнению с плацебо, р = 0,019) [15];
- обеспечивает бóльшую площадь поверхности кости, покрытой остеобластами (на 38% по сравнению с плацебо, р = 0,047) [15].
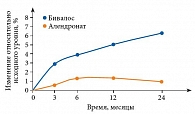
Данные микрокомпьютерной томографии подтвердили увеличение не только объема кости, но и числа трабекул, а также уменьшение расстояния между ними (рис. 6) [16]. Это, безусловно, способствует повышению прочности костной ткани и, как следствие, снижению риска переломов.
Эти данные подтверждаются и в работе B. Jobke и соавт. [17]. Проведен корреляционный анализ биопсийного материала (для оценки состояния микроархитектоники), маркеров костного ремоделирования и показателей DXA (dual energy x-ray absorptiometry, двухэнергетическая рентгеновская абсорбциометрия) у пациентов, получавших терапию бисфосфонатами и в дальнейшем переведенных на стронция ранелат. Результаты показали, что даже после подавляющего действия на костное ремоделирование, которое оказывают бисфосфонаты, Бивалос (стронция ранелат) демонстрирует положительное влияние на трабекулярную и кортикальную костную ткань, а также на изменение микроархитектоники и маркеров костного ремоделирования.
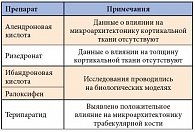
Эффекты разных противоостеопоротических препаратов на микроархитектонику костной ткани, установленные в исследованиях, обобщены в табл. 2.
В 2012 г. на Европейском конгрессе по клиническим и экономическим аспектам остеопороза и остеоартроза (European Congress on Clinical and Economic Aspects of Osteoporosis and Osteoarthritis, ECCEO) были впервые представлены результаты крупного рандомизированного плацебоконтролируемого исследования эффективности стронция ранелата в лечении остеоартроза. Потенциальные возможности стронция ранелата в отношении влияния на структурное изменение хряща при остеоартрозе показаны в доклинических исследованиях, где была продемонстрирована способность стронция ранелата восстанавливать баланс между формированием и дегенерацией хрящевой ткани. Предварительные положительные данные были получены у пациентов с остеоартрозом позвоночника в ходе клинических исследований эффективности стронция ранелата (Бивалос) при постменопаузальном ОП [18–20]. Субанализ показал обнадеживающие результаты применения стронция ранелата, выражающиеся как в снижении маркеров деградации хряща (C-концевой перекрестно-связывающий телопептид костного коллагена – сarboxyterminal cross-linking telopeptide of bone collagen, CTX-II) в моче, так и в замедлении прогрессирования остеоартроза и уменьшении болевого синдрома (боль в спине).
Было проведено международное рандомизированное двойное слепое плацебоконтролируемое исследование, в котором изучались эффективность и безопасность применения стронция ранелата для лечения гонартроза у 1371 пациента в течение трех лет [20–22]. В качестве первичной конечной точки было принято радиологическое изменение ширины межсуставной щели медиального тибиофеморального отдела коленного сустава при лечении Бивалосом по сравнению с плацебо. Вторичные конечные точки включали оценку боли, скованности и функции по шкале WOMAC (Western Ontario and McMaster Universities Arthritis Index – индекс артрита университетов Западного Онтарио и МакМастера). Применение стронция ранелата оказывало выраженный эффект как на структуру хряща, так и на симптомы остеоартроза. Полученная разница в ширине межсуставной щели при приеме стронция ранелата была достоверной по сравнению с плацебо (p = 0,018). В группе пациентов, принимавших стронция ранелат, потеря хряща уменьшилась на 27%. С клинической точки зрения это говорит о снижении скорости прогрессирования остеоартроза и отдалении сроков операции по эндопротезированию сустава. Этот достоверно доказанный эффект стронция ранелата на структуру хряща сопровождался также улучшением показателей по общей шкале WOMAC и субшкале боли (в обоих случаях p < 0,05). В данном исследовании еще раз была продемонстрирована хорошая переносимость и безопасность стронция ранелата у пациентов с остеоартрозом.
Таким образом, Бивалос (стронция ранелат), показавший себя как эффективный и безопасный препарат для патогенетического лечения ОП у женщин в постменопаузе и у мужчин, теперь может применяться по новому показанию – для лечения остеоартроза коленных и тазобедренных суставов с целью замедления прогрессирования разрушения хряща.
Modern evidence-based therapy approaches in osteoporosis
Ye.V. Doskina
State Budgetary Educational Institution for Continuing Professional Education ‘Russian Medical Academy
of Postgraduate Education’
Contact person: Yelena Valeryevna Doskina, elena-doskina@rambler.ru
According to WHO experts, osteoporosis is the fourth largest non-communicable disease, surpassed only by cardiovascular, cancer and diabetes. Postmenopausal women and men older than 50 years are at risk of the disease. Among first-line therapies for osteoporosis (bisphosphonates, strontium ranelate and denosumab), only strontium ranelate (Bivalos) produces double effect on bone metabolism and influences both processes of bone tissue remodeling – inhibits resorption and stimulates new strong bone formation. Bivalos improves bone mineral density as well as qualitative characteristics of bone tissue and results in decreased risk of fractures of any location.
Recent studies have demonstrated that strontium ranelate restores the balance between formation and degeneration of cartilage. These findings provide new opportunities for management of knee and hip osteoarthritis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.