Остеопороз и кальциноз сосудов у больных сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
- English
В развитии кальциноза участвуют остеопонтин, остеопротегерин, RANKL, фетуин А, костные морфогенетические белки. Все эти вещества вырабатываются в сосудистой стенке в процессе прогрессирования атеросклероза. Риск развития кальциноза коронарных артерий повышен у лиц с большим индексом массы тела, что характерно для пациентов с сахарным диабетом 2 типа, артериальной гипертензией, дислипидемией, нарушением толерантности к углеводам, то есть с компонентами метаболического синдрома, а также с наследственной предрасположенностью, хронической болезнью почек, высоким уровнем фибриногена и С-реактивного белка.
Как следствие, крайне важен комплексный подход к курации пациентов, своевременное назначение адекватной сахароснижающей, гиполипидемической, антирезорбтивной и симптоматической терапии.
В развитии кальциноза участвуют остеопонтин, остеопротегерин, RANKL, фетуин А, костные морфогенетические белки. Все эти вещества вырабатываются в сосудистой стенке в процессе прогрессирования атеросклероза. Риск развития кальциноза коронарных артерий повышен у лиц с большим индексом массы тела, что характерно для пациентов с сахарным диабетом 2 типа, артериальной гипертензией, дислипидемией, нарушением толерантности к углеводам, то есть с компонентами метаболического синдрома, а также с наследственной предрасположенностью, хронической болезнью почек, высоким уровнем фибриногена и С-реактивного белка.
Как следствие, крайне важен комплексный подход к курации пациентов, своевременное назначение адекватной сахароснижающей, гиполипидемической, антирезорбтивной и симптоматической терапии.

Сахарный диабет (СД) – актуальная проблема современного здравоохранения. Согласно данным Всемирной организации здравоохранения, патология занимает третье место среди причин инвалидизации и смерти после сердечно-сосудистых и онкологических заболеваний [1].
Основной причиной смерти пациентов с СД 2 типа являются сердечно-сосудистые заболевания. Известно, что уже на момент верификации диагноза более 50% из них страдают ишемической болезнью сердца.
Течение ишемической болезни сердца зависит от многих факторов [2], основные среди них – длительность и компенсация СД (чаще декомпенсация), а также наличие или отсутствие тяжелых коморбидных состояний [3, 4]. При СД ведущим и наиболее значимым фактором, инициирующим как прямое, так и опосредованное повреждение сердечной мышцы, является гипергликемия. Она способствует поражению миокарда и усиливает отрицательное влияние других факторов сердечно-сосудистого риска [2, 5]. S. Haffner и соавт. еще в 1998 г. установили повышенную частоту встречаемости атеросклероза еще до клинической манифестации диабета [6, 7]. Необходимо отметить, что представленная R.A. DeFronzo и соавт. в 1992 г. модель развития сахарного диабета актуальна и в настоящее время (рис. 1).
В то же время пациенты с сердечно-сосудистыми заболеваниями находятся в группе риска развития СД 2 типа.
У взрослых проблема поздней диагностики и лечения СД связана с недостаточным уровнем профилактики сердечно-сосудистой патологии. Опаснейшими последствиями глобальной эпидемии СД, с одной стороны, являются его системные сосудистые осложнения – нефропатия, ретинопатия, поражение магистральных сосудов сердца, головного мозга, периферических сосудов нижних конечностей [1, 8], с другой – остеопороз и кальциноз.
Еще в 1999 г. Е.Л. Насонов предложил отнести к кальций-дефицитным состояниям сердечно-сосудистые заболевания (без четкого уточнения генеза), дегенеративные заболевания позвоночника и суставов, а также остеопороз, служащие наиболее частыми проявлениями инволютивной патологии. Во многом это обусловлено сходством патогенеза атеросклероза и остеопороза, при которых поврежденные моноцитарные клетки в одном случае дифференцируются в сосудистой стенке в макрофагоподобные пенистые клетки, в другом – в остеокласты.
Эпидемиологические данные позволяют предположить, что возрастание частоты встречаемости остеопороза, эктопической кальцификации и атеросклероза у одних и тех же пациентов объясняется не только неспецифическими возрастными факторами, ассоциированными с независимым накоплением этих патологических состояний в пожилом возрасте. Вероятно, существует и общая патогенетическая основа указанных состояний.
Долгое время развитие кальциноза коронарных артерий представлялось пассивным дегенеративным процессом, конечной стадией атеросклероза, что подтверждалось корреляцией степени кальциноза с возрастом пациентов [9]. На сегодняшний день считается, что кальциноз артерий является активным процессом, в основе которого лежат механизмы, регулирующие обмен кальция в организме, в частности механизмы роста и формирования костей [10, 11]. При этом кальцинированное поражение артерий, приводящее к формированию вещества костной плотности, возможно только при наличии других факторов риска атеросклероза. И.В. Сергиенко и соавт. указали на то, что отложение кальция в атеросклеротических бляшках начинается на стадии формирования липидных полос и продолжается на всех остальных этапах атерогенеза [12].
Таким образом, атеросклероз рассматривается как хронический воспалительный процесс, индуцирующий остеогенную дифференцировку гладкомышечных клеток сосудов, приводящую к кальцинозу коронарных артерий. В свою очередь кальциноз может индуцировать воспалительные изменения, способствуя дальнейшему отложению кальция в атеросклеротических бляшках, то есть прогрессированию процесса [13].
В настоящее время выделяют два морфологических типа кальциноза коронарных артерий: атеросклеротическая кальцификация с преимущественным поражением интимы и кальциноз медиального слоя артерий. При первом типе происходит индукция остеогенной дифференциации гладкомышечных клеток сосудов медиаторами воспаления и липидами атеросклеротических бляшек [14]. Развитие кальциноза медийного слоя артерий ассоциировано с преклонным возрастом, диабетом и хроническим заболеванием почек. Ранее считавшийся доброкачественным процессом кальциноз медии повышает жесткость артерий, что увеличивает риск неблагоприятных сердечно-сосудистых событий [15]. В обоих случаях кальциноз коронарных артерий приводит к снижению эластичности стенки артерии, патологическим вазомоторным ответам и нарушению перфузии миокарда [16]. Это происходит на фоне других кардиальных изменений.
В развитии кальциноза важную роль играют остеопонтин, остеопротегерин, RANKL, фетуин А, костные морфогенетические белки. Все эти вещества вырабатываются в сосудистой стенке при прогрессировании атеросклероза. В ряде исследований выявлена связь между уровнем остеопонтина и уровнем коронарного кальция, измеренного с помощью мультиспиральной компьютерной томографии [17–19]. Поэтому остеопонтин предложено рассматривать как независимый фактор риска возникновения сердечно-сосудистых событий. Показано, что остеопонтин и костный морфогенетический белок 7 определяют дифференциацию гладкомышечных клеток сосудов в остеобластоподобные клетки, которые в свою очередь индуцируют процессы отложения кальция в стенке сосудов [20, 21]. В то же время остеопротегерин, фетуин А, пирофосфаты и остеонектин выступают в качестве ингибиторов сосудистой кальцификации [22–24].
Большинство исследователей считают, что основную роль в кальцификации атеросклеротических бляшек играют белки костного матрикса, функция которых регулируется индукторами и ингибиторами кальцификации (остеонектином, остеопонтином, остеопротегерином и др.). В норме между ними существует баланс. При его нарушении в сторону индукторов кальциноза может развиться кальциноз коронарных артерий. Необходимо отметить, что точные механизмы действия и значение маркеров кальцификации находятся на стадии изучения.
В 1994 г. N.D. Wong и соавт. установили, что кальциноз коронарных артерий встречается более чем у 90% мужчин и более чем у 67% женщин старше 70 лет [25]. В 2019 г. в аналогичной работе F. Wang и соавт. показано, что развитие кальцинированных атеросклеротических бляшек в коронарных артериях чаще наблюдалось в возрасте 53 лет у мужчин и 62 лет у женщин. К 64 годам у мужчин и 73 годам у женщин встречаемость кальциноза коронарных артерий ККА достигала 75% [26].
Риск развития кальциноза коронарных артерий выше у лиц с увеличенным индексом массы тела, что характерно для пациентов с СД 2 типа, и артериальным давлением, дислипидемией, нарушением толерантности к углеводам, то есть с компонентами метаболического синдрома, а также с наследственной предрасположенностью, хронической болезнью почек, высоким уровнем фибриногена и повышенным уровнем С-реактивного белка [2, 27, 28]. Все это общепризнанные факторы риска развития атеросклероза. Важную роль также играют другие факторы, например курение [29].
Согласно результатам крупного исследования EPIC-Heidelberg, в которое были включены 24 тыс. человек в возрасте от 35 до 64 лет, употребление кальциевых добавок достоверно может увеличивать риск развития инфаркта миокарда [30]. Некоторые авторы сообщили об увеличении риска инфаркта миокарда при употреблении кальциевых добавок более чем 800 мг/сут [13]. Получены также противоположные данные. Так, употребление кальция с пищей не оказывало значительного влияния на кальциноз сосудов и сердечно-сосудистые события [31].
Важно напомнить, что медиальный кальциноз, или артериосклероз Менкеберга, – макроангиопатия, развивающаяся преимущественно на фоне сахарного диабета. Однако она может также быть лекарственно-индуцированной, например витамином D, варфарином.
Коронарный кальций служит маркером интенсивности коронарного атеросклероза. Установлено, что он является предиктором прогрессирования атеросклероза [32, 33]. Так, в исследовании P. Raggi и соавт. продемонстрировано, что у лиц с бессимптомным течением атеросклероза оценка коронарного кальция позволяла предсказать вероятность развития инфаркта миокарда в течение трех лет наблюдения. В то же время традиционные показатели липидного обмена оказались неэффективными в отношении прогнозирования сосудистых катастроф [34]. У пациентов с развившимся инфарктом миокарда в период наблюдения степень прогрессирования кальциноза коронарных артерий была значимо выше.
В ряде исследований выявлено, что костная и сосудистая ткани имеют ряд общих морфологических и молекулярных свойств. Сосудистый кальцинат состоит из тех же компонентов, что и костная ткань, − солей кальция, фосфатов, связанных с гидроксиапатитом, остеопонтина, костного морфогенного белка, матриксного Gla-белка, коллагена I, остеонектина, остеокальцина и др. [35]. К общим факторам риска развития остеопороза и сосудистых заболеваний помимо курения, сахарного диабета, почечной недостаточности следует отнести хроническое воспаление, оксидативный стресс, патологические состояния, которые ассоциируются с дефицитом эстрогенов, гиповитаминозы С, D, К [36].
Таким образом, в настоящее время актуальна концепция, в соответствии с которой сердечно-сосудистые заболевания и остеопороз связаны посредством маркеров, одновременно влияющих на сосудистые и костные клетки [37].
Доказано, что скорость снижения костной массы пропорциональна степени прогрессирования атеросклеротического процесса [38–40].
Вместе с тем существует мнение, что данная закономерность характерна только для женщин пожилого возраста. Так, C.M. Kammerer и соавт. отметили, что только у женщин старшей возрастной группы имела место корреляция минеральной плотности костной ткани с изменениями сосудистой стенки сонных артерий [41]. У более молодых получены противоположные данные. С помощью электронно-лучевой компьютерной томографии выявлена связь между снижением минеральной плотности костной ткани в позвоночнике, проксимальном отделе бедренной кости и увеличением содержания кальция в коронарных артериях [36]. Показано, что низкая минеральная плотность кости у пожилых является независимым и более важным фактором риска сердечно-сосудистой смерти, чем такие компоненты метаболического синдрома, как повышенные артериальное давление и уровень холестерина в крови [31].
Оксидативный стресс ингибирует дифференциацию остеобластов кости и стромальных клеток костного мозга. Такой ответ на оксидативный стресс отчасти объясняет кальцификацию сосудов и дефект кальцификации кости. Через оксидативный стресс реализуется воздействие и воспалительных медиаторов, например фактора некроза опухолей α, который дозозависимым образом влияет на сосудистую кальцификацию [14].
Таким образом, крайне важен комплексный подход к курации пациентов, своевременное и как можно более раннее назначение адекватной сахароснижающей, гиполипидемической, антирезорбтивной и симптоматической терапии.
Наибольшее число исследований было выполнено с бисфосфонатами (БФ). Эффективность БФ в замедлении потери костной массы и предотвращении риска переломов доказана в многочисленных рандомизированных контролируемых исследованиях, поэтому они наиболее часто используются для лечения остеопороза, а алендронат считается золотым стандартом терапии остеопороза [42].
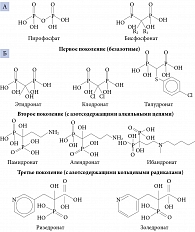
Бисфосфонаты – это синтетические аналоги пирофосфатов, природных ингибиторов костной минерализации. Их структура сходна со структурой костного минерала гидроксиапатита, что определяет устойчивость препаратов этой группы к химическому и ферментативному гидролизу и способность адсорбироваться на поверхности гидроксиапатитных кристаллов, препятствуя их росту. Структура различных бисфосфонатов представлена на рис. 2.
Прирост минеральной плотности кости при применении БФ обусловлен их способностью восстанавливать положительный баланс между процессами ремоделирования: формированием и резорбцией, которую они подавляют посредством прямого воздействия на остеокласты. БФ нарушают функциональную активность остеокластов и индуцируют апоптоз.
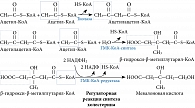
Способы воздействия БФ на остеокластогенез определяет строение их молекулы (присутствие в структуре атома азота или аминогруппы). Так, не содержащие аминогруппу препараты (этидронат, клодронат, тилудронат) превращаются в аденозин-5’-(β,γ-дихлорометилен) трифосфат (аналог аденозинтрифосфата), который, проникая в остеокласты, нарушает их функциональную активность и снижает жизнеспособность [43]. Присутствие в структуре БФ азота или аминогруппы значительно увеличивает их антирезорбтивную активность за счет воздействия на каскад мевалонатного пути биосинтеза холестерина (рис. 3), являющегося также точкой приложения статинов – препаратов, применяемых для лечения гиперхолестеринемии. Биосинтез холестерина происходит в несколько этапов. Сначала 3-гидрокси-3-метилглутарил коэнзим А (ГМГ-КоА) под влиянием ГМГ-КоА-редуктазы превращается в мевалонат. Этот этап подавляется статинами. Далее мевалонат трансформируется в геранилпирофосфат, а затем в фарнезилпирофосфат при участии фарнезилпирофосфатсинтетазы – ключевого фермента, регулирующего клеточные процессы, необходимые для функционирования и выживаемости остеокластов. БФ непосредственно подавляют активность этого фермента [44]. В завершение образуется сквален и, наконец, холестерин.
Установлено, что эффективно воздействовать на остеокластогенез путем активизации апоптоза остеокластов in vitro в равной степени способны как БФ, так и статины [45].
Проводились исследования в отношении влияния БФ на развитие и снижение прогрессирования атеросклероза.
Механизмы действия БФ на сосудистую стенку оценены в экспериментальных исследованиях. Показано, что препараты способны аккумулироваться в интиме или медии независимо от наличия атеросклеротического повреждения из-за высокого сродства с гидроксиапатитом. БФ тормозят формирование пенистых клеток, блокируют кальциевые каналы гладкомышечных клеток артерий, уменьшая перегрузку клетки кальцием [46]. У кроликов с гипехолестеринемией и установленными стентами в подвздошной артерии введение липосомного клодроната или алендроната приводило к значительному уменьшению количества моноцитов и макрофагов, а также к подавлению гиперплазии неоинтимы вблизи стента [47]. Дозозависимое влияние БФ на пролиферацию, адгезию, миграцию и микроструктуру гладкомышечных клеток было выявлено у крыс при введении золедроновой кислоты [48]. В более позднем исследовании было оценено влияние золедроновой кислоты на фибробласты – клетки, которые играют ключевую роль в неоинтимальной гиперплазии и ремоделировании сосудов [49]. Показано, что типичная морфология фибробластных клеток изменялась после воздействия золедроната: культивируемые фибробласты дозозависимо ингибировали пролиферацию клеток вследствие остановки клеточного цикла в S-фазе. Активность миграции клеток зависела от дозы золедроната [49, 50]. Это можно рассматривать как класс-эффект препаратов золедроновой кислоты в дозе 5 мг/100 мл, применяемой для лечения остеопороза.
Бисфосфонаты были обнаружены в кальцинированных атеросклеротических бляшках у животных [49, 51]. Накопление БФ в артериях, пораженных атеросклерозом, объясняют их связью с кальцифицированным атероматозным поражением из-за высокого сродства с гидроксиапатитом и кальцием. Однако в ряде исследований БФ (этидронат и памидронат) были выявлены в высоких концентрациях и в не пораженных атеросклерозом сосудах, в частности в аорте у мышей и артериях молочной железы человека [52]. Эффект накопления БФ в здоровых сосудах может быть следствием подавления атерогенеза на раннем этапе.
При изучении влияния на толщину комплекса «интима – медиа» сонной артерии и на показатели липидного обмена двух БФ, применяемых внутривенно, – золедроната (5 мг один в год) и ибандроната (3 мл один раз в три месяца) установлено, что через год от начала терапии его толщина уменьшилась в обеих группах. Однако статистическая значимость различий была достигнута лишь в группе золедроновой кислоты. В обеих группах также было отмечено повышение уровня холестерина липопротеинов высокой плотности и его соотношения с уровнем холестерина липопротеинов низкой плотности (р < 0,01). Снижение уровня холестерина липопротеинов низкой плотности также наблюдалось в обеих группах. Однако статистическая значимость была достигнута только в группе золедроновой кислоты (p < 0,05). В обеих группах отмечалось статистически значимое снижение уровня фактора роста фибробластов 23, а также повышение уровня склеростина, более выраженное в группе золедроновой кислоты [53].
Ассоциация приема азотсодержащих бисфосфонатов (алендроната, ризедроната, ибандроната, золедроната (см. рис. 2)) с кальцификацией аортального и митрального клапанов, грудного отдела аорты, коронарных артерий, диагностированной при помощи компьютерной томографии, была изучена в крупном исследовании MESA. В одной из ветвей исследования у 3710 женщин, стратифицированных по возрасту, после поправок на демографические данные, индекс массы тела, уровень холестерина, статус курения, наличие сахарного диабета, артериальной гипертензии, прием менопаузальной гормональной терапии, а также терапии антигипертензивными (ингибиторами ангиотензинпревращающего фермента) и гиполипидемическими (статинами) препаратами, применение БФ привело к снижению частоты сердечно-сосудистой кальцификации у пациенток 65 лет и старше. Однако у женщин моложе 65 лет подобного эффекта отмечено не было. Разницу в действии у относительно молодых и пожилых женщин авторы исследования объясняли более длительным приемом препаратов пожилыми и необходимостью длительной терапии для проявления антиатеросклеротического эффекта БФ [54].
Анализ результатов исследований 2000–2014 гг., проведенный C. Caffarelli и соавт., свидетельствует о положительном влиянии БФ на течение как атеросклероза, так и медикальциноза с указанием на возможную роль различных цитокинов, в том числе остеопротегерина [55].
Применение золедроновой кислоты в дозе 5 мг/100 мл эффективно для лечения остеопороза, профилактики остеопоротических переломов и предотвращения кальцификации сосудов.
На сегодняшний день на фармацевтическом рынке представлены как оригинальные препараты золедроновой кислоты, так и их дженерики (Остеостатикс раствор для инфузий 5 мг/100 мл рег. № ЛП 005585 от 13.06.2019, ООО «Фарм-Синтез», Россия).
Суммируя влияние БФ на сосудистую стенку, продемонстрированное в экспериментальных исследованиях, можно заключить, что они оказывают как прямое, так и непрямое воздействие, связанное со снижением костной резорбции, уменьшением элиминации кальция из костной ткани и депонированием его в сосудистой стенке, подавлением воспаления в атеросклеротических бляшках и ее стабилизацией.
Ye.V. Doskina, PhD, Ye.S. Ilina
Russian Medical Academy for Continuing Professional Education
Contact person: Yelena V. Doskina, evd-evd20008@yandex.ru
Calcification of the arteries is an active process, which is based on the mechanisms that regulate the exchange of calcium in the body, in particular, the mechanisms of growth and formation of bones.
Osteopontin, osteoprotegerin, RANKL, fetuin A, bone morphogenetic proteins play a role in the development of calcification. All these substances are produced in the vascular wall during the progression of atherosclerosis. There is a high risk of coronary artery calcification in people with a high body mass index (which is typical for patients with type 2 diabetes mellitus), high blood pressure, dyslipidemia, impaired carbohydrate tolerance – components of the metabolic syndrome, as well as family predisposition, chronic kidney disease, high levels of fibrinogen and increased levels of C-reactive protein.
It is extremely important to take an integrated approach in the curation of patients, timely early appointment of adequate hypoglycemic, hypolipidemic, antiresorptive and symptomatic therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.