Современный взгляд на антибактериальную профилактику при трансректальной биопсии предстательной железы в условиях роста резистентности микроорганизмов
- Аннотация
- Статья
- Ссылки
Под приобретенной устойчивостью понимают свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть микробной популяции. Возможны ситуации, когда бὸльшая часть микробной популяции проявляет приобретенную устойчивость. Известны несколько биохимических механизмов формирования устойчивости бактерий к антибиотикам:
- модификация мишени действия;
- инактивация антибиотика;
- активное выведение антибиотика из микробной клетки (эффлюкс);
- нарушение проницаемости внешних структур микробной клетки;
- формирование метаболического «шунта».
Наиболее распространенным механизмом устойчивости микроорганизмов к β-лактамным антибиотикам является их ферментативная инактивация в результате гидролиза одной из связей β-лактамного кольца ферментами β-лактамазами. К настоящему времени описано более 200 таких ферментов. Локализация генов (плазмидная или хромосомная), кодирующих эти ферменты, определяет эпидемиологию резистентности. При плазмидной локализации генов происходит быстрое внутри- и межвидовое распространение резистентности, при хромосомной образуется резистентный клон. В настоящее время наибольшее значение для клинической практики имеют плазмидные β-лактамазы расширенного спектра (БЛРС) грамотрицательных бактерий, поскольку они способны разрушать цефалоспорины III и в меньшей степени IV поколения. Рутинные методы оценки антибиотикочувствительности очень часто не выявляют этот механизм устойчивости. Чаще всего БЛРС встречаются у микроорганизмов рода Klebsiella, достаточно часто у E.coli и Proteus spp., реже у других грамотрицательных бактерий.
В России в некоторых лечебных учреждениях распространенность БРЛС среди клебсиелл достигает 90% [1]. При нозокомиальных инфекциях, вызванных Enterobacter spp., Citrobacter spp. и некоторыми другими микроорганизмами, в процессе лечения цефалоспоринами III поколения примерно в 20% случаев формируется резистентность к этим антибиотикам, обусловленная гиперпродукцией хромосомных β-лактамаз класса С. В таких ситуациях эффективность сохраняют цефалоспорины IV поколения и карбапенемы. К неблагоприятным тенденциям, наблюдаемым в последнее время, следует отнести иммобилизацию ферментов класса С на плазмидах, что создает реальные предпосылки для их широкого распространения.
Ряд международных организаций констатируют, что спустя всего лишь 70 лет после появления в клинической практике антибиотиков мы можем столкнуться с отсутствием эффективных препаратов для профилактики и лечения различных бактериальных инфекций [2]. В странах Европы уровень резистентности к антибиотикам как грамотрицательных, так и грамположительных микроорганизмов, вызывающих тяжелые инфекционные заболевания и осложнения, достиг 25% и более. Ежегодно в Европе вследствие селекции мультирезистентных штаммов бактерий умирает около 25 000 больных. Общие затраты здравоохранения в связи с распространением таких штаммов составляют не менее 1,5 миллиардов евро.
По мнению ведущих экспертов, развитие резистентности микроорганизмов к антибиотикам первого ряда во многих странах происходит по сценарию «ночного кошмара» [3]. Наглядным примером является ситуация в Испании, где регистрируется самый высокий уровень резистентности микроорганизмов в Европе. Так, в 2003 году резистентность к ципрофлоксацину у E.сoli, выделенной у больных при посевах крови, наблюдалась в 19% случаев. По данным European Antimicrobial Resistance Surveillance System (EARSS), в 2007 году уровень резистентности к фторхинолонам в Испании превысил 25%. A. Jimenez-Pacheco et al. представили результаты исследования, продемонстрировавшего наличие у 30 изолятов E.сoli,, продуцирующих БЛРС, резистентности к ципрофлоксацину и левофлоксацину [4].
Методами ПЦР и секвенирования ДНК были выявлены специфические мутации у всех уропатогенов этой группы. Авторы исследования подтвердили возможность формирования у продуцентов БЛРС ассоциированной резистентности к фторхинолонам в результате передачи обоих механизмов через плазмиды. Таким образом, мультирезистентность повышает вероятность появления в повседневной клинической практике микроорганизмов, обладающих одновременно несколькими механизмами резистентности.
В письме к членам Европейской ассоциации урологов от 7 декабря 2010 г. профессора F.M.E. Wagenlehner и T.E. Bjerklund-Johansen обращают внимание на результаты опубликованного в этом году исследования о появлении новых резистентных штаммов микроорганизмов [5, 6]. В Великобритании, Индии и Пакистане выделены 107 представителей Еnterobacteria, которые являются источником металло-β-лактамаз 1 расширенного спектра действия (New Delhi metallo-β-lactamase 1; NDM-1) и обладают высокой резистентностью к большинству антибиотиков. Два штамма Klebsiella, выделенных в Великобритании проявили резистентность ко всем известным антибиотикам. Эти микроорганизмы, или плазмиды, определяющие резистентность, способны распространяться в разных регионах мира. В то время как сегодня в клинической практике появился ряд новых антибиотиков, действующих на грамположительные бактерии, создание новых препаратов против грамотрицательных патогенов в ближайшем будущем не предвидится, что представляет огромную проблему для урологии.
Рациональное применение известных сегодня антибиотиков и оптимизация антимикробной профилактики в урологии имеет большое значение для предотвращения развития серьезных инфекционных осложнений, особенно после высокотехнологичных и малоинвазивных операций. К широко применяемым малоинвазивным вмешательствам в урологии относится, например, трансректальная биопсия предстательной железы (ТРБП) под УЗ-контролем.
Рак предстательной железы (РПЖ) является весьма распространенным злокачественным новообразованием у мужчин среднего и пожилого возраста. В структуре онкологических заболеваний в ряде стран РПЖ выходит на 2–3-е место после рака легкого и желудка, а в США и Швеции – на 1-е место. Россия занимает 2-е место по темпам прироста заболеваемости РПЖ (31,4%). Программы скрининга РПЖ получили широкое распространение после внедрения метода определения простат-специфического антигена (ПСА) в конце 1980-х годов и усовершенствования техники выполнения биопсии простаты. В 2006 году в США выполнено 624 000 трансректальных биопсий простаты с целью ранней диагностики РПЖ. Однако опыт показывает, что до 25% случаев РПЖ не выявляются с помощью биопсии простаты. Нередко пациентам приходится выполнять повторное исследование [7].
Сегодня основным методом верификации рака простаты является трансректальная биопсия простаты (ТРБП) под УЗ-контролем. Вместе с тем существует ряд серьезных осложнений (в особенности инфекционных), связанных с данной процедурой. Характер инфекционных осложнений (13–20%) может варьировать от асимптоматической бактериурии (13–36%), бактериемии (73–100%) и лихорадки (0–48%) до угрожающего жизни сепсиса [8, 9]. По данным литературы, острый бактериальный простатит после ТРБП развивается в 0,1–7% случаев, а уросепсис – в 0,6% [10]. Сообщается также об опасности возникновения эндокардита, обусловленного Enterococcus faecalis [11]. Основными возбудителями являются Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa и Enterococcus spp. [12, 13]. Сообщается о выявлении Bacteroides spp., Peptococcus spp., Peptostreptococcus spp. и Clostridium perfringens, однако уровень анаэробной инфекции остается низким. Наиболее часто в позитивных посевах мочи и крови у пациентов, перенесших ТРБП, выделяется Escherichia coli. Осложнения нередко вызваны устойчивыми микроорганизмами, продуцирующими β-лактамазы расширенного спектра действия.
R.K. Nam и соавт. проанализировали результаты ТРБП у 75 190 пациентов, наблюдавшихся в университете г. Торонто (Канада) с 1996 по 2005 гг. У 33 508 (44,6%) пациентов был диагностирован РПЖ. Количество урологических осложнений, отмеченных в течение 30 суток после операции, с 1% в 1996 году возросло до 4,1% в 2005 году. Большинство осложнений (72%) были связаны с развитием мочевой инфекции [14]. Ряд рандомизированных контролируемых исследований (RCTs) свидетельствуют, что профилактическое применение антибиотиков снижает риск развития сепсиса после ТРБП [15, 16]. Aron и соавт. показали, что применение фторхинолонов значительно уменьшает количество инфекционных осложнений после ТРБП по сравнению с плацебо (8% против 25%) [15]. Несмотря на очевидность этого факта, в настоящее время отсутствуют европейские стандартизированные рекомендации по антимикробной профилактике при ТРБП. Выбор антибактериальной профилактики при проведении ТРБП является трудной задачей, и консенсус в определении идеального режима профилактики отсутствует. Даже в одном регионе режимы профилактики могут быть различными. Вместе с тем фторхинолоны включены в большинство протоколов по антимикробной профилактике острого бактериального простатита при выполнении ТРБП, что обусловлено их широким спектром действия, фармакокинетикой, благоприятной биоэквивалентностью и удобным способом применения (перорально).
Опрос, проведенный среди 568 урологов США, показал, что 90,1% из них используют антимикробную профилактику при ТРБП, назначая с этой целью фторхинолоны, при этом в половине случаев профилактика проводится не менее 3 дней [17]. Вопрос о продолжительности профилактики остается открытым: одна доза перед процедурой перорально или внутривенно, следует ли продолжать прием препарата после процедуры и как долго? Не все проведенные исследования подтверждают преимущество пролонгированной антимикробной профилактики. Существует мнение о необходимости назначения первой дозы препарата за сутки до выполнения ТРБП [18]. Мультицентровое двойное слепое исследование эффективности ципрофлоксацина XR 1000 мг не выявило существенных преимуществ 3-дневного применения препарата по сравнению с однодневным режимом дозирования в профилактике инфекционных осложнений при ТРБП у 497 пациентов [19]. Вместе с тем среди больных, принимавших препарат 1 день, уровень бактериологической неудачи был выше (5,4%), чем при 3-дневном применении (2,1%). Авторы считают, что 3-дневный режим дозирования может играть позитивную роль при профилактике инфекций у пациентов с сахарным диабетом и наличием простатита в анамнезе.
В другом исследовании, проведенном во Франции, авторы проанализировали инфекционные осложнения после ТРБП у 288 пациентов, которым проводилась антимикробная профилактика одной дозой ципрофлоксацина или 3-дневным приемом препарата. Острый бактериальный простатит (ОБП) развился в одном случае в каждой из групп, у 12 пациентов после процедуры имела место асимптоматическая бактериурия. У пациента с ОБП, получавшего 3-дневную антимикробную профилактику, в посеве мочи была обнаружена Escherichia coli, резистентная к ципрофлоксацину. Авторы не выявили клинических различий в группах на 5-й и 21-й день после процедуры и считают достаточной профилактику одной дозой антибиотика [20].
При выборе препарата для антимикробной профилактики очень важным аспектом, который часто недооценивают, являются локальные данные о резистентности микроорганизмов с учетом предшествующей антимикробной терапии. Резистентность уропатогенов к ципрофлоксацину в некоторых центрах Великобритании составляет 20-25%. Другой проблемой является предшествующий прием пациентом этого препарата, что было наглядно продемонстрировано в опубликованных недавно клинических наблюдениях. В одном случае перед ТРБП пациент прошел 6-месячный курс лечения ципрофлоксацином по поводу простатита, в другом больной принимал ципрофлоксацин в течение 2 недель при хирургическом вмешательстве за 3 месяца до исследования. Антимикробная профилактика во время ТРБП в первом случае проводилась гентамицином, аугментином и метронидазолом, во втором – ципрофлоксацином и метронидазолом. У обоих пациентов развились септицемия и озноб, посев крови выявил наличие у них мультирезистентных микроорганизмов, вероятно вследствие длительного приема ципрофлоксацина. Очевидно, что предшествующая антибактериальная терапия является значимым фактором при планировании ТРБП, и в этом случае необходимо сделать существенную корректировку схемы антимикробной профилактики [21, 22].
R. Tal и соавт. выполнили ТРБП 23 пациентам, которым за 2 суток до биопсии была начата антимикробная профилактика. В 69,5% случаев были назначены фторхинолоны (ципрофлоксацин или офлоксацин). Клинические проявления в виде повышения температуры тела до 39° наблюдались у 56,5% пациентов, в 4 случаях развился орхит или орхоэпидидимит. Посев мочи был положительным у 60,8% больных, а посев крови – у 26,1%. Во всех случаях обнаружена Escherichia coli, резистентная к фторхинолонам и ко-тримоксазолу [23]. Ряд исследований, представленных на конгрессе Американской ассоциации урологов в 2010 г., продемонстрировал возрастающую частоту развития уросепсиса после ТРБП, обусловленную резистентностью микроорганизмов к антибиотикам. Лихорадка, потребовавшая госпитализации, наблюдалась у 769 пациентов, перенесших 945 ТРБП с 2006 по 2009 гг., при этом уросепсис был диагностирован у 15 (1,6%) пациентов [24]. Во всех случаях перед операцией проводилась антимикробная профилактика ципрофлоксацином. Среди 12 пациентов с положительными результатами бактериологического исследования у 10 (83%) была выделена E.сoli, резистентная к ципрофлоксацину. Наличие микроорганизмов, продуцирующих БЛРС, привело к развитию у одного пациента дистресс-синдрома, необходимости эндотрахеальной интубации и ИВЛ в течение 30 суток.
M. Uddin et al. наблюдали уросепсис у 91 (3,1%) из 2956 пациентов, перенесших ТРБП с 2002 по 2009 в Singapore General Hospital [25]. Этиологическим агентом в большинстве случаев (94%) являлась E.сoli. Рост резистентности этого уропатогена к ципрофлоксацину, 3-дневное применение которого являлось основным режимом антибиотикопрофилактики при ТРБП в период 2002 – 2004 гг., заставил в дальнейшем отказаться от препарата и назначать антибиотики других групп. Авторы исследования обращают внимание на отсутствие простых и однозначных профилактических режимов при ТРБП и необходимость выбора антибиотиков на основании регулярного бактериологического мониторинга, что позволит минимизировать опасность развития уросепсиса, вызванного мультирезистентными микроорганизмами. Клиническое значение увеличивающейся резистентности уропатогенов к ципрофлоксацину отметили в своем недавнем исследовании и специалисты из Южной Кореи [26]. В целях антимикробной профилактики при ТРБП 2013 пациентам перед операцией внутривенно вводили ципрофлоксацин. Несмотря на это, уросепсис развился в 9 (0,4%) случаях. При бактериологическом исследовании крови у всех 9 пациентов была обнаружена E.сoli, резистентная к ципрофлоксацину. Помимо этого, в 8 случаях отмечена резистентность уропатогена к ампициллину и в 7 случаях – к гентамицину. У одного пациента была выделена E.сoli, продуцирующая БЛРС.
Развитие инфекционно-воспалительных осложнений после ТРБП может быть обусловлено в ряде случаев нозокомиальной микрофлорой [27, 28]. K. Olshtain-Pops и соавт. наблюдали 4 пациентов с пиурией и лихорадкой, которые возникли через 3 дня после ТРБП. Были выполнены бактериологические исследования мочи, крови пациентов, смывов с оборудования и инструментов, а также флакона с гелем для УЗИ. Посев крови и мочи выявил рост грамотрицательного микроорганизма Achromobacter xylosoxidans (Alcaligenes xylosoxidans). По мнению авторов, источником инфицирования у этой группы пациентов являлся нестерильный флакон с гелем для УЗИ. На основании полученных данных при выполнении ТРБП для обработки ультразвукового датчика показано использование только стерильного геля [28].
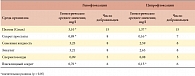
Многие авторы полагают, что новые фторхинолоны, в том числе левофлоксацин, остаются высокоэффективными препаратами для антибактериальной профилактики инфекционных осложнений при проведении биопсии простаты. Выбор препарата для антибиотикопрофилактики при ТРБП во многом зависит от его фармакокинетики и способности создавать высокий уровень накопления в тканях во время процедуры. Левофлоксацин отвечает этим требованиям, поскольку концентрация действующего вещества в предстательной железе в 4 раза превышает его концентрацию в плазме крови [29]. Исследования фармакокинетики ципрофлоксацина и левофлоксацина продемонстрировали преимущество последнего (более высокую концентрацию в простатическом секрете), что позволяет рекомендовать левофлоксацин в качестве альтернативного препарата для профилактики бактериального простатита при ТРБП (табл. 1) [30, 31]. Применение левофлоксацина в однократной дозе 500 мг позволило снизить уровень развития ИМП до 0,25% у 400 больных, перенесших ТРБП [32]. В другом исследовании среди 457 пациентов, принимавших 200 мг левофлоксацина 2 раза в день в течение 4 суток (первый прием за 12 часов до биопсии), острый простатит после ТРБП развился у 6 (1,3%) больных, причем 4 из них выполнялась повторная биопсия. Бактериологические исследования выявили у этих пациентов наличие E.coli, резистентной к левофлоксацину [33].
Назначение фторхинолонов после ТРПБ остается эффективным методом антимикробной профилактики инфекционных осложнений, связанных с процедурой. Это подтвердил анализ 1273 подобных манипуляций, после которых пациенты получали левофлоксацин или гатифлоксацин. Количество инфекционных осложнений составило 31 (2,4%), вместе с тем авторы исследования отмечают, что в половине случаев причиной их развития было наличие микрофлоры (89% E.сoli), резистентной к фторхинолонам [34]. Недавно проведенное в Японии проспективное рандомизированное исследование эффективности левофлоксацина и другого нового фторхинолона – тозуфлоксацина – в антимикробной профилактике инфекции мочевыводящих путей после трансректальной биопсии простаты показало, что назначение 200 мг левофлоксацина за 2 часа до процедуры и дальнейшее его применение по 200 мг 2 раза в сутки в течение 48 часов не уступает по эффективности новым фторхинолонам [35]. Целью исследования, проведенного в урологической клинике МГМСУ, являлась разработка оптимальной схемы подготовки пациента к трансректальной биопсии предстательной железы для снижения частоты развития мочевой инфекции [36]. Для достижения указанной цели авторы сравнили эффективность применения левофлоксацина и очистительной клизмы, используемых в различных режимах и сочетаниях. В клинике урологии МГМСУ 108 пациентов путем случайной выборки были разделены на 4 группы:
- Левофлоксацин в дозе 500 мг внутрь за 2 ч до биопсии и очистительная клизма;
- Только очистительная клизма;
- Левофлоксацин в дозе 250 мг 1 раз в сутки внутрь в течение 5 дней;
- Левофлоксацин в дозе 250 мг 1 раз в сутки внутрь в течение 48 часов.
Показания к биопсии были обычными: повышение уровня ПСА выше 4 нг/мл и/или изменения простаты при пальцевом ректальном исследовании. Средний возраст обследованных пациентов составил 64,4 года. Средний уровень ПСА – 15,8 нг/мл. Биопсия выполнялась из 6-18 точек под ультразвуковым и пальцевым контролем в амбулаторных и стационарных условиях. Поскольку, по нашим данным, а также данным зарубежных авторов, частота инфекционных осложнений не зависит от количества пункций при биопсии, мы не рассматривали взаимосвязь указанных параметров. Однако число больных с различным количеством точек при биопсии оказалось примерно одинаковым во всех 4 группах.
Из исследования были исключены пациенты, принимавшие какие-либо антибактериальные препараты за 2 недели до биопсии, больные с иммуносупрессивными состояниями, перенесшие недавно (в течение 3 месяцев) инфекции мочевой системы, а также пациенты с постоянным катетером, протезами клапанов сердца и т. д. Прием левофлоксацина начинался за 2 ч до биопсии, при длительном приеме препарат принимался по 250 мг каждые 24 ч. Очистительная клизма выполнялась в 22:00 накануне исследования и за 2 ч до биопсии. Оценка бактериурии в средней порции мочи проводилась до биопсии, через 48 ч и 5 дней после манипуляции. В течение 3 суток после биопсии все пациенты 3 раза в день измеряли температуру тела (ее повышение расценивалось как проявление бактериемии). До биопсии и через 5 суток после ее проведения бактериурии не было ни у одного из пациентов. У всех лихорадящих больных гипертермия была купирована не позже, чем к 3–4-му дню (случаев уросепсиса, абсцессов предстательной железы не наблюдалось).
Проведенное исследование позволило сделать вывод, что при выполнении трансректальной мультифокальной биопсии предстательной железы профилактическое назначение антибактериальных средств показано всем пациентам даже при отсутствии факторов риска развития мочевой инфекции. Согласно ранее проведенным в клинике урологии МГМСУ исследованиям, у больных, имевших в анамнезе инфекции мочеполовой системы (простатит, орхит, эпидидимит, уретрит) риск развития какого-либо осложнения (гематурии, острой задержки мочи) был выше в 1,8 раза, а риск возникновения инфекционных осложнений возрастал в 8,3 раза по сравнению с пациентами с неотягощенным урологическим анамнезом. Интересно то, что не было обнаружено существенной разницы между назначением левофлоксацина в течение 48 ч и в течение 5 дней после биопсии, но этот факт требует дальнейшего изучения. Следует отметить, что пероральный прием левофлоксацина в различных дозах оказался высокоэффективным для профилактики инфекционных осложнений такой часто осуществляемой процедуры, как ТРБП [25].
Таким образом, опыт клиники урологии МГМСУ и опубликованные результаты других исследований позволяют считать пероральный прием левофлоксацина (Таваник®) высокоэффективным методом профилактики инфекционных осложнений при ТРБП. Вместе с тем, в условиях роста резистентности микрофлоры в настоящее время необходимо дальнейшее регулярное изучение и мониторирование клинической и микробиологической эффективности режимов антимикробной профилактики. Не вызывает сомнений, что по мере развития фармакологии и появления новых лекарственных препаратов поиск новых режимов антибиотикопрофилактики будет продолжаться.Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.