Современный взгляд на возможности терапии ревматоидного артрита на доклинической стадии
- Аннотация
- Статья
- Ссылки
- English
Введение
Ревматоидный артрит (РА) представляет собой хроническое аутоиммунное заболевание, поражающее костно-мышечную систему и в некоторых случаях внутренние органы. Согласно результатам эпидемиологических исследований, распространенность РА составляет 0,5–1,0% [1].
Социально-экономическое бремя РА обусловлено как снижением качества жизни пациентов, так и ростом прямых и непрямых медицинских затрат, что подчеркивает необходимость оптимизации терапевтических подходов.
Ключевым направлением для решения этой проблемы является раннее начало терапии, так называемое окно возможностей. Окно возможностей – временной интервал, в котором фармакологическое вмешательство обеспечивает максимальную эффективность в предотвращении структурных повреждений суставов и достижении клинической ремиссии заболевания. Клинические исследования демонстрируют, что своевременная иммуносупрессивная терапия может изменять течение болезни, снижая риск прогрессирования патологического процесса и улучшая долгосрочные исходы [2].
Дополнительным доказательством важности ранней терапии служит стратегия лечения до достижения цели (treat-to-target), предполагающая стандартизированный подход к достижению определенных терапевтических целей, таких как ремиссия или низкая активность заболевания. Согласно данным литературы, стратегия лечения до достижения цели ассоциирована с более высокими показателями устойчивой ремиссии по сравнению с традиционной терапией [3, 4]. Это дает возможность в дальнейшем снизить дозу препаратов или временно приостановить лечение в период устойчивой ремиссии [5]. Однако в реальной клинической практике лишь 30–40% пациентов достигают ремиссии или низкой активности заболевания [6].
Таким образом, концепция первичной профилактики, предполагающая лечение заболевания до его полного проявления, представляется многообещающей. Фармакологическая терапия на доклинической стадии РА или при высоком риске его развития направлена на то, чтобы воспрепятствовать началу и прогрессированию заболевания в долгосрочной перспективе.
Известно, что повышенные уровни сывороточных аутоантител, включая антитела к цитруллинированному пептиду (АЦЦП) и/или ревматоидный фактор (РФ), могут обнаруживаться задолго до клинической манифестации РА [7]. Серологические отклонения отмечаются как при бессимптомном течении патологии, так и при артралгии без клинически значимого воспаления суставов. Такое состояние, определяемое как фаза серологической предрасположенности, получило название «риск развития РА» (risk of RA), или «доклиническая стадия РА».
Профилактические вмешательства на доклинической стадии
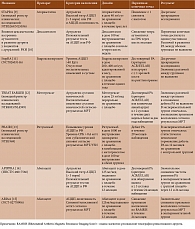
За последнее десятилетие были проведены исследования разных терапевтических тактик, применение которых потенциально возможно на доклинических стадиях РА (таблица) [8–15]. В частности, изучена эффективность статинов, дексаметазона, базисных противовоспалительных препаратов (БПВП) и генно-инженерных биологических препаратов (ГИБП), а также немедикаментозных стратегий, в том числе модификации образа жизни.
Медикаментозные методы
Статины. Согласно результатам рандомизированного плацебо-контролируемого исследования TARA, добавление аторвастатина к стандартной терапии БПВП снижает активность заболевания, оцениваемую по Disease Activity Score 28 (DAS28), у пациентов с установленным диагнозом РА [16]. Обратная корреляция между использованием статинов и риском развития РА также была выявлена G. Chodick и соавт. при проведении общенационального когортного исследования в Израиле [17].
В ходе многоцентрового сравнительного плацебо-контролируемого исследования STAPRA оценивалась эффективность аторвастатина у лиц с РА на доклинической стадии и положительным серологическим статусом (АЦЦП+/−РФ+) [9]. После одного года лечения и двух лет наблюдения первичная конечная точка (прогрессирование до РА по DAS44) достигнута у 29% в группе аторвастатина и 19% в группе плацебо (отношение рисков (ОР) 1,4 при 95%-ном доверительном интервале (ДИ) 0,5–3,95). Исследование было преждевременно прекращено из-за меньшего, чем ожидалось, количества участников – 62 из первоначально запланированных 220 пациентов. В этой небольшой группе лиц с высоким риском развития РА не удалось продемонстрировать защитного эффекта аторвастатина, однако ограниченная мощность анализа не позволяет сделать окончательные выводы.
Дексаметазон. В рамках голландского многоцентрового рандомизированного плацебо-контролируемого исследования (n = 83) оценивалось влияние двух курсов дексаметазона, вводимого внутримышечно в дозе 100 мг с интервалом шесть недель, на клинические проявления у серопозитивных по АЦЦП и/или РФ пациентов с артралгией. На 24-й неделе значимого снижения уровней аутоантител не зафиксировано. В ходе последующего наблюдения (медиана – 26 месяцев) заболеваемость РА в группах оказалась сопоставимой: 20% в группе дексаметазона и 21% в контрольной группе (p = 0,89) [10].
Полученные данные свидетельствуют об отсутствии профилактической эффективности дексаметазона в указанной дозе на доклинической стадии РА у серопозитивных лиц. Однако ограниченная мощность исследования и гетерогенность выборки не позволяют исключить возможность потенциального терапевтического эффекта в определенных субпопуляциях пациентов.
Базисные противовоспалительные препараты. StopRA – многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование, проведенное в США, по оценке эффективности 12-месячной терапии гидроксихлорохином (ГХ), адаптированной к массе тела, у пациентов с повышенным уровнем АЦЦП (> 40 Ед/л) и отсутствием клинически значимого синовита или пальпируемого выпота в суставах [11]. Данный препарат, обладающий иммуномодулирующим, противовоспалительным и антипролиферативным свойствами, широко используется не только в ревматологии, но и в других областях клинической медицины [18].
Промежуточные результаты исследования StopRA были представлены на заседании экспертов Американской коллегии ревматологов (American College of Rheumatology, ACR) в 2022 г. [11]. Так, с апреля 2016 г. по ноябрь 2022 г. рандомизированы 144 пациента, 142 из которых были включены в окончательный анализ. За трехлетний период наблюдения у 41 (29%) участника исследования диагностирован РА. На 36-м месяце наблюдения исследование было прекращено досрочно в связи с отсутствием статистически значимой разницы в частоте развития РА между группой ГХ и контролем (34 и 36% соответственно; p = 0,844). Таким образом, полученные данные не подтвердили профилактическую эффективность ГХ у серопозитивных пациентов с РА на доклинической стадии. Однако ограниченная выборка и гетерогенность группы требуют дальнейших исследований для оценки терапевтического потенциала в специфических субпопуляциях пациентов.
В голландском многоцентровом рандомизированном плацебо-контролируемом исследовании TREAT EARLIER оценивался эффект 12-месячного курса метотрексата (МТ) в дозе ≤ 25 мг/нед применяемого перорально, в комбинации с однократной внутримышечной инъекцией глюкокортикостероидов (ГКС) (120 мг преднизолона) на манифестацию и активность РА у пациентов с артралгией и субклиническими признаками артрита по данным магнитно-резонансной томографии (МРТ) [12]. Длительность наблюдения составила 24 месяца. Первичной конечной точкой исследования служил дебют РА, определяемого либо по совместным критериям Американской коллегии ревматологов и Европейского альянса ревматологических ассоциаций (European Alliance of Associations for Rheumatology, EULAR) 2010 г., либо по наличию двух и более опухших и болезненных суставов в течение не менее двух недель. Частота указанного события оказалась сопоставимой в группах: 19% (23/119) в группе активного лечения и 18% (21/117) в контрольной группе (ОР 0,81 (95% ДИ 0,45–1,48)). В отношении вторичных конечных точек в группе лечения по сравнению с группой плацебо отмечено достоверное функциональное улучшение в первые четыре месяца, а также более выраженное снижение интенсивности боли, утренней скованности и воспалительных изменений по результатам МРТ.
Таким образом, несмотря на то что применение комбинации МТ и ГКС не позволило предотвратить развитие РА, клиническое течение заболевания было модифицировано. Полученные данные указывают на паллиативный, но не на профилактический эффект применяемой терапии у серопозитивных пациентов с доклинической стадией РА.
Генно-инженерные биологические препараты. Ревматоидный артрит традиционно рассматривается как типичный пример системного аутоиммунного воспалительного заболевания, характеризующегося дисрегуляцией В- и Т-клеточного иммунного ответа. В связи с этим ряд клинических испытаний был направлен на оценку профилактической эффективности терапии, модулирующей клеточные звенья аутоиммунного ответа, на доклинических стадиях заболевания.
Многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование PRAIRI было посвящено влиянию моноклональных антител к CD20 (ритуксимаба (РТМ) в дозе 1000 мг внутривенно) на прогрессирование болезни у 81 пациента с доклинической стадией серопозитивного РА (положительные результаты тестов на АЦЦП и/или РФ, артралгия, повышение уровня С-реактивного белка (СРБ) > 0,6 мг/л или субклинический синовит по данным магнитно-резонансной томографии/ультразвукового исследования (УЗИ), но без клинических признаков выраженного артрита) [13]. Все участники исследования также получали 100 мг метилпреднизолона внутривенно. В качестве первичной конечной точки выбрано развитие клинически манифестирующего артрита (два и более опухших и болезненных сустава) в течение 29 месяцев наблюдения. Различий по данному показателю между группами не выявлено: 34% (14/41) в группе РТМ и 40% (16/40) в контрольной группе (p = 0,54). Однако вторичный анализ показал, что в течение 12 месяцев РА прогрессировал у 75% пациентов в группе активного лечения по сравнению с контрольной группой (ОР 3,1 (95% ДИ 1,8–5,4); p < 0,0001), что указывает на ускорение дифференцировки в синовиальную патологию при использовании анти-B-клеточной терапии. Частота побочных эффектов в группе РТМ была выше, однако все они носили легкий или умеренный характер и не требовали прекращения лечения.
Полученные данные не подтверждают профилактическую эффективность РТМ у пациентов с РА на доклинической стадии. Более того, наблюдаемое ускорение прогрессирования заболевания требует осторожности при применении анти-B-клеточных препаратов в этой группе больных [13].
Недавно опубликованные результаты международного многоцентрового исследования APIPPRA, проведенного в Великобритании и Нидерландах в 2024 г., впервые продемонстрировали успех в профилактике РА на доклинической стадии. Исследование включало 146 серопозитивных пациентов с РА на доклинической стадии (артралгия в сочетании с уровнем АЦЦП, в три раза и более превышающем верхние границы референсных значений, и/или положительным РФ) [14]. Участники исследования были рандомизированы для получения подкожных инъекций абатацепта (АБЦ) еженедельно или плацебо в течение 12 месяцев, после чего следовало 12-месячное наблюдение в отсутствие терапии. Первичной конечной точкой стало развитие клинически выраженного артрита, определяемого как три и более опухших сустава или соответствие критериям ACR/EULAR 2010 г. Через 12 месяцев заболеваемость РА составила 6% (4/68) в группе АБЦ и 29% (20/69) в контрольной группе (p < 0,001). На 24-й месяц первичная конечная точка достигнута у 25% (17/68) и 37% (26/69) соответственно (p = 0,044). Сниженный риск прогрессирования патологического процесса сохранялся после завершения терапии, что указывает на потенциальную эффективность АБЦ. Нежелательные явления встречались редко, при этом с одинаковой частотой в обеих группах.
Данные исследования APIPPRA подкрепляются результатами немецкого многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования ARIAA [15]. Участники исследования были рандомизированы для получения еженедельных инъекций АБЦ в дозе 125 мг подкожно (n = 49) или плацебо (n = 49) в течение шести месяцев. За периодом активного лечения следовал период 12-месячного наблюдения без терапии. Первичной конечной точкой считалось улучшение параметров воспаления по результатам МРТ (синовит, тендовагинит, остеит), определяемое как снижение суммарного балла воспаления на один пункт и более от исходного. Через шесть месяцев первичная конечная точка достигнута у 57% пациентов в группе АБЦ и 31% пациентов в группе плацебо (p = 0,006). Прогрессирование до РА зарегистрировано у 35% (17) пациентов в контрольной группе и 8% (4) пациентов в группе активного лечения (p = 0,0016). Несмотря на прекращение терапии, различия в частоте прогрессирования и степени МРТ-выявленного воспаления на этапе наблюдения сохранялись (p = 0,018). Нежелательные явления были сопоставимыми в обеих группах.
Таким образом, согласно результатам рандомизированных контролируемых исследований (РКИ), краткосрочное применение АБЦ на доклинической стадии РА приводит к значительному снижению субклинического воспаления и задержке его клинической манифестации. Полученные результаты указывают на возможность иммуномодуляции на ранних этапах патогенеза с сохранением эффекта после завершения курса терапии.
Немедикаментозные методы
Значительное внимание уделено наблюдательным (когортным и продольным) исследованиям, в которых анализировалось влияние модифицируемых факторов образа жизни на риск прогрессирования РА.
Одним из немногих изученных модифицируемых факторов, влияющих на риск развития РА, является курение. Анализ результатов проспективных когортных исследований показал, что через 10–20 лет после отказа от курения ОР развития РА у бывших курильщиков достигает уровня, сопоставимого с уровнем у никогда не куривших [19, 20]. В шведском когортном исследовании подтверждена обратная корреляция между временем воздержания от курения и риском РА, особенно у пациентов с АЦЦП-позитивной формой заболевания [21].
Согласно данным крупного проспективного исследования (238 506 участников, 40 лет наблюдения), проведенного X. Liu и соавт., курение ассоциировалось с повышенным риском развития РА (ОР 1,47 (95% ДИ 1,27–1,72)), в том числе серопозитивного (ОР 1,67 (95% ДИ 1,38–2,01)) [22]. Риск развития РА снижался на 30% через 20 лет после отказа от курения (p = 0,009). Следует отметить, что даже через 30 лет после отказа от курения сохранялся умеренный риск развития РА (ОР 1,25 (95% ДИ 1,02–1,53)), что предполагает наличие долгосрочных иммунологических изменений, индуцированных никотином.
Эти данные подтверждают гипотезу о том, что курение усугубляет антицитруллиновый иммунный ответ, лежащий в основе патогенеза АЦЦП-ассоциированного РА. Тем не менее наблюдательный формат исследований ограничивает возможность установления причинно-следственных связей. Проведение РКИ по профилактике РА путем отказа от курения представляется маловероятным из-за этических и методологических сложностей, включая необходимость длительного наблюдения (≥ 10 лет) и большого размера выборки. С учетом сказанного могут оказаться полезными информационные программы, направленные на повышение осведомленности о связи курения с развитием РА [23].
Избыточная масса тела также рассматривается в качестве потенциального модификатора риска развития РА. Ожирение классифицируется как системное воспалительное состояние, при котором адипоциты секретируют повышенные уровни провоспалительных цитокинов, в частности фактора некроза опухоли альфа и интерлейкина 6, играющих ключевую роль в патогенезе РА и являющихся мишенями для современной терапии [24]. Кроме того, поскольку в жировой ткани происходит конверсия андрогенов в эстрогены, ожирение ассоциировано с относительной гиперэстрогенией, которая, как предполагается, также играет значимую роль в развитии РА [25].
Метаболические эффекты самого РА, такие как кахексия (потеря мышечной массы при сохранении или увеличении массы жира) и саркопения усложняют интерпретацию связи между индексом массы тела и риском возникновения заболевания. Индекс массы тела может выступать в качестве маркера не только ожирения, но и системных метаболических нарушений, связанных с РА. Кроме того, возможно синергетическое взаимодействие избыточной массы тела с другими метаболическими факторами, такими как диета и уровень физической активности, что требует дальнейшего изучения в контексте многофакторной профилактики развития РА. Таким образом, коррекция избыточной массы тела потенциально может рассматриваться как инструмент профилактики формирования РА у предрасположенных к нему лиц [26].
Здоровый образ жизни, включающий повышенное потребление полиненасыщенных жирных кислот омега-3 (≥ 250 мг/сут), ограничение употребления этанола (< 10 г/сут), снижение потребления кофеина (< 200 мг/сут) и исключение сахаросодержащих напитков, коррелирует с более низкой заболеваемостью РА [26]. Согласно данным литературы, у пациентов с доклинической стадией РА повышение приверженности к средиземноморской диете ассоциировалось со снижением риска развития РА на 21% (ОР 0,79 (95% ДИ 0,65–0,96)) [27]. Этот эффект был более выражен у лиц мужского пола и серопозитивных пациентов.
Протективная роль физической активности была оценена в нескольких проспективных исследованиях, результаты которых оказались неоднозначными. В одном из крупных когортных исследований (n = 30 112) сообщалось о снижении риска РА у женщин, занимавшихся более 20 минут в день (более одного часа в неделю) физической активностью (ходьба, велосипед, домашняя работа), по сравнению с менее активными респондентками (ОР 0,62 (95% ДИ 0,42–0,92)) [28].
В проспективном исследовании, проведенном X. Liu и соавт., с помощью стандартизированных опросников оценивалось влияние рекреационной физической активности на развитие РА [29]. В исследовании приняли участие 113 366 женщин. Период наблюдения составил 26 лет. Участницы исследования предоставили данные о времени, еженедельно затрачиваемом на физическую активность, включая ходьбу, бег трусцой, бег, езду на велосипеде, плавание, теннис и аэробные тренировки. Увеличение совокупного объема физической активности ассоциировалось со статистически значимым снижением риска развития РА по сравнению с низким объемом физической активности (ОР 0,67 (95% ДИ 0,47–0,98)). Доля эффекта, обусловленного снижением индекса массы тела, составила 14,0% (p = 0,002) для общего риска развития РА и 20,0% (p = 0,001) для риска развития серопозитивного РА.
Однако в других исследованиях значимой связи между физической активностью и риском возникновения РА не зафиксировано, что может быть связано с ограниченной мощностью для обнаружения минимального эффекта или гетерогенностью методов оценки активности патологического процесса [30].
Таким образом, совокупные данные указывают на потенциальную профилактическую роль физической активности, однако механизм этого эффекта требует дальнейшего изучения. Для подтверждения причинно-следственной связи необходимы исследования с объективными инструментами измерения физической активности и биомаркеров воспаления.
Следует отметить, что большинство данных основаны на самоотчетах и требуют верификации в рамках проспективных контролируемых исследований. Тем не менее представленные ассоциации подчеркивают важность обучения корректным поведенческим и пищевым навыкам как компонента первичной профилактики РА, в первую очередь у пациентов с высокой степенью риска его развития.
Воздействие на кишечную микробиоту с помощью пробиотиков или трансплантации фекальной микробиоты рассматривается как потенциально эффективный подход к коррекции микробиоценоза и регуляции иммунных нарушений у лиц, предрасположенных к развитию РА [31]. На данный момент времени количество исследований, посвященных роли ориентированных на микробиоту вмешательств в патогенезе РА, недостаточно велико для вынесения обоснованного суждения. Однако предварительные данные указывают на их значимость как целевых механизмов для профилактической интервенции [32].
Применение пробиотиков демонстрирует противовоспалительный потенциал, однако его недостаточно для значимого снижения активности заболевания [31, 33]. Препараты, содержащие Lactobacillus casei, Bifidobacterium adolescentis и Prevotella histicola, находящиеся на стадии доклинической и клинической оценки, демонстрируют перспективы в профилактике развития РА [31]. Альтернативной стратегией считается трансплантация фекальной микробиоты, которая способна восстанавливать эубиоз кишечной микробиоты при аутоиммунных патологиях. Тем не менее опции, показавшие положительные эффекты в экспериментах на животных моделях, пока не внедрены в клиническую практику у людей.
Описан случай эффективного применения трансплантации фекальной микробиоты у пациента с РА, получавшего трансплантат от здорового донора (девочки восьми лет) [34]. Такое лечение сопровождалось снижением титра РФ с 314 до 136 Ед/мл, а также улучшением субъективных показателей активности болезни и функционального состояния.
Таким образом, модуляция микробиоты представляет собой перспективное направление в коррекции патологического воспаления и облегчения симптомов РА. Однако для верификации ее профилактической и терапевтической эффективности при данном заболевании требуется проведение масштабных контролируемых исследований.
Выводы
Концепция профилактики РА, основанная на применении лекарственного средства в виде единичной инъекции или краткосрочного курса терапии, представляет значительный научный и практический интерес. Потенциальная возможность предотвратить развитие заболевания позволяет не только минимизировать страдания пациентов, но и снизить социально-экономическую нагрузку на системы здравоохранения. В связи с этим ряд исследований был направлен на оценку фармакологических методов профилактики болезни на доклинической стадии. В испытания включали здоровых добровольцев, серопозитивных по РФ и АЦЦП, соответствующих критериям высокого риска развития РА, а также пациентов с артралгией. В качестве профилактических агентов оценивались статины, ГКС, БПВП и ГИБП.
Несмотря на привлекательность подхода, полученные данные пока не позволяют перейти от лечения клинически выраженного РА к ранней профилактике его манифестации. Исследования, в которых применялись аторвастатин, ГКС, БПВП (ГХ, МТ) и РТМ, не подтвердили долгосрочной эффективности этих методов в предотвращении манифестации аутоиммунного заболевания. Однако в некоторых испытаниях отмечено статистически значимое замедление прогрессирования суставного синдрома у пациентов, получавших активное лечение по сравнению с применением плацебо.
Наиболее обнадеживающие результаты в отношении профилактики развития РА были получены в двух клинических исследованиях – исследовании ARIAA и исследовании APIPPRA. В них оценивалось применение АБЦ – селективного модулятора Т-клеточной активности. Оба исследования показали статистически значимое снижение частоты манифестации РА на фоне применения АБЦ по сравнению с получением плацебо у пациентов с высоким риском развития заболевания. Данный эффект сохранялся в течение 24 месяцев наблюдения, что указывает на потенциальную долгосрочную эффективность данного подхода.
Однако следует подчеркнуть, что не у всех лиц, позитивных по РФ/АЦЦП или другим маркерам риска, симптомы прогрессируют до клинически выраженного РА. Это делает чрезвычайно важным предотвращение избыточной терапии, поскольку фармакологические вмешательства, особенно применение системных иммуномодуляторов, могут быть связаны с риском развития серьезных нежелательных явлений. Перед внедрением профилактических стратегий в клиническую практику необходим строгий анализ соотношения пользы и риска, в том числе оценка длительности действия препаратов и их влияния на качество жизни пациентов.
Для повышения точности прогноза в отношении манифестации РА и минимизации избыточного назначения терапии актуальным представляется пересмотр существующих моделей риска. Интеграция новых биомаркеров, таких как специфические субклассы АЦЦП или генетические варианты, может значительно улучшить прогностическую ценность моделей и увеличить эффект профилактических вмешательств. Это позволит целенаправленно назначать терапию пациентам с наиболее высокой вероятностью прогрессирования заболевания.
Не менее важным является учет субъективных характеристик пациентов. Хотя необходимость лечения возрастает при наличии артралгии и функциональных ограничений, как было продемонстрировано в исследовании TREAT EARLIER, у лиц, не испытывающих симптомов, приверженность к профилактике фармакологическими методами может быть низкой. Это подтверждается досрочным завершением исследования STAPRA из-за недостаточного набора участников. Отсутствие явных жалоб, вероятно, снижало готовность обращаться за медицинской помощью или соглашаться на прием препаратов даже с относительно благоприятным профилем безопасности, таких как аторвастатин.
На основании проведенного анализа рекомендуется проводить серологическую оценку у пациентов с полиартралгией кистей и/или стоп, а также при наличии воспалительной дефигурации сустава. У данной категории пациентов целесообразным представляется определение уровней РФ и АЦЦП. Массовый скрининг населения нецелесообразен, поскольку лишь у части лиц с повышенными титрами антител развивается РА. Важно отметить, что данные серологические маркеры обладают недостаточной чувствительностью и специфичностью для использования в качестве универсальных инструментов скрининга.
Пациенты с полиартралгией и серопозитивностью по РФ/АЦЦП, у которых исключены другие ревматические или дегенеративные заболевания (например, остеоартрит), должны рассматриваться как имеющие доклиническую стадию РА и находиться под наблюдением с целью выявления признаков воспалительного артрита, включая припухлость сустава. При подтверждении наличия припухших суставов следует поставить диагноз РА в соответствии с критериями ACR/EULAR и начать терапию, соответствующую международным и национальным рекомендациям.
С учетом представленных доказательств в текущей клинической практике не рекомендуются фармакологические вмешательства у лиц с серологическими или клиническими признаками риска развития РА вне рамок клинических исследований. Анализ данных показал, что краткосрочная терапия на доклинической стадии заболевания не предотвращает его прогрессирования. Таким образом, начало лечения должно быть строго ограничено подтвержденным диагнозом РА.
Концепция профилактики РА и недавние клинические исследования, в которых оценивалась эффективность БПВП и ГИБП у лиц с серологическими или клиническими признаками болезни, представляются важным этапом в развитии ревматологии. Эти исследования расширяют понимание патогенеза аутоиммунных заболеваний и возможностей раннего фармакологического вмешательства. Однако профилактика РА пока остается недостижимой в условиях широкой клинической практики. Для повышения эффективности профилактических стратегий необходимо дальнейшее совершенствование моделей оценки риска, включая интеграцию современных биомаркеров и молекулярных характеристик. Это позволит повысить прогностическую ценность моделей, минимизировать объем лечения и целенаправленно назначать терапию пациентам с наиболее высокой вероятностью прогрессирования заболевания. До тех пор, пока не будут разработаны более точные инструменты прогноза, применение фармакологических вмешательств у лиц с риском возникновения РА вне рамок контролируемых исследований не рекомендуется.
В настоящее время отсутствуют достоверные данные о влиянии комплексных нефармакологических вмешательств, направленных на модификацию множества изменяемых факторов риска развития РА. Интеграция программ повышения физической активности, коррекции питания, а также поведенческих стратегий, ориентированных на отказ от курения и улучшение стоматологического здоровья, может стать перспективным подходом к профилактике, замедлению или даже регрессу патологического процесса у лиц с серологическим или клиническим риском.
Для углубленного изучения механизма взаимодействия между фармакологическими и нефармакологическими вмешательствами в контексте профилактики манифестации РА необходимо проведение РКИ, учитывающих синергетический эффект комбинированных стратегий. Особое внимание следует уделять интеграции мультидисциплинарных моделей риска, включающих генетические полиморфизмы, иммунологические профили (например, уровень провоспалительных цитокинов) и характеристику микробиоты, которые могут уточнить прогноз индивидуального риска и повысить эффективность целевой профилактики.
Таким образом, хотя текущие данные демонстрируют определенный потенциал воздействия на ранних стадиях РА, их внедрение в клиническую практику должно основываться на строгом анализе соотношения пользы и риска, а также на результатах исследований, направленных на оптимизацию стратификации пациентов.
Конфликт интересов. Статья подготовлена в рамках научно-исследовательской работы ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», № государственного задания РК 125020301268-4. Исследование не имело спонсорской поддержки. Конфликт интересов отсутствует.
E.S. Aronova, PhD, B.S. Belov, MD, PhD, G.I. Gridneva, PhD
V.A. Nasonova Research Institute of Rheumatology
Contact person: Eugenia S. Aronova, eugpozd@mail.ru
Rheumatoid arthritis is a chronic autoimmune disease characterized by joint damage and systemic inflammatory processes. Early diagnosis and therapy, especially at the preclinical stage, are considered key to preventing structural damage and achieving remission. The window of opportunity concept emphasizes the importance of immunosuppressive therapy at the earliest stages of the disease, but the effectiveness of preventive interventions in patients with serological predisposition (elevated levels of antibodies to citrullinated protein, rheumatoid factor) remains limited. Despite the potential for immunomodulation at the preclinical stage, widespread use of preventive therapy is limited by the low predictive value of serological markers and the risk of adverse effects. Risk assessment models need to be improved, including through the integration of genetic, immunological, and metabolic biomarkers, for targeted therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.