Субдиабетическая гипергликемия: стратегия профилактики сахарного диабета
- Аннотация
- Статья
- Ссылки
- English
Проведенные исследования свидетельствуют о необходимости и эффективности терапии дисгликемии на стадии предиабета. Центральное место в медикаментозной коррекции указанных состояний занимает метформин. Эффективность и безопасность препаратов метформина доказана результатами многочисленных исследований.
Проведенные исследования свидетельствуют о необходимости и эффективности терапии дисгликемии на стадии предиабета. Центральное место в медикаментозной коррекции указанных состояний занимает метформин. Эффективность и безопасность препаратов метформина доказана результатами многочисленных исследований.
Сахарный диабет (СД) является одной из важнейших проблем здравоохранения. Это связано прежде всего с постоянно увеличивающимся, носящим катастрофический характер, опережающим все прогнозы темпом роста заболеваемости. Так, по данным Международной федерации диабета (International Diabetes Federation – IDF), на сегодняшний день в мире один человек из 11 страдает СД, что в абсолютных значениях составляет 415 млн. К 2040 г. количество больных увеличится до 642 млн (данные IDF за 2016 г.). Неуклонно повышается и ассоциированная с диабетом смертность. В 2015 г. зафиксировано 5 млн смертей вследствие СД (для сравнения – вследствие ВИЧ/СПИДа и туберкулеза умирает по 1,5 млн пациентов) [1].
В то же время благодаря улучшению качества медицинского обслуживания неуклонно увеличивается продолжительность жизни больных СД. Поэтому все чаще приходится решать проблемы осложнений СД. Их решение требует больших социальных, интеллектуальных и экономических затрат. Так, в 2015 г. в мире расходы здравоохранения на оказание помощи пациентам с СД превысили 650 млрд долларов США, 14 млрд – вклад Российской Федерации [1].
В структуре заболеваемости диабетом большая доля приходится на СД 2 типа – 85–95% случаев. Бессимптомное течение и, как следствие, позднее выявление вносят дополнительный вклад в увеличение частоты развития осложнений СД 2 типа, которые, как правило, обусловливают тяжесть заболевания и являются причиной высокой инвалидизации и смертности. Поражения сердца, почек, нервной системы, органов зрения остаются важнейшими нерешенными проблемами медицины всего мира, в особенности стран с низким и средним уровнем развития – более 80% смертельных случаев, ассоциированных с СД, зафиксировано именно в этих странах (информационный бюллетень Всемирной организации здравоохранения № 312). Макроангиопатией обусловлено приблизительно 70% смертей больных СД 2 типа. Доказано, что риск инфарктов при развитии СД повышается как у мужчин, так и у женщин – в 3,7 и 5,9 раза соответственно, риск кровоизлияния в мозг – в среднем в шесть раз. При этом более половины больных, которым впервые диагностирован СД 2 типа, уже имеют диабетические осложнения разных стадий [2]. Диабетическая нейропатия у таких пациентов отмечается в 60–90% случаев, диабетическая нефропатия – примерно в 41% [3]. Последняя через десять лет приводит к развитию почечной недостаточности. Ангиоретинопатия диагностируется у 38% больных СД. Заболевание не ассоциируется со смертельными исходами, однако повышает риск потери зрения в 25 раз [3].
Именно поэтому усилия ученых всего мира направлены на разработку способов оптимизации диагностики и медицинской помощи пациентам с СД 2 типа. Однако из поля зрения выпадают состояния, предшествующие развитию хронической гипергликемии.
Как известно, постановка диагноза СД осуществляется на основании уровня гликированного гемоглобина (HbA1c) или глюкозы в плазме. Показатели гликемии, превышающие нормальные, но не достигающие диагностических критериев, очень часто не учитываются. Однако в этой ситуации уже можно говорить о предиабете или предиабетической дисгликемии [4].
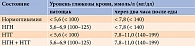
Нарушение метаболизма глюкозы развивается, как правило, за много лет до манифестации диабета. Прогрессирующая инсулинорезистентность на этапе дисгликемии приводит к компенсаторной гиперинсулинемии и гиперпроинсулинемии, которые какое-то время позволяют поддерживать уровень глюкозы. Наряду с этим нарушаются секретирующая функция бета-клеток и их способность поддерживать эугликемию [5]. В результате развиваются нарушение гликемии натощак (НГН) и/или нарушение толерантности к глюкозе (НТГ). При первом состоянии повышение уровня глюкозы не сопровождается увеличением постпрандиальной гликемии. При втором – повышается уровень постпрандиальной глюкозы при нормальном уровне глюкозы натощак. Необходимо отметить, что согласно отечественным клиническим рекомендациям комбинация указанных состояний также относится к НТГ [3]. В то же время Американская диабетическая ассоциация (American Diabetes Association – ADA) подразделяет НТГ на изолированную (при абсолютно нормальных значениях глюкозы натощак) и комбинированную НТГ и НГН (увеличение тощаковой и постпрандиальной гликемии, не достигающее диабетических значений) [4]. Интерпретация результатов перорального глюкозотолерантного теста для диагностики дисгликемии представлена в табл. 1 [4, 6].
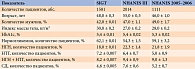
Распространенность предиабетических состояний изучена в ряде популяционных исследований. При анализе трех работ (более чем 4,5 тыс. обследованных) НТГ, НГН и их комбинация выявлены в среднем в 6, 21 и 9% случаев соответственно (табл. 2) [7].
Таким образом, очевидно, что распространенность дисгликемии существенно выше, чем распространенность выраженной гипергликемии, которая и верифицируется как СД. Следует также отметить, что у обследованных с субдиабетическими значениями глюкозы значения HbА1c соответствовали референсным, что еще раз подтверждает малоинформативность данного показателя при скрининге предиабета.
Необходимость верификации указанных нарушений продемонстрирована в нескольких исследованиях [6, 8, 9]. Доказано, что прогрессирование инсулинорезистентности и нарушение продукции инсулина приводят к развитию СД 2 типа. Около 70% лиц с НГН и/или НТГ подвержены указанному риску в будущем [6]. Результаты исследования DPP свидетельствуют, что ежегодно у 10% обследованных происходит манифестация СД [10]. При этом у лиц с комбинацией НТГ и НГН риск развития СД значительно выше – за три года СД диагностировался в 56% случаев. В группе НТГ этот показатель составил 34% [9]. Нормализация показателей глюкозы при сочетании НТГ и НГН наблюдалась в 18% случаев, только при наличии НТГ – в 32% [9].
Повышенный интерес ученых к дисгликемии обусловлен также риском поражения микро- и макрососудов, а также нервной системы. Так, субдиабетическое нарушение углеводного обмена признано фактором риска макроваскулярных катастроф. Речь, в частности, идет о миокардиальном инфаркте, инсульте и внезапной сердечной смерти [11, 12]. Концентрация кардиального тропонина, являющегося маркером острого коронарного синдрома [13], также была достоверно повышена при НТГ и СД – 6,4 и 10,8% пациентов соответственно по сравнению с 3,7% эугликемических обследованных [14]. Приведенные данные позволили сделать вывод о повышении сердечно-сосудистого риска и субклиническом повреждении сердца при дисгликемии.
Подтверждено также развитие микрососудистых осложнений при дисгликемии. Даже в отсутствие прогрессирования дисгликемии у 7,9% пациентов наблюдалось развитие ретинопатии. У больных СД частота встречаемости указанного осложнения составляет 12,6% [15]. Распространенность полинейропатии при НТГ – 13% случаев, НГН – 11%, манифестации СД – 28% случаев [16].
Следовательно, раннее нарушение углеводного обмена нельзя рассматривать как формальное, пограничное состояние перехода от нормогликемии к развитию СД. Дисгликемия сама по себе сопряжена с достоверным увеличением риска развития диабетических осложнений (нейропатии, ретинопатии) и ассоциированных с диабетом заболеваний (прежде всего сердечно-сосудистых). Поэтому, безусловно, наличие НТГ и НГН требует не только наблюдения за уровнем глюкозы пациентов, но и активных диагностических и лечебных мероприятий. Таким пациентам необходима также терапия артериальной гипертензии, дислипидемии и абдоминального ожирения. Эти заболевания часто сопутствуют дисгликемии и являются компонентами метаболического синдрома.
Рекомендации пациентам с СД 2 типа и предиабетом по сути аналогичны: немедикаментозная терапия, направленная на снижение массы тела [4, 17] (диета, повышение физической активности), и медикаментозная, направленная на лечение ожирения и коррекцию основного патогенетического звена СД 2 типа – инсулинорезистентности.
Таргетным препаратом для улучшения чувствительности к инсулину является метформин. Согласно существующим европейским, американским и российским стандартам он считается препаратом первой линии терапии СД 2 типа. Предиабетическая дисгликемия в большинстве стран не служит показанием для назначения препарата, однако в ряде национальных стандартов, например Польши, Турции и Филиппин, рекомендовано назначать метформин при предиабете. Обоснованием послужили результаты исследований механизмов действия метформина.
Антигипергликемический эффект метформина связан со снижением инсулинорезистентности, что приводит к уменьшению выработки глюкозы в печени [18, 19]. Препарат также способствует увеличению утилизации глюкозы мышцами, не повышая продукцию лактата и улучшая связывание инсулина с рецептором инсулина, активируя фосфорилирование и повышая активность тирозинкиназы рецептора к инсулину [20]. В гепатоцитах метформин активирует рецептор инсулина независимо от инсулина, что обусловлено влиянием на субстрат инсулинового рецептора [21]. Предполагают, что препарат воздействует на аденозинмонофосфат-активируемую протеинкиназу (AMПK) – сенсор клеточной энергетики, активируемый при метаболическом стрессе. Вследствие активации АМПК продукция глюкозы печенью подавляется. Это способствует улучшению чувствительности к инсулину и утилизации глюкозы мышцами, а также окислению жирных кислот. На активность АМПК также могут влиять физическая активность, отдельные гормоны, цитокины и медикаменты [22]. Активация метформином АМПК носит дозозависимый характер. Она приводит к подавлению ацетил-КоА-карбоксилазы и уменьшению экспрессии синтазы жирных кислот в гепатоцитах [23]. Препарат способен увеличивать инсулиннезависимую утилизацию глюкозы печенью [24].
Еще один механизм действия метформина обусловлен влиянием на инкретинзависимые механизмы регуляции метаболизма глюкозы. Установлено, что препарат увеличивает концентрацию инкретинов, в первую очередь глюкагоноподобного пептида 1 (ГПП-1), в значительной степени обусловливающего прандиальный инсулиновый ответ [25, 26]. Этот механизм можно объяснить и снижающейся под действием метформина активностью дипептидилпептидазы 4 – физиологического инактиватора ГПП-1 [26]. Метформин также может вызывать активацию экспрессии ГПП-1-рецепторов на поверхности бета-клеток поджелудочной железы [27].
Метформин положительно влияет на гомеостаз глюкозы путем коррекции инсулярных нарушений вследствие островковых амилоидных отложений. Известно, что накопление амилоида приводит к уменьшению массы бета-клеток. В результате снижается продукция инсулина. Препарат уменьшает активность и накопление этого белка [28].
Таким образом, положительное влияние метформина на метаболизм глюкозы не ограничивается коррекцией инсулинорезистентности. Он оказывает воздействие и на второй важнейший патогенетический механизм развития СД 2 типа и дисгликемии – нарушение синтеза инсулина, как базального (через островковый амилоид), так и стимулированного (через ГПП-1).
Кроме того, доказана способность метформина подавлять липогенез через независимые от аденозинмонофосфата пути регуляции формации адипоцитов.
Метформин положительно влияет на процессы остеогенной дифференцировки. Следовательно, может быть перспективным в терапии остеопороза и переломов костей [29, 30].
Как было отмечено выше, лица с НТГ и/или НГН относятся к группе высокого риска развития не только СД, но и сердечно-сосудистых патологий. Эффективность метформина в улучшении прогноза развития сердечно-сосудистых заболеваний продемонстрирована в исследовании UKPDS [31]: зафиксировано клинически значимое снижение риска целого ряда неблагоприятных сердечно-сосудистых событий, смертности от всех причин. За десять лет наблюдения отмечено уменьшение риска развития инфаркта миокарда на 39% [31]. Вне зависимости от уровня HbA1c метформин снижал частоту смертей, ассоциированных с СД, и инфарктов миокарда [32]. Результаты еще одного плацебоконтролируемого исследования также подтвердили улучшение прогноза относительно развития сердечно-сосудистой патологии у пациентов, получавших метформин [33].
Проводимое в настоящее время мультицентровое проспективное исследование GLINT должно окончательно установить степень эффективности метформина в профилактике сердечно-сосудистых исходов у лиц с предиабетом [34].
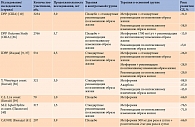
На данный момент собрана большая доказательная база в отношении антидиабетической эффективности метформина на стадии предиабета. Характеристика наиболее масштабных работ представлена в табл. 3 [35].
Наиболее интересным и продолжительным было исследование DPP [10], в котором приняло участие более 3 тыс. лиц с НТГ и, как следствие, очень высоким риском развития СД. Первая группа помимо выполнения стандартных рекомендаций по изменению образа жизни получала метформин, вторая – только немедикаментозное лечение. Контрольную группу составили лица с НТГ, получавшие плацебо. В основной части исследования (три года наблюдения) установлено, что по сравнению с группой плацебо риск манифестации СД в группе метформина снизился на 31%, в группе интенсивной модификации образа жизни – на 58%. Особый интерес вызывает анализ эффективности метформина внутри группы. Показано, что риск развития диабета снижался в большей степени у молодых участников исследования – пропорционально индексу массы тела и уровню глюкозы. Эффект терапии метформином у данных лиц оказался сравним с эффектом интенсивной модификации образа жизни [10]. По окончании этой части исследования DPP наблюдение за пациентами было продолжено (исследование DPP OS, длительность – семь лет). Результаты исследования DPP OS продемонстрировали, что сочетание метформина и интенсивной модификации образа жизни способствует снижению риска развития диабета на 13%. В отсутствие метформина указанный риск увеличился на 5% [36].
Таким образом, изменение образа жизни и прием метформина ассоциируются с достоверным уменьшением риска манифестации СД (34 и 18% соответственно) по сравнению с плацебо [36].
Аналогичные исследования A. Ramachandran и соавт. с участием более 500 лиц с предиабетом показали сопоставимый эффект метформина и изменения образа жизни. За два с половиной года риск развития СД в группах метформина, изменения образа жизни, метформина и модификации образа жизни снизился на 26,4, 28,5 и 28,2% соответственно по сравнению с контрольной группой [37].
В другом трехлетнем исследовании, проведенном Y. Wenying и соавт., получены одинаковые результаты в отношении снижения риска развития СД при терапии метформином и ингибитором альфа-глюкозидазы акарбозой: 88 и 87% соответственно. Интенсивное изменение образа жизни способствовало сокращению указанного риска только на 43% [38].
Протективные свойства метформина при НТГ подтверждены C.L. Li и соавт. [39]. Снижение риска развития СД в основной группе по сравнению с группой плацебо составило 66%.
M.Z. Iqbal Hydrie и соавт. у более чем трехсот человек с дисгликемией зафиксировали уменьшение риска развития СД в группах метформина и интенсивной модификации образа жизни – на 76,5 и 71% соответственно [40].
Интересные результаты получены и в исследовании CANOE. Эффект метформина в сочетании с росиглитазоном по снижению риска развития СД при НТГ превосходил эффект плацебо – -66% [41].
Приведенные данные стали поводом внесения изменений в отечественные рекомендации «Алгоритмы специализированной медицинской помощи больным сахарным диабетом» [3]. Именно поэтому пациентам группы риска развития СД 2 типа помимо активного изменения образа жизни (диеты и регулярной физической активности) показана также терапия метформином. Лицам с НТГ и НГН метформин назначается в дозе 250–850 мг два раза в сутки, особенно пациентам моложе 60 лет с индексом массы тела > 30 кг/м2 [3].
Сказанное выше позволяет утверждать, что единственным способом кардинально изменить ситуацию с катастрофическим ростом заболеваемости СД и ассоциированной с ним патологией является его профилактика. На стадии предиабета доказанной эффективностью в отношении снижения риска развития СД 2 типа среди медикаментозных методов лечения обладает только метформин. Препарат хорошо зарекомендовал себя на протяжении многих лет применения.
V.I. Novikov, K.Yu. Novikov
FSBEI HE ‘Smolensk State Medical University’
Contact person: Vladimir Ivanovich Novikov, endo@smolgmu.ru
Usually, impaired glucose metabolism develops many years before overt manifestations of diabetes mellitus. A risk of developing type 2 diabetes mellitus exists in approx. 70% persons with impaired fasting glycemia and glucose tolerance. Moreover, such conditions per se are associated with damaged micro- and macrovessels as well as nervous system.
Previous studies evidence about necessity and efficacy of treating dysglycemia at prediabetes stage. Metformin holds a central place in medicated correction of such conditions. Efficacy and safety of metformin was proved by the results from multiple studies.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.