Топическая цитокинотерапия при хроническом тонзиллите
- Аннотация
- Статья
- Ссылки
- English
В статье представлен клинический опыт патогенетически обоснованного применения средства Суперлимф® Л в топической терапии больных простой формой хронического тонзиллита. Результаты проведенного исследования свидетельствуют о клинической эффективности, безопасности применения и хорошей переносимости препарата.
В статье представлен клинический опыт патогенетически обоснованного применения средства Суперлимф® Л в топической терапии больных простой формой хронического тонзиллита. Результаты проведенного исследования свидетельствуют о клинической эффективности, безопасности применения и хорошей переносимости препарата.


Значительная распространенность тонзиллярной патологии, обусловленная воздействием неблагоприятных экологических, алиментарных и других факторов, которые могут приводить к дисрегуляции механизмов врожденного и адаптивного иммунитета, а также росту резистентности микроорганизмов к проводимой терапии, определяют актуальность проблемы и необходимость дальнейшего совершенствования методов лечения [1–3]. Наиболее распространенная патология глотки среди различных групп населения – хронический тонзиллит (ХТ) встречается у 5–37% взрослых, 15–63% детей. Самая высокая заболеваемость регистрируется в возрастной группе 16–20 лет [1, 4].
Небные миндалины являются основным рабочим звеном лимфаденоидного глоточного кольца Пирогова – Вальдейера, которое в свою очередь тесно связано с единой системой, получившей название MALT (в переводе с английского – лимфоидная ткань, связанная со слизистой оболочкой) [5]. Роль слизистой оболочки в поддержании гомеостаза макроорганизма крайне важна. Фактически это «линия соприкосновения», где идут постоянные «бои местного значения», цель которых защита от биологической агрессии (патогенных микроорганизмов, чужеродных веществ). Еще одна функция MALT – поддержание симбионтных отношений с нормальной микрофлорой и контролирование условно-патогенных микроорганизмов и комменсалов. Мукозальный иммунитет представляет собой многоуровневую защиту: слизь, эпителий, собственную пластинку слизистой оболочки, изолированные лимфоидные фолликулы. В MALT представлены клетки и гуморальные факторы как врожденного, так и приобретенного иммунитета. От сбалансированности этих факторов, своевременности развития иммунного ответа и его переключения с местного на системный зависят развитие заболевания, наличие, тяжесть и продолжительность осложнений [6].
Современные подходы к лечению ХТ минимизируют применение системных антибиотиков и отдают приоритет топическим антимикробным средствам. С учетом особенности строения небных миндалин одним из наиболее эффективных методов считается промывание лакун [7, 8]. Однако очевидно, что полной элиминации патогенов практически не бывает (биопленки позволяют выжить части микроорганизмов), а при наличии выраженных нарушений местного иммунитета они со временем вновь начнут активно размножаться или их вытеснят другие, возможно, более агрессивные возбудители. Длительная персистенция условно-патогенных микроорганизмов способствует дальнейшему нарастанию иммунной дисфункции и продолжению хронического воспалительного процесса [5]. Следствием любого длительного воспаления являются ремоделирование тканей, функциональная перестройка, развитие фиброза и склероза, что в итоге может привести к стойкой утрате функций органа. Поэтому применение при ХТ иммунотропных препаратов, особенно влияющих на мукозальный иммунитет, патогенетически обосновано [9–11].
К одним из первых зарегистрированных лекарственных средств, предназначенных для локальной иммунокоррекции, относится Суперлимф® – оригинальная отечественная разработка коллектива сотрудников кафедры иммунологии Российского государственного медицинского университета им Н.И. Пирогова. Субстанция представляет собой стандартизированный комплекс цитокинов (интерлейкин (ИЛ) 1, ИЛ-6, фактор некроза опухоли (ФНО) альфа, фактор, ингибирующий миграцию макрофагов (МИФ), трансформирующий фактор роста (ТФР)) и комплекс антимикробных пептидов (АМП). Доказано, что Суперлимф® стимулирует функциональную активность фагоцитирующих клеток, выработку клетками собственных цитокинов (ИЛ-1, ИЛ-6, ФНО-альфа, ТФР-бета), миграцию иммунокомпетентных клеток в очаг воспаления [9, 11, 12]. Кроме того, субстанция характеризуется наличием антимикробного (вероятно, за счет входящих в его состав АМП), противовоспалительного, антиоксидантного эффектов и способностью стимулировать процессы регенерации тканей [11]. Препарат хорошо зарекомендовал себя при лечении ран различного происхождения и инфекционно-воспалительных заболеваний урогенитального тракта [13–16]. В дальнейшем на основе данной субстанции были созданы новые средства, специально предназначенные для применения при воспалительных процессах в ротоглотке, в частности Суперлимф® Л в виде порошка для приготовления раствора. Появились сообщения о его эффективном использовании при заболеваниях пародонта и хроническом тонзиллите [11, 17, 18].
Цель данного исследования – оценить клиническую эффективность и безопасность средства Суперлимф® Л при лечении пациентов с простой формой ХТ.
Материал и методы
В исследовании участвовало 60 пациентов (36 женщин и 26 мужчин) в возрасте 18–60 лет (средний возраст – 36,1 ± 9,8 года) с простой формой ХТ, длительностью заболевания от трех до 20 лет.
Пациенты были распределены на две группы с учетом принципа рандомизации. 30 пациентам основной группы провели курс десяти промываний лакун миндалин средством Суперлимф® Л, 30 пациентам контрольной группы назначали 0,02%-ный раствор фурацилина. Группы не имели достоверных различий по демографическим показателям, клиническим характеристикам и сопутствующей патологии.
В ходе исследования проводились опрос больных – выявление жалоб, сбор данных анамнеза, инструментальный осмотр ЛОР-органов. Для оценки эффективности лечения, уточнения формы заболевания выполнялись лабораторное исследование (общий анализ крови, мочи, биохимический анализ крови, ревматоидные пробы – С-реактивный белок, ревматоидный фактор, антистрептолизин (АСЛ-О)), электрокардиограмма, бактериологическое исследование микрофлоры миндалин, cтрептатест на наличие бета-гемолитического стрептококка группы А.
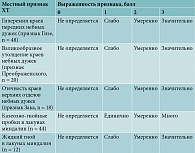
У 52 (86,7%) обследуемых отмечались местные признаки ХТ и перенесенные ранее ангины. У 8 (13,3%) больных с безангинной формой ХТ диагноз был установлен на основании четко выраженных местных признаков ХТ во время профилактического осмотра или при обследовании по поводу другого заболевания.
Критерии включения пациентов в исследование:
- перенесенная ранее ангина;
- боль при глотании;
- дискомфорт в горле;
- сухой глоточный кашель;
- гнойные пробки в миндалинах;
- неприятный запах изо рта;
- наличие двух и более местных признаков ХТ: казеозно-гнойные пробки или жидкий гной в лакунах миндалин, отечность верхних отделов небных дужек (признак Зака), гиперемия краев передних небных дужек (признак Гизе), валикообразное утолщение краев небных дужек (признак Преображенского), сращение и спайки миндалин с дужками.
Критерии исключения:
- острые воспалительные процессы или обострение хронических заболеваний во время исследования и в течение месяца перед исследованием;
- положительный результат стрептатеста;
- высокие титры АСЛ-О (> 200 МЕ/мл);
- новообразования глотки и гортани;
- иммунодефицитные состояния;
- аллергопатология;
- тяжелая коморбидная патология;
- сахарный диабет;
- беременность;
- грудное вскармливание.
Пациентам исследуемой группы выполнено десять промываний лакун миндалин раствором препарата Суперлимф® Л. Для приготовления однородного раствора порошкообразное содержимое флакона растворяли последовательно в 5 мл (во флаконе) и 40 мл физиологического раствора.
О клинической эффективности терапии судили по динамике выраженности клинических проявлений, интенсивности субъективной симптоматики, исходя объективной оценки воспалительных изменений слизистой оболочки ротоглотки при фарингоскопии, наличия или отсутствия нежелательных явлений.
Количественная оценка степени выраженности фарингоскопических признаков проводилась на первые, пятые, десятые и 15-е сутки наблюдения с помощью четырехбалльной шкалы (0 – признак отсутствует; 1 – слабо выражен; 2 – умеренно выражен; 3 – выражен значительно) по критериям, представленным в табл. 1.
Субъективная оценка пациентами степени выраженности фарингеальных жалоб – болевых, неприятных ощущений в горле и самочувствия проводилась по десятибалльной визуальной аналоговой шкале (ВАШ).
Отбор проб для бактериологического исследования содержимого лакун миндалин проводили стерильным тампоном диаметром 2–3 мм. Образцы биологического материала транспортировались в лабораторию в течение двух-трех часов и немедленно подвергались высеванию на специальные питательные среды.
Результаты
В течение длительного периода времени и на момент осмотра пациентов беспокоили боль в горле непостоянного характера (n = 38), дискомфорт в горле (n = 48) – неприятные ощущения сухости, першения, инородного тела, кома в горле, скопление вязкой слизи на задней стенке глотки, наличие гнойных пробок в небных миндалинах (n = 44), желание откашляться (n = 12), неприятный запах изо рта (n = 18).
На фоне проведенного курса лечения у всех пациентов основной группы, получавших топическую цитокинотерапию, наблюдались улучшение самочувствия, регресс клинической симптоматики (боль, дискомфорт в горле, воспалительные изменения в ротоглотке), более ранний и выраженный, чем в контрольной группе.
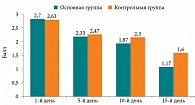
Согласно результатам субъективной оценки симптомов по ВАШ, у пациентов основной группы на первом визите выраженность болевого синдрома составила 2,7 ± 2,28 балла. В последующие дни (5-й, 10-й и 15-й) отмечалось снижение интенсивности болевых ощущений до 2,33 ± 2,06, 1,87 ± 1,95 и 1,17 ± 1,3 балла соответственно. В контрольной группе сумма баллов по интенсивности боли в горле составила 2,63 ± 2,36 (1-й день), 2,47 ± 2,25 (5-й день), 2,3 ± 2,2 (10-й день), 1,6 ± 1,69 (15-й день) (рис. 1, табл. 2).
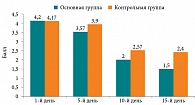
Степень дискомфорта – неприятных ощущений першения, сухости, инородного тела в горле в основной группе уменьшилась с 4,2 ± 2,41 (1-й день) до 3,57 ± 2,3 (5-й день) и 2,0 ± 1,57 балла (10-й день). На 15-е сутки степень слабовыраженного дискомфорта в горле составила 1,5 ± 1,31 балла. Сумма баллов по выраженности дискомфорта в горле в контрольной группе составила 4,17 ± 2,4 (1-й день), 3,9 ± 2,47 (5-й день), 2,57 ± 1,78 (10-й день), 2,4 ± 1,72 (15-й день) (рис. 2).
На фоне лечения препаратом Суперлимф® Л отмечался значительный регресс ощущения инородного тела, кома в горле – 70,83% случаев, галитоза – с 1,87 ± 2,99 балла в 1-й день до 0,57 ± 1,05 балла на 15-й день наблюдения.
При проведении курса топической цитокинотерапии наблюдалось очевидное уменьшение или купирование локальных признаков воспаления: очищение лакун миндалин от патологического содержимого после трех-четырех процедур, уменьшение воспалительных изменений – интенсивности гиперемии, отечности, инфильтрации краев небных дужек – 5–8 процедур (рис. 3, табл. 2). На 15-й день наблюдения зарегистрирована нормализация фарингоскопической картины у 9 (30%) пациентов.
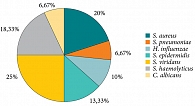
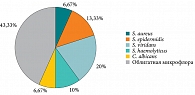
При микробиологическом исследовании содержимого лакун небных миндалин, проведенном у пациентов обеих групп до начала лечения, выявлен рост патогенной и условно-патогенной флоры в количестве 102–105 КОЕ/мл: Staphylococcus aureus (n = 12; 20,0%), Streptococcus pneumoniae (n = 4; 6,67%), Haemophilus influenzaе (n = 6; 10%), S. epidermidis (n = 8; 13,33%), S. viridans (n = 15; 25%), S. haemolyticus (n = 11; 18,33%), Candida albicans (4; 6,67%), в том числе ассоциации S. aureus – S. viridians (13,33%), C. albicans – S. viridans (6,67%) (рис. 4).
При контрольном микробиологическом исследовании после проведенного курса топической цитокинотерапии в основной группе отмечалось уменьшение микробной обсемененности небных миндалин: S. aureus (n = 2; 6,67%), S. epidermidis (n = 4; 13,33%), S. viridans (n = 6; 20%), S. haemolyticus (n = 3; 10%), C. albicans (n = 2; 6,67%). S. pneumoniae, H. influenzaе не высеивались. Отмечено сохранение облигатной флоры – в 43,33% случаев (рис. 5).
В контрольной группе видовой состав микрофлоры после проведенного курса не изменился: S. aureus (n = 6; 20%), S. pneumoniae (n = 2; 6,67%), H. influenzaе (n = 2; 6,67%), S. epidermidis (n = 5; 16,67%), S. viridans (n = 7; 23,33%), S. haemolyticus (n = 6; 20%), C. albicans (n = 2; 6,67%).
Ухудшения общего состояния, повышения температуры тела, аллергических, системных и местных побочных реакций во время наблюдения у пациентов не зарегистрировано. При лабораторном исследовании клинически значимые изменения не выявлены.
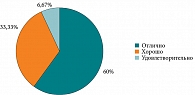
Переносимость средства Суперлимф® Л оценивалась пациентами «отлично» (n =18; 60%), «хорошо» (n = 10; 33,33%) и «удовлетворительно» (n = 2; 6,67%) (рис. 6).
При катамнестическом шестимесячном наблюдении у пациентов основной группы зафиксированы продолжительный клинический эффект проведенной терапии, отсутствие рецидивов заболевания. У 4 (13,3%) пациентов контрольной группы зарегистрированы обострения ХТ.
Обсуждение
Любой инфекционно-воспалительный процесс всегда сопровождается нарушением иммунорегуляции, прежде всего на уровне поврежденного органа. Одним из ключевых звеньев является дисбаланс продукции различных цитокинов, при котором нарушается кооперация иммунокомпетентных клеток, снижается эффективность иммунной защиты, что создает условия для перехода заболевания в хроническую форму. Цитокины, будучи своеобразными информационными молекулами, влияют практически на все основные клеточные функции, регулируют межклеточные взаимодействия, а цитокиновая сеть представляет собой систему управления, через которую иммунная система осуществляет дистанционную связь с другими системами организма. При введении экзогенных цитокинов происходит не только восполнение дефицита эндогенных, но и изменение их продукции собственными клетками, усиление экспрессии различных клеточных рецепторов, активация каскадов внутриклеточных сигнальных путей, а также усиление миграции в очаг воспаления нейтрофилов, тканевых макрофагов и лимфоцитов. В итоге развивается адекватный иммунный ответ, патологический процесс купируется [19].
Цитокинотерапия активно применяется во многих областях клинической медицины, однако чаще эти препараты вводят парентерально [20, 21]. Исключение составляют топические формы интерферона-альфа-2b, хорошо известные и врачам, и населению, и интерферона-гамма. Вместе с тем, поскольку цитокины преимущественно работают в очаге воспаления (не считая критических ситуаций, когда развивается системный воспалительный ответ с неконтролируемой продукцией цитокинов и их высокой концентрацией в кровеносном русле), локальное применение препаратов, содержащих цитокины, представляется наиболее целесообразным.
АМП относятся к очень важным факторам врожденного иммунитета. В последнее время интерес к ним неуклонно растет в связи с проблемой антибиотикорезистентности [1, 2, 5, 22]. Это низкомолекулярные (3,5–6,0 кДа) катионные пептиды с характерным высоким содержанием основных аминокислот (аргинина, лизина, гистидина), несущие положительный заряд. Как показывают многочисленные исследования, АМП высокоэффективны в отношении многих бактерий (в том числе синегнойной палочки), грибов рода Candida, а также некоторых вирусов (вирус папилломы человека, аденовирус, риновирус) [23–25]. Основной механизм антимикробного действия – электростатическое взаимодействие с цитоплазматической мембраной: благодаря своему положительному заряду дефензины взаимодействуют с анионными фосфолипидными мембранами бактериальной клетки – адсорбируются на отрицательно заряженной мембране, затем агрегируются и встраиваются в ее фосфолипидный бислой, нарушая структуру и функцию клеточной мембраны. В результате образуются мембранные поры и происходит лизис микробной клетки [25]. Показано, что АМП уменьшают прикрепление бактериальных клеток к субстрату, разрушают архитектуру биопленки и способны действовать на всех этапах жизнедеятельности биопленки, нарушают секрецию и/или взаимодействие между внеклеточными полимерами в матриксе, а также нейтрализуют токсины бактерий и биопленки [22, 23]. Наличие дисульфидных связей обеспечивает сохранение устойчивости молекул дефензинов к многочисленным лейкоцитарным и микробным протеазам и сохранение антимикробных свойств в очаге воспаления и тканевой деструкции [22]. Помимо прямого антимикробного действия эти пептиды являются хемоаттрактантами для моноцитов, незрелых дендритных клеток, Т-лимфоцитов, то есть выступают в роли связующего звена между врожденным и приобретенным иммунитетом. Это создает возможность для накопления в очаге воспаления иммунокомпетентных клеток с развитием эффективного адаптивного иммунного ответа [26].
Результаты данного пилотного исследования показывают, что локальное применение при ХТ средства, содержащего стандартизированную композицию из про- и противовоспалительных цитокинов и АМП (Суперлимф® Л), в качестве монотерапии, сопровождается отчетливой положительной клинико-лабораторной динамикой. Нормализация фарингоскопической картины к 15-му дню зафиксирована у 30% больных. В пробах из лакун небных миндалин частота выявления S. aureus уменьшилась с 20,0 до 6,7%, S. pneumoniae и H. influenzaе не высевались. Субъективно самочувствие пациентов также улучшилось согласно данным ВАШ. При шестимесячном наблюдении за пациентами рецидивов не зафиксировано. Таким образом, подход, направленный на коррекцию нарушений местного иммунитета, оказался правильным.
Как показывает многолетний опыт использования иммунотропных препаратов, их применение в сочетании с этиотропной терапией (антибиотиками, противогрибковыми или противовирусными лекарственными средствами) часто оказывается более эффективным, чем монотерапия. В связи с этим целесообразно продолжить исследования эффективности средства Суперлимф® Л при инфекционно-воспалительных заболеваниях ЛОР-органов в составе различных схем комплексной терапии.
Заключение
Клиническая эффективность средства Суперлимф® Л проявляется клинически значимым регрессом основных симптомов хронического воспалительного процесса, снижением степени микробной обсемененности лимфоидной ткани ротоглотки, достижением длительной ремиссии. Препарат отличается высоким профилем безопасности, хорошей переносимостью, отсутствием системных побочных эффектов и подтвержденной антимикробной активностью в отношении патогенной и условно-патогенной микрофлоры.
Применение средств на основе комплекса противовоспалительных цитокинов и АМП в качестве возможной альтернативы антибиотикам при инфекционных заболеваниях дыхательных путей представляется перспективным направлением, требующим дальнейших контролируемых исследований с использованием методов оценки биологической активности цитокинов, иммунохимического и молекулярно-биологического анализа.
Авторы заявляют об отсутствии конфликта интересов.
A.Yu. Ovchinnikov, PhD, Prof., S.S. Yegiyan, PhD, L.V. Akopyan, PhD
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Andrey Yu. Ovchinnikov, lorent1@mail.ru
Despite all the achievements of modern medicine, the treatment of chronic tonsillitis still remains an actual problem in otorhinolaryngology. This is largely due to an increase in antibiotic resistance, the number of immunocompromised individuals and underestimation of the importance of local immunity factors in the pathogenesis of the disease.
The article presents the clinical experience of pathogenetically justified use of the drug Superlymph in topical therapy of patients with a simple form of chronic tonsillitis. The results of the study indicate the clinical efficacy, safety of use and good tolerability of the drug.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.