Тромбоэмболия легочной артерии: принципы диагностики, антитромботическая терапия и профилактика
- Аннотация
- Статья
- Ссылки
- English
![Рис. 4. Мультидетекторная компьютерная ангиография: крупный тромб в главных ветвях легочной артерии [11]](/upload/resize_cache/iblock/022/195_350_1/022cdbc7de4307605ba3c9a1be4de585.jpeg)
Введение
Тромбоэмболия легочной артерии (ТЭЛА) занимает одно из ведущих мест в структуре сердечно-сосудистой заболеваемости и сопровождается высокой летальностью пациентов. ТЭЛА нередко является непосредственной причиной смерти при целом ряде тяжелых кардиологических и некардиологических состояний (сердечная недостаточность, злокачественные опухоли), а может возникать и без видимых предвестников у практически здоровых молодых людей – например, в результате иммобилизации при лечении травмы. С учетом патогенеза этого заболевания в лечении пациентов с ТЭЛА ключевую роль играет антитромботическая терапия. При ТЭЛА высокого риска важнейшую роль играет своевременное восстановление проходимости легочного русла, для чего в первую очередь используется фармакологическая реперфузия – тромболизис, с последующим назначением антикоагулянтов. При немассивных ТЭЛА антикоагулянтная терапия является основой лечения. Соблюдение стандартов вторичной профилактики, которая также проводится антикоагулянтными препаратами, обеспечивает резкое снижение вероятности рецидива ТЭЛА.
Кроме того, становится все более очевидным значение первичной профилактики, поскольку риск развития ТЭЛА повышается при целом ряде распространенных терапевтических и хирургических заболеваний. В то же время необходимость оценки риска ТЭЛА и адекватного назначения антикоагулянтов для первичной профилактики – вопрос, пока недостаточно хорошо освещенный отечественными, да и зарубежными стандартами.
Тромбоэмболия легочной артерии представляет собой острую тромботическую окклюзию ствола легочной артерии, ее главных, долевых или сегментарных ветвей, возникающую главным образом вследствие эмболизации из венозной системы или правых камер сердца. ТЭЛА и тромбоз глубоких вен нижних конечностей (ТГВ) часто объединяют общим термином «венозная тромбоэмболическая болезнь» (ВТЭ), поскольку оба состояния имеют общий патогенез и часто сосуществуют.
ТЭЛА – одно из самых распространенных сердечно-сосудистых заболеваний: например, в США регистрируют 600 000 случаев ТЭЛА в год, а случаев острого коронарного синдрома, для сравнения, – около 1,5 млн, при этом инфарктов миокарда с подъемом сегмента ST – около 300 000 [1, 2].
В развитых странах ТЭЛА занимает третье место среди причин сердечно-сосудистой смертности после инфаркта миокарда и инсульта. По данным регистра г. Мальмё (Швеция), ТЭЛА служит причиной 13% случаев смерти, причем прижизненно диагностируется лишь в 2% случаев. Диагноз ТЭЛА подтверждается у 10–35% пациентов, у которых он подозревался.
В 95% случаев источником ТЭЛА является система нижней полой вены (глубокие вены нижних конечностей и таза), в 1,5–2% – система верхней полой вены, в 3–15% – правое предсердие, правый желудочек или левое предсердие при наличии открытого овального окна, обычно при фибрилляции предсердий.
ТЭЛА (часто бессимптомную) обнаруживают при перфузионной сцинтиграфии легких у 50% пациентов с ТГВ нижних конечностей. В свою очередь ТГВ инструментально выявляют в 70% случаев ТЭЛА. В связи с этим, как упоминалось выше, для обозначения обоих состояний применяют единый термин ВТЭ [1].
Факторы риска ТЭЛА
Вероятность ТГВ повышается при наличии факторов классической триады Вирхова: повреждения венозного эндотелия (чаще в результате воспаления – флебита), замедления венозного кровотока, гиперкоагуляции. Состояния, сопровождающиеся повышенным риском ТГВ и ТЭЛА, перечислены в табл. 1 [1, 3, 4]. Отметим, что наличие сочетания факторов риска повышает категорию риска пациента. Например, злокачественная опухоль и химиотерапия по отдельности являются факторами среднего риска, но их сочетание приводит к высокому риску ВТЭ.
Наследственная предрасположенность к венозному тромбозу, в том числе ТЭЛА, может быть обусловлена целым рядом различных состояний и объединяется понятием тромбофилии. Среди основных причин тромбофилии выделяют следующие:
- мутация G1691А гена фактора V (Лейденская) – резистентность к активированному протеину С;
- мутация G20210А гена протромбина (фактора II);
- мутация с667Т гена метилентетрагидрофолатредуктазы;
- дефицит протеина С;
- дефицит протеина S;
- дефицит антитромбина III;
- дисфибриногенемия;
- гипергомоцистеинемия;
- повышение уровня факторов VIII, IX, XI.
Приблизительно у 20% пациентов ТЭЛА развивается в отсутствие факторов риска.
Краткие сведения о диагностике
Обычная последовательность диагностических действий при подозрении на ТЭЛА представлена в табл. 2.
Из клинических признаков наиболее постоянно при ТЭЛА наблюдаются одышка, тахипноэ и тахикардия. При массивной ТЭЛА могут выявляться физикальные признаки острой перегрузки правого желудочка – растяжение яремных вен, шум трикуспидальной регургитации, правожелудочковый ритм галопа. Однако большинство жалоб и объективных симптомов недостаточно чувствительны и малоспецифичны [5].
Для оценки клинической вероятности ТЭЛА предложено несколько количественных систем, в том числе пересмотренный Женевский алгоритм и алгоритм P.S. Wells [1].
ЭКГ- и рентгенологические признаки ТЭЛА представлены в табл. 3 [1, 5] и на рис. 1. Они характеризуются низкой чувствительностью (< 50%).
Компрессионная эхография вен нижних конечностей позволяет оценить наиболее типичные места тромбообразования системы нижней полой вены. Исследование выполняется билатерально в двух основных точках – паховой области и подколенной ямке. Основной критерий ТГВ – неполная компрессия вены. Чувствительность и специфичность методики в отношении ТГВ – более 90% [6].
D-димер является продуктом деградации перекрестносвязанного фибрина. Уровень его повышается (> 500 мкг/л) при наличии свежего тромба. Повышение D-димера неспецифично: оно также наблюдается при инфаркте миокарда, опухолях, инфекциях, травмах, расслаивающей аневризме аорты. Оценка D-димера является исследованием первого ряда при подозрении на ТЭЛА у гемодинамически стабильного пациента [1, 3, 7, 8].
Эхокардиография играет ключевую роль в экспресс-диагностике ТЭЛА, в первую очередь у пациентов с нестабильной гемодинамикой (артериальная гипотония, шок). С помощью эхокардиографии проводят дифференциальную диагностику с рядом состояний, сопровождающихся схожей клинической картиной: острым инфарктом миокарда, острой клапанной недостаточностью (или тромбозом протеза клапана), тампонадой перикарда, расслаивающей аневризмой аорты.
Косвенным признаком ТЭЛА, выявляемым при эхокардиографии, является перегрузка правых камер. При наличии гемодинамически значимой ТЭЛА выявляют ее косвенный признак – перегрузку правого желудочка давлением.
При косвенной диагностике ТЭЛА во время эхокардиографии оценивают следующие признаки перегрузки правого желудочка объемом и давлением [1, 9]:
- дилатация полости правого желудочка;
- D-образная форма левого желудочка по короткой оси;
- парадоксальное движение межжелудочковой перегородки;
- высокоскоростная трикуспидальная регургитация;
- признак Макконнелла: гипокинезия свободной стенки при нормальной сократимости верхушки правого желудочка.
При острой ТЭЛА часто не нарушается спадение нижней полой вены на вдохе, так как давление в правом предсердии может быть нормальным. Этот признак более типичен для хронической рецидивирующей ТЭЛА и может наблюдаться при ряде других заболеваний (перикардит, трикуспидальный стеноз и пр.).
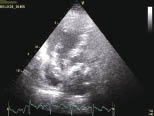
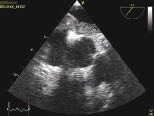
Помимо косвенных признаков острой перегрузки правого желудочка, эхокардиография позволяет непосредственно выявить тромбы в правых камерах, стволе и главных ветвях легочной артерии, особенно часто у гемодинамически нестабильных пациентов, и прямо подтвердить диагноз (рис. 2, 3). Выявление тромбоэмболов в правых камерах или легочной артерии («в ходу») является индикатором массивной ТЭЛА; смертность среди этих пациентов составляет 30% в течение 24 ч. Данная эхокардиографическая находка служит основанием для лечения по алгоритму ТЭЛА с высоким риском (см. ниже). Следует отметить, что наличие у таких пациентов открытого овального окна (рис. 3) служит противопоказанием к тромболизису из-за риска парадоксальной эмболии.
Используются три основные методики специализированной инструментальной диагностики ТЭЛА: вентиляционно-перфузионная сцинтиграфия легких, рентгеноконтрастная пульмонография, компьютерная ангиография системы легочной артерии (предпочтительно мультиспиральная) [10–12]. Все методики обладают высокой чувствительностью, наибольшая – около 98% – у мультиспиральной компьютерной ангиографии (МСКТ) с контрастированием, которая считается методикой выбора (рис. 4). Специфичность пульмонографии и вентиляционно-перфузионной сцинтиграфии легких при низкой клинической вероятности ТЭЛА относительно невысока (вероятны ложноположительные результаты). Методики оптимальны для диагностики ТЭЛА у стабилизированного пациента, однако общими их недостатками являются техническая сложность, большое время исследования и интерпретации результатов, необходимость транспортировки пациента из палаты интенсивной терапии. По этим причинам у наиболее тяжелых гемодинамически нестабильных пациентов с ТЭЛА их применение ограничено.
Оценка тяжести ТЭЛА и выбор тактики лечения
Согласно классификации Европейского общества кардиологов (European Society of Cardiology – ESC) (2008), выделяют ТЭЛА с низким, промежуточным и высоким риском. В клинической практике часто применяют классификацию, связанную с калибром пораженных артерий легочного русла: ТЭЛА мелких ветвей (< 30% легочного русла), субмассивная (30–50% легочного русла) и массивная (> 50% легочного русла) ТЭЛА, что, как правило, совпадает с соответствующими уровнями риска. Для оценки уровня риска ТЭЛА используют клинические маркеры, маркеры дисфункции правого желудочка и маркеры повреждения миокарда [1, 13, 14] (табл. 4).
Уровень мозгового натрийуретического пептида (BNP) и N-концевого фрагмента его предшественника (NT-proBNP) повышается при ТЭЛА в связи с растяжением правого желудочка.
Степень этого повышения пропорциональна тяжести состояния, но повышение этого маркера неспецифично (наблюдается при гипертрофии левого желудочка, тахиаритмиях, ишемии миокарда, сепсисе и пр.). Отсутствие значимого повышения (то есть B-NP < 50 пг/мл, NT-proBNP < 400 пг/мл) говорит о хорошем прогнозе ТЭЛА.
Повышение уровня сердечных тропонинов при ТЭЛА обычно небольшое. Примерно у половины пациентов с ТЭЛА уровень тропонина Т не превышает 0,5 нг/мл, и лишь у 4% он выше 2,5 нг/мл. Высвобождение тропонинов связывают с обратимым повреждением (растяжением) миокарда правого желудочка – при этом в кровоток попадает тропонин цитозольного пула, которого в кардиомиоцитах немного – от 3 до 7% от общего количества. Длительность повышения тропонинов при ТЭЛА обычно около 3 дней [15].
Риск ТЭЛА считается высоким (массивная ТЭЛА) у всех пациентов, имеющих признаки гемодинамической нестабильности (шок, гипотензия). Оценка маркеров повреждения и дисфункции правого желудочка у них необязательна, хотя, как правило, эти маркеры также имеются. При стабильном артериальном давлении (АД) оценивают маркеры дисфункции/повреждения правого желудочка. Наличие какого-либо из этих маркеров указывает на наличие у пациента промежуточного риска, если их нет, риск низкий.
Лечение ТЭЛА
Центральное место в патогенезе ТЭЛА занимает тромботическая окклюзия в системе легочной артерии, приводящая к увеличению «мертвого пространства» (неперфузируемой легочной ткани) и повышению общего легочного сосудистого сопротивления. В связи с этим антитромботические препараты являются основой патогенетической терапии ТЭЛА.
Основой лечения пациента с высоким риском является тромболизис или эмболэктомия в сочетании с антикоагулянтной терапией. Пациентам без высокого риска реперфузию не проводят, важнейшим элементом терапии являются антикоагулянты.
Лечение ТЭЛА высокого риска
Пациенту, поступающему в состоянии гипотензии/шока, обеспечивается адекватная инотропная и респираторная поддержка (табл. 5) [1, 9].
При подозрении на ТЭЛА, еще до получения окончательного подтверждения диагноза, пациенту назначают антикоагулянтную терапию. Препарат выбора при массивной ТЭЛА – нефракционированный гепарин (НФГ). Вводится болюс 80 ЕД/кг (или 10 000 ЕД), а затем проводится инфузия 18 ЕД/кг/ч (800–1250 ЕД/ч) до целевого значения активированного частичного тромбопластинового времени (АЧТВ) 1,5–2,3 от верхней границы нормы (46–70 с) с коррекцией инфузии по соответствующим таблицам [1]. Варфарин назначают с первых суток лечения. Длительность терапии НФГ – не менее 5 сут, его отменяют, когда целевое международное нормализованное отношение (МНО) сохраняется в течение 2 дней на уровне > 2,0 [4].
Одновременно в отсутствие противопоказаний (табл. 6) начинают процедуру тромболизиса, которая приводит к клиническому и/или эхокардиографическому улучшению у 92% пациентов.
Существуют разные режимы введения фибринолитиков (табл. 7): более быстрое введение эффективнее, но сопровождается повышением риска кровотечения (средний риск кровотечения составляет 12%) [1]. Введение тромболитика через катетер в легочную артерию не имеет преимуществ перед внутривенным введением. Согласно современным Рекомендациям по антитромботической терапии ВТЭ [4], введение тромболитика должно быть завершено в течение 2 ч. Соответственно, при использовании стрептокиназы или урокиназы следует прибегнуть к ускоренным схемам.
Временное «окно» для проведения тромболизиса при ТЭЛА значительно больше, чем при инфаркте миокарда: оптимальные сроки – до 48 ч, а целесообразность тромболизиса сохраняется до 5 суток от развития заболевания. Результаты применения указанных в табл. 7 препаратов при ТЭЛА сопоставимы.
При ТЭЛА высокого риска и абсолютных противопоказаниях к тромболизису, при неудаче тромболизиса (гипотензия без эффекта от терапии > 1 ч), шоке и риске смерти до наступления эффекта тромболитической терапии рекомендуют чрескожную катетерную или хирургическую эмболэктомию [1, 9]. Катетерное вмешательство эффективно только при поражении наиболее крупных сосудов системы легочной артерии – ствола, главных или долевых ветвей. Оно является методом выбора при неудаче или неэффективности тромболизиса.
Лечение ТЭЛА невысокого риска [1, 4]
Основой терапии является антикоагуляция. Точки приложения антикоагулянтов, используемых в современной терапии ТЭЛА, приводятся на рис. 5. Антагонисты витамина K (варфарин), не указанные на схеме, влияют на синтез витамин-K-зависимых факторов свертывания (II, VII, IX, X), то есть действуют «выше» всех остальных препаратов в каскаде коагуляции.
Препараты выбора – низкомолекулярные гепарины (НМГ) или фондапаринукс. Согласно рекомендациям ESC, эноксапарин вводится в дозировке 1 мг/кг дважды в сутки, фондапаринукс – 7,5 мг (при весе 50–100 кг) или 10 мг (при весе > 100 кг) один раз в сутки.
НФГ используется при тяжелой хронической почечной недостаточности (клиренс креатинина < 30 мл/мин) или высоком риске кровотечения, целевое АЧТВ – 1,5–2,3 верхней границы нормы; длительность терапии не менее 5 дней.
Варфарин назначается одновременно с парентеральным антикоагулянтом, с первых суток. Отмена парентерального антикоагулянта при сохранении варфарина возможна после достижения целевого МНО в течение двух дней подряд.
Перспектива лечения ТЭЛА
Опубликованные данные позволяют считать новые оральные антикоагулянты перспективными в отношении антикоагулянтной терапии ВТЭ во время первичной госпитализации, особенно у пациентов с ТЭЛА низкого и среднего риска. Из зарегистрированных в Российской Федерации препаратов оценку эффективности в сравнении со стандартной терапией при назначении в остром периоде заболевания проходил ривароксабан, в то время как дабигатран изучался лишь в рамках долгосрочной вторичной профилактики, после курса парентеральных НМГ [16, 17]. В России Ксарелто® (ривароксабан) был одобрен для лечения тромбоза глубоких вен и тромбоэмболии легочной артерии и профилактики рецидивов ТГВ и ТЭЛА в августе 2013 г. В исследование EINSTEIN–PE [18] было включено 4833 пациентов с симптомной, подтвержденной инструментально ТЭЛА в сочетании с ТГВ или без него. Критериями исключения были: ТЭЛА высокого риска (показан фибринолиз), тромбэктомия, имплантация кава-фильтра, клиренс креатинина < 30 мл/мин.
Схема исследования представлена на рис. 6. В исследовании сравнивались стандартная терапия (эноксапарин с последующим переходом на варфарин) и ривароксабан, который назначался с 1-го дня заболевания в дозе 15 мг 2 раза в сутки в течение 21 дня, а затем в дозе 20 мг 1 раз в сутки. Продолжительность антикоагулянтной терапии определялась по обычным критериям и составляла 3, 6 или 12 месяцев. Главной конечной точкой эффективности был 1-й рецидив ВТЭ, главной конечной точкой безопасности – 1-е тяжелое или иное клинически значимое кровотечение.
Исследование показало, что эффективность ривароксабана и стандартной терапии в отношении защиты от рецидивов ТЭЛА была сравнима. Общее число кровотечений достоверно не различалось, но массивных кровотечений при применении ривароксабана было в 2 раза меньше, чем при использовании стандартной терапии. В этой связи представляется перспективным включение ривароксабана в стандарты терапии ТЭЛА, не относящейся к категории высокого риска, в остром периоде.
В случае невозможности назначения орального антикоагулянта или его недостаточной эффективности с целью вторичной профилактики ТЭЛА применяется имплантация кава-фильтра [1, 4, 19, 20] (табл. 8). В отсутствие противопоказаний целесообразно сочетание имплантации кава-фильтра с антикоагулянтной терапией.
Профилактика ТЭЛА
Вторичная профилактика
Известно, что без проведения профилактики рецидив в течение 3 месяцев наблюдается у 20–47% пациентов с ТГВ. Эффективность адекватной профилактики чрезвычайно высока – число рецидивов снижается до 1%. Стандартом вторичной профилактики является терапия варфарином, однако у онкологических больных препаратами выбора в первые 3–6 месяцев являются НМГ, затем возможен переход на оральные антагонисты витамина K (АВК) [1, 3, 4].
Алгоритм выбора длительности профилактического назначения антикоагулянта, предлагаемый ESC, приводится на рис. 7.
При решении вопроса о длительности профилактики необходимо оценить риск кровотечения. Для этой цели Американская коллегия врачей-специалистов по заболеваниям органов грудной клетки (American College of Chest Physicians – АССР) рекомендует расчет уровня риска в зависимости от количества факторов риска, к которым относятся возраст старше 65 лет, наличие кровотечения или инсульта в анамнезе, наличие таких заболеваний, как злокачественная опухоль, хроническая почечная недостаточность, хроническая печеночная недостаточность, тромбоцитопения, сахарный диабет, анемия, а также сопутствующее лечение антитромбоцитарными препаратами, лабильное МНО, коморбидность и снижение подвижности, недавняя хирургическая операция, частые падения, алкоголизм [4]. Риск кровотечения считается высоким, если набирается 2 или более факторов риска. С нашей точки зрения, с этой целью можно использовать и более простую шкалу риска кровотечений HAS-BLED, рекомендуемую для пациентов с ФП, поскольку оцениваемые в этих шкалах параметры в основном совпадают [17].
К настоящему моменту завершены или продолжаются исследования «новых» оральных антикоагулянтов для вторичной профилактики ВТЭ [18, 19]. В группе исследований RECOVER сравнивалось долгосрочное лечение дабигатраном со стандартной терапией (варфарин) в качестве вторичной профилактики ВТЭ после применения НМГ в остром периоде. Дабигатран продемонстрировал равноценную эффективность и безопасность в период долгосрочной профилактики.
Использование ривароксабана для лечения ТГВ и ТЭЛА и профилактики рецидивов тромбоэмболических событий изучалось в программе EINSTEIN (включающей упомянутое выше исследование EINSTEIN–PE, EINSTEIN DVT и EINSTEIN Extension). Особенностью исследовательской программы было назначение ривароксабана сразу в остром периоде ВТЭ, без предшествующего назначения парентеральных антикоагулянтов. Использование ривароксабана было так же эффективно, как стандартная последовательная терапия НМГ и АВК. Кроме того, ривароксабан продемонстрировал меньшее число массивных кровотечений при лечении ТЭЛА, большую «чистую клиническую выгоду» в случае лечения ТГВ.
В режиме продленной терапии ривароксабан по сравнению с плацебо в исследовании EINSTEIN Extension показал свое превосходство у пациентов (снижение относительного риска рецидива ВТЭ на 82%, p < 0,001), у которых врачом было принято решение о продолжении профилактики после 6 или 12 месяцев терапии. При этом общее число кровотечений было низким.
На основании результатов проведенных исследований «новые» оральные антикоагулянты были внесены в американские Рекомендации по вторичной профилактике ТЭЛА наравне со стандартной терапией [4].
Таким образом, представляется перспективным использование ривароксабана в течение более длительного периода, чем принято по существующим критериям, – оно может принести дополнительную защиту от рецидива ТЭЛА без повышения риска кровотечения. При этом рекомендуется ежегодно проводить повторную оценку целесообразности продолжения антикоагулянтной терапии.
Первичная профилактика
Отсутствие первичной профилактики ВТЭ, в первую очередь у пациентов с высоким и средним риском (табл. 1), сопровождается неприемлемо высоким процентом тромбоэмболических осложнений. Тем не менее частота проведения адекватной профилактики ВТЭ в Российской Федерации низкая [21] (рис. 8).
Следует отметить, что в структуре смертности от ТЭЛА среди стационарных больных 75% составляют больные нехирургического профиля. Большую долю терапевтических больных с ТЭЛА составляют пациенты с хронической сердечной недостаточностью III–IV классов по NYHA (New York Heart Association, классификация Нью-Йоркской ассоциации кардиологов), причем риск ТЭЛА закономерно увеличивается со снижением фракции выброса левого желудочка [22, 23].
Проведение антикоагулянтной терапии в профилактическом режиме у пациентов, имеющих факторы риска, снижает вероятность ВТЭ, в том числе ТЭЛА, приблизительно вдвое. В связи с этим Российская ассоциация флебологов рекомендует проводить всем госпитализированным пациентам оценку риска ВТЭ и назначать соответствующую профилактику [3].
Для оценки риска нехирургических больных российскими специалистами рекомендуется шкала, представленная на рис. 9. Подчеркнем, что индивидуализированная количественная оценка риска представляет собой достаточно сложную процедуру, в то время как принципом эффективной профилактики является простота принятия решения. Именно поэтому большинство экспертов сходятся во мнении, что наиболее правильный подход к оценке риска ВТЭ – учет основного фактора риска, который послужил основанием для госпитализации (табл. 1) [24]. В то же время наличие дополнительных параметров риска, очевидно, повышает вероятность ТЭЛА и должно учитываться при выборе режима профилактики.
Выбор антикоагулянта для первичной профилактики на сегодняшний день таков: НМГ, фондапаринукс, ривароксабан, дабигатран.
Среди НМГ эталонной терапией считается эноксапарин, который в ряде исследований продемонстрировал очевидное превосходство перед НФГ [25, 26].
Новые пероральные антикоагулянты были изучены и зарегистрированы в качестве первичной профилактики пока только после ортопедических операций.
При сравнении ривароксабана с эноксапарином в группе исследований RECORD у пациентов, подвергшихся эндопротезированию коленного или тазобедренного сустава, было продемонстрировано превосходство ривароксабана в достижении первичной конечной точки – снижение частоты общей ВТЭ при сходном количестве кровотечений.
Дабигатран в исследованиях по первичной профилактике был либо сходен по эффективности с эноксапарином (при «европейском» режиме 40 мг 1 р/день), либо был менее эффективен (в «американском» режиме 30 мг 2 р/день) в исследовании RE-MOBILIZE.
Последние рекомендации ACCP 9 (2012) включили ривароксабан, наряду с НМГ, в перечень препаратов, используемых для послеоперационной тромбопрофилактики после эндопротезирования крупных суставов [4].
Дозировки антикоагулянтов, рекомендуемые Российской ассоциацией флебологов в первичной профилактике ВТЭ, приводятся в табл. 9 [3].
В дополнение к медикаментозной профилактике рекомендуется использование компрессионного трикотажа, а также перемежающейся эластической компрессии (ПЭК) 40–50 мм рт. ст. [3, 4, 27].
Характер и длительность первичной профилактики обобщены в табл. 10. Рекомендации по профилактике ВТЭ в ортопедии [27] указывают на предпочтительность введения последней дозы антикоагулянта не позднее 12 ч до операции, а при использовании схемы с послеоперационным введением первой дозы предпочтительный режим – не ранее 12 ч после операции.
У пациентов, которым выполняются операции низкого риска (в частности, артроскопические операции на коленных суставах в ортопедии), и не имеющих сопутствующих факторов риска ВТЭ, использование антикоагулянтов не рекомендуется, так как сопровождается риском кровотечения, который превосходит пользу от профилактики [27]. У остальных пациентов необходимо проводить индивидуальную оценку для определения соотношения «риск/польза» от назначения антикоагулянтов и также определять продолжительность такой профилактики.
Pulmonary embolism: diagnosis, antithrombotic therapy and prevention
L.L. Bershtein
State Budgetary Educational Institution for Higher Professional Education ‘North-Western State Medical University named after I.I. Mechnikov’, Cardiology Department
Contact person: Leonid Lvovich Bershtein, l_berstein@yahoo.com
Pulmonary embolism (PE) is one of most common and dangerous acute cardiovascular disorders. A number of cardiologic and non-cardiologic conditions is associated with increased PE risk. Due to complicated diagnosis, pulmonary embolism is frequently not recognized. The author reviews current approaches to diagnosis, management and prevention of PE. Current strategies of antithrombotic therapy are presented.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.