Тромбофилические нарушения как предикторы акушерской патологии. XX Всероссийский научно-образовательный форум «Мать и дитя»
- Аннотация
- Статья
- Ссылки





Опыт использования низкомолекулярных гепаринов в программах вспомогательных репродуктивных технологий
На современном этапе именно вспомогательные репродуктивные технологии (ВРТ) зачастую помогают решать проблему бесплодного брака, поэтому активное внедрение ВРТ в клиническую практику обусловливает актуальность повышения их эффективности и безопасности. Доцент кафедры акушерства и гинекологии с курсом ДПО Алтайского государственного медицинского университета, д.м.н. Марина Геннадьевна НИКОЛАЕВА напомнила, что любая ВРТ – фактор тромбогенного риска. Индукция овуляции хорионическим гонадотропином человека и дотация эстрогенов приводят к увеличению концентрации фактора роста эндотелия сосудов (vascular endothelial growth factor – VEGF). В результате, с одной стороны, автоматически повышается содержание тканевого фактора (tissue factor – TF), вследствие чего растет число полученных ооцитов, и это хороший прогноз для программы ВРТ. С другой стороны, снижается выделение ингибитора пути тканевого фактора (tissue factor pathway inhibitor – TFPI), что в конечном итоге ведет к нарушению имплантации. Кроме того, сама по себе процедура способствует увеличению содержания всех прокоагулянтов, повышает тромбогенность крови и риск возможных тромбоэмболических осложнений1, 2.
Недостаточность научных данных, устанавливающих влияние гемостазиологических изменений на исходы программ ВРТ, послужила основанием для инициации в 2010 г. собственного исследования сотрудниками Алтайского филиала Национального медицинского исследовательского центра гематологии и Центра репродукции при Краевой клинической больнице под руководством профессора А.П. Момота. Продолжительность проспективного исследования составила пять лет (2010–2015). Была поставлена задача установить роль нарушений в системе гемостаза и фибринолитической активности крови в возникновении неудач ВРТ и определить возможность их терапевтической коррекции.
В исследовании приняли участие 765 женщин в возрасте от 24 до 42 лет (33,4 ± 3,9 года). Они принадлежали к европеоидной расе и в подавляющем большинстве имели трубный фактор бесплодия (87,5%).
Исследование проходило в два этапа. На первом этапе (n = 163) изучалась роль нарушений в системе гемостаза и фибринолитической активности крови в возникновении неудач программы экстракорпорального оплодотворения (ЭКО). Второй этап (n = 602) был посвящен оценке эффективности терапевтических мероприятий. Были выбраны пять точек, обусловленных критическими периодами как во время имплантации, так и в период становления хориона. В том числе три на первом этапе: перед началом гормональной стимуляции, за два-три дня до пункции фолликула, на 13–14-й день после переноса эмбрионов. И две на втором этапе: 6–7-я и 12–13-я недели беременности. Проанализировано 25 лабораторных параметров, описывающих коагуляционную и фибринолитическую активность крови, включая оценку генерации тромбина (эндогенный тромбиновый потенциал (ЭТП) и пик тромбина) и определение индекса активирующей фибринолиз способности эндотелия (АФСЭ) по соотношению активностей тканевого активатора плазминогена (tissue plasminogen activator – t-PA) и ингибитора активатора плазминогена первого типа (plasminogen activator inhibitor – PAI-1): АФСЭ = t-PA/PAI-1 × 100%.
В качестве методов терапевтического воздействия использовались перемежающаяся пневматическая компрессия (ППК) два раза в неделю с 30-минутным наложением манжеты аппарата на правую руку и прием низкомолекулярного гепарина (НМГ) – надропарина кальция в дозе 0,6 мл/сут. В результате проведенного исследования установлено, что изменения показателей системы гемостаза (избыточная генерация тромбина и/или низкая фибринолитическая активность) на этапе стимуляции овуляции в циклах ЭКО отмечались у 78,8% пациенток. Практически у такого же количества пациенток (70,7%) изменились показатели гемостаза на шестой – восьмой неделе беременности, наступившей в программе ЭКО. Рассчитаны критические пороговые значения тестов, сопряженных с риском неудачных попыток циклов ЭКО:
- ЭТП > 1900 нмоль/мин (отношение шансов 27,8, р = 0,0001);
- пик тромбина > 360 нмоль/л (отношение шансов 22,8, р = 0,0001);
- индекс АФСЭ > 11% (отношение шансов 11,5, р = 0,003).
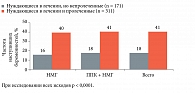
В рамках второго этапа на основании полученных лабораторных параметров сформированы группы женщин, которые нуждались в терапевтической коррекции нарушений в системе гемостаза, проводившейся при добровольном согласии пациенток. Женщинам со сниженной фибринолитической активностью до начала процедуры ЭКО выполнялись четыре сеанса ППК. Пациентки с высокой генерацией тромбина принимали препарат Фраксипарин (надропарин кальция) по 0,6 мл в сутки, а пациентки с высокой генерацией тромбина и нарушенным фибринолизом не только получали Фраксипарин, но и проходили курс компрессионной пневмокомпрессии. За два-три дня до пункции фолликулов яичников терапия отменялась и возобновлялась со следующего дня после процедуры. Лечение продолжалось до проведения ультразвукового исследования с целью установления факта беременности. При положительном результате пациентки получали предложенную терапию вплоть до 12-й недели гестации, при отрицательном результате терапевтические мероприятия отменялись. В группах пациенток с критическими порогами найденных сдвигов при проведении терапии по заданному алгоритму по завершении программы ЭКО отмечены снижение способности к генерации тромбина по показателям ЭТП и пика тромбина на 13,9% (р = 0,0041) и 11,6% (р = 0,0038) соответственно и увеличение фибринолитической активности по индексу АФСЭ в 2,1 раза (р = 0,0001). Клинический эффект предложенного терапевтического воздействия выразился в повышении частоты благоприятных исходов ЭКО. В частности, на фоне обоснованного назначения НМГ при исходно высокой генерации тромбина беременность в цикле ЭКО наступала на 24% чаще, а на фоне комбинированной терапии «НМГ + ППК» – на 23% чаще (р < 0,0001) (рис. 1). В рамках второго этапа исследования также был разработан алгоритм диагностики и коррекции нарушений в системе гемостаза на ранних сроках беременности, наступившей в программе ЭКО. После проведения исследования системы гемостаза при установлении факта наступления беременности у пациенток без предшествующих нарушений гемокоагуляции в цикле ЭКО и уровне эндогенного тромбинового потенциала выше 2050 ммоль/л назначался Фраксипарин в профилактической дозе 0,6 мл в сутки на протяжении первого триместра. Если на шестой – восьмой неделе гестации у пациенток без нарушений гемокоагуляции показатель ЭТП превышал 2165 ммоль/л, им также назначался Фраксипарин в профилактической дозе 0,6 мл в сутки до 12-й недели беременности.
Результаты исследования продемонстрировали эффективность предложенного терапевтического подхода для снижения удельного веса ранних репродуктивных потерь в циклах ЭКО. В группе пациенток с выявленными нарушениями в системе гемостаза и не получавшими терапевтической коррекции ранние репродуктивные потери составили 22,6% случаев. В группе пациенток, прошедших курс терапии по предложенному алгоритму, только в цикле ЭКО число репродуктивных потерь (неразвивающиеся беременности) было в 4,6 раза ниже и составило 4,8%. В случае продолжения терапии Фраксипарином в профилактической дозе в течение первого триместра ранних репродуктивных потерь не зарегистрировано (рис. 2).
Результаты исследования позволяют сделать некоторые важные выводы:
- избыточная генерация тромбина в плазме крови и/или низкая фибринолитическая активность в цикле ЭКО наблюдаются в 78,8% случаев;
- терапевтическая коррекция нарушений в системе гемостаза в цикле ЭКО увеличивает частоту наступления беременности на 23%;
- гематологическая коррекция нарушений в системе гемостаза в первом триместре беременности способствует уменьшению репродуктивных потерь на 22,6%.
Опасности антифосфолипидного синдрома в акушерстве
Как известно, антифосфолипидный синдром (АФС) – это аутоиммунная тромбофилия, которая обусловлена взаимодействием антител к фосфолипидам с компонентами свертывающей системы крови, тромбоцитами и эндотелиальными клетками, приводящим к активации механизмов тромбообразования и сосудистого повреждения, что проявляется тромбозами различной локализации и/или акушерской патологией. По словам старшего научного сотрудника отделения репродуктивной гематологии и клинической гемостазиологии Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, к.м.н. Татьяны Валерьевны КИРСАНОВОЙ, достаточно часто (от 3 до 21%) при АФС отмечается HELLP-синдром (сочетание трех симптомов: гемолиза, увеличения уровня печеночных ферментов и тромбоцитопении). HELLP-синдром, развившийся в рамках как первичного, так и вторичного АФС, характеризуется достаточно высокой летальностью, достигающей 4%. А если после родоразрешения симптомы тромботической микроангиопатии не регрессируют, то вероятность развития катастрофического АФС увеличивается, и в этих случаях летальность достигает 50%, несмотря на адекватные методы лечения3. Специалистам нужно быть предельно внимательными, если до или во время беременности обнаруживались антифосфолипидные антитела, а в анамнезе были тромбозы или синдром потери плода4. Акушерские осложнения при АФС могут проявляться тремя и более последовательными потерями беременности до десяти недель, одной и более необъяснимыми потерями беременности после десяти недель, одними и более преждевременными родами (до 34 недель) из-за преэклампсии и ее осложнений. Они могут реализоваться в виде ранних репродуктивных потерь, синдрома задержки роста и развития плода или его гибели, преэклампсии, тромбозов.
По данным литературы, АФС чаще всего манифестирует с тромбоцитопении (21,9%) и сетчатого ливедо – тяжелого ишемического поражения кожи, которое развивается вследствие тромбозов сосудов дермо-эпидермального стыка и не исчезает при надавливании (20,4%), и гораздо реже с синдрома потери плода (8,3%)5.
Сегодня одним из ведущих механизмов, лежащих в основе неблагоприятных исходов беременности у женщин с АФС, считается избыточная активация локальной системы комплемента, а не гиперкоагуляция как таковая. Важно отметить, что эффективность гепаринов можно объяснить не прямым антикоагулянтным действием, а ингибированием избыточной активации системы комплемента.
Какие лабораторные предикторы высокого риска тромбоза и синдрома потери плода существуют? По данным исследования NOH-APS, высокие уровни антител кардиолипина больше характерны для ранних потерь беременности, тогда как наличие волчаночного антикоагулянта – для поздних6. Исследование PROMISSE в свою очередь постулирует, что с неблагоприятными исходами беременности коррелирует только наличие волчаночного антикоагулянта7. Однако не стоит забывать о маркерах высокого риска при АФС, поскольку позитивность сразу по нескольким классам антифосфолипидных антител свидетельствует о более высоком риске реализации любого тромботического события.
Какова должна быть оптимальная терапевтическая тактика? Говоря о методах лечения, докладчик констатировала, что роль многих из них при АФС явно переоценена. Например, не известны реальная эффективность и безопасность дипиридамола, поскольку он не изучался у беременных с АФС в контролируемых клинических испытаниях. Внутривенный иммуноглобулин проходил испытания по применению у беременных с АФС, и его эффективность была ниже, чем у гепаринов в сочетании с ацетилсалициловой кислотой (АСК). Поэтому при акушерском АФС введение иммуноглобулина внутривенно в рутинной практике не рекомендуется8. Плазмаферез может механически удалить антитела, но они вновь синтезируются. Кроме того, процедура может осложняться нежелательными явлениями и не имеет доказанной эффективности при АФС. В настоящее время проведение плазмафереза показано только при катастрофическом АФС. Наиболее эффективными и безопасными средствами являются антикоагулянты. Однако применение только АСК не улучшает исходы беременности. Два проспективных исследования, сравнивавших эффективность низких доз АСК и сочетания АСК с нефракционированным гепарином, продемонстрировали успех комбинированной терапии9, 10.
С появлением НМГ были доказаны их эффективность и безопасность при акушерской патологии у женщин с АФС. Поэтому еще одним стандартом ведения женщин с АФС и тремя последовательными ранними потерями беременности является использование НМГ в сочетании с низкими дозами АСК11. Считается, что такое лечение позволяет снизить показатели мертворожденности при синдроме потери плода, а кроме того, контролировать тромботические риски при беременности, поэтому оно рекомендовано всеми сообществами, включая Ассоциацию торакальных хирургов.
Безусловно, у беременных с АФС крайне высок риск тромботических осложнений, и это касается не только тромбозов крупных сосудов, но и возникновения тромботической микроангиопатии. В настоящий момент проводится исследование High-Low Study с целью проверки гипотезы, что средняя доза НМГ переносится так же хорошо, как и низкая, но лучше предупреждает повторные тромботические события у беременных с тромбозом глубоких вен или тромбоэмболией легочной артерии (ТЭЛА) в анамнезе.
Завершая выступление, Т.В. Кирсанова при ведении пациенток с АФС призвала ориентироваться на НМГ. Среди этой группы препаратов надропарин кальция (Фраксипарин) характеризуется низким молекулярным весом и, следовательно, наименьшим риском геморрагических осложнений, кроме того, он демонстрирует наибольшую биодоступность12.
Обоснованность антикоагулянтной терапии при планцента-ассоциированных осложнениях
Причины патологии беременности лежат в нарушении иммунных, гемостазиологических, генетических взаимодействий между матерью и плодом. Как отметила руководитель отделения профилактики и терапии невынашивания беременности Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, д.м.н. Нана Картлосовна ТЕТРУАШВИЛИ, еще одна проблема женщин с потерями беременности – акушерские так называемые плацента-ассоциированные осложнения беременности. Прежде всего речь идет о преэклампсии, преждевременных родах, плацентарной недостаточности, задержке роста плода или его гибели и самопроизвольных выкидышах. Свой вклад в развитие данных осложнений вносят врожденная и приобретенная тромбофилия, инфекционный фактор, иммунологические нарушения.
По словам докладчика, беременность – своеобразный тест на реализацию тромботических осложнений ввиду определенных факторов: физиологической гиперкоагуляции, особого состояния эндотелия, замедления кровотока и формирования нового «органа» – плаценты, которая богата сосудами и имеет особую архитектонику.
При генетической предрасположенности, полиморфизме генов, циркуляции аутоантител тромботические осложнения, в первую очередь в плаценте, могут реализоваться в условиях неблагоприятных факторов, таких как ожирение, возраст старше 35 лет, гипертензия, инфекции, воспаление и собственно беременность. Речь идет о многоплодной беременности или беременности после программы ВРТ, беременности на фоне гормональной терапии, ожирения, варикоза и обезвоживания.
Помимо тромботических механизмов существует и воспалительное поражение, приводящее к повреждению плаценты и вносящее лепту в развитие плацента-ассоциированных осложнений. Наиболее яркий пример совокупности этих патогенетических механизмов – акушерский АФС.
Помимо АФС существуют и другие нераспознанные состояния, которые, вероятно, по тем же сходным механизмам ведут к реализации плацентарной недостаточности и плацента-ассоциированным осложнениям. Именно поэтому необходимо детально собирать семейный анамнез пациентки в отношении перенесенных тромбозов, тромботических осложнений во время приема гормональной контрацепции, тромбофлебитов, тромбоцитопении неясной этиологии и, конечно, уточнять данные репродуктивного анамнеза и репродуктивной неудачи.
К факторам риска тромбоза, подлежащим оценке во время беременности, относятся не только возраст старше 35 лет, ожирение, наступление беременности в результате ВРТ, но и синдром гиперстимуляции яичников, тяжелая рвота, преэклампсия, многоплодная беременность.
Относительно назначения НМГ в протоколе тромбопрофилактики Королевское общество акушеров-гинекологов Великобритании (2015) дает следующие рекомендации13:
- при наличии четырех и более факторов риска тромбоза – НМГ в профилактических дозах на протяжении всей беременности и шести недель послеродового периода;
- при наличии трех факторов риска – НМГ в профилактических дозах с 28-й недели беременности и в течение шести недель послеродового периода;
- при наличии двух факторов риска – НМГ в профилактических дозах в течение десяти дней послеродового периода.
Нужно отметить, что на ранних сроках беременности НМГ назначаются при синдроме гиперстимуляции яичников, тяжелой рвоте беременных или беременности после ЭКО при наличии двух факторов риска.
Безусловно, необходимо проводить оценку риска тромбоза после родов. Пациенткам с высоким риском тромбозов НМГ назначается на шесть недель, со средним риском – на десять дней.
Как уже отмечалось, применение НМГ уменьшает риск развития тромбоза и улучшает исходы беременности. Однако не все НМГ одинаковы, у каждого препарата есть свои особенности. Так, Фраксипарин (надропарин), оказывая быстрое антитромботическое действие и обладая стойким эффектом, характеризуется высокой степенью безопасности, в первую очередь в отношении развития кровотечения, простотой назначения и отсутствием необходимости строгого лабораторного контроля. Как отметила Н.К. Тетруашвили, именно безопасность Фраксипарина в отношении развития кровотечения – один из главных аргументов его использования на ранних сроках беременности. Благодаря низкой молекулярной массе Фраксипарин демонстрирует в исследованиях улучшенный антитромботический эффект и высокую безопасность. G. Simonneau и соавт. (2006) установили, что при применении Фраксипарина риск больших кровотечений уменьшается на 36% по сравнению с эноксапарином14. Доказано, что среди всех НМГ Фраксипарин – наиболее безопасный в отношении гепарин-индуцированной тромбоцитопении и активации тромбоцитов12.
За последние годы было опубликовано сразу несколько руководств, регламентирующих использование НМГ в лечении и профилактике венозных тромбоэмболических осложнений, в том числе в акушерстве и гинекологии. Необходимо отметить, что препарат Фраксипарин (надропарин) внесен в российские клинические рекомендации по профилактике венозных тромбоэмболических осложнений в акушерстве и гинекологии 2014 г., а также во многие современные международные рекомендации15, 16. Согласно международным рекомендациям, профилактическая доза Фраксипарина составляет 2850 МЕ/сут (0,3 мл), лечебная – 86 МЕ/кг два раза в сутки или 171 МЕ/кг один раз в сутки.
Применение НМГ показано при тромбозе во время беременности и тромбофилиях высокого риска без тромбозов (монозиготной мутации фактора V Лейдена, гена протромбина, антитромбина III) в профилактических дозах в течение всей беременности и шести недель послеродового периода.
«Необходимы дальнейшие исследования роли НМГ в предотвращении осложнений беременности. В нашем отделении мы широко и с успехом применяем надропарин у пациенток с плацента-ассоциируемыми проблемами в анамнезе для предотвращения осложнений текущей беременности», – уточнила Н.К. Тетруашвили в заключение.
Клинические случаи ведения беременности при тромбоэмболии легочной артерии
Тромбофилия – патологическое состояние, вызванное комбинацией врожденных и/или приобретенных факторов риска, клинически реализованных развитием тромбоза. Однако, как отметила заведующая кафедрой акушерства и гинекологии Института медицины и психологии Новосибирского государственного университета, заслуженный врач РФ, д.м.н., профессор Наталья Михайловна ПАСМАН, диагноз тромбофилии правомочен только при клиническом эквиваленте артериального или венозного тромбоза, соответствующей лабораторной картине и генетически подтвержденной клинически значимой тромбогенной мутации.
Заподозрить у пациентки тромбофилию позволяет отягощенный анамнез, а именно перенесенные близкими родственниками инсульты, инфаркты, тромбозы в возрасте до 50 лет, кроме того, возможные тромбозы и тромбоэмболии у пациентки во время родов и в послеродовом периоде, тромбозы на фоне комбинированных оральных контрацептивов, а также задержка внутриутробного развития плода, мертворождения, преждевременная отслойка плаценты, ранняя преэклампсия, HELLP-синдром в анамнезе.
Патогенез тромбоза при беременности включает стаз крови, повреждение сосудов и гиперкоагуляцию крови. Не случайно один из ведущих российских экспертов в области клинической гемостазиологии, профессор А.Д. Макацария отмечал, что беременность – своеобразный «гестационный экзамен» организма на тромбофилическое состояние.
По статистике, частота тромбозов при беременности возрастает в десять раз, а вероятность развития тромбозов после родов в четыре – шесть раз выше, чем во время беременности. В среднем частота тромбоэмболических осложнений колеблется от 0,6 до 1,3 случая на 1000 родов. При этом ТЭЛА остается основной причиной материнской смертности17. Дополнительными факторами, потенцирующими клинические эффекты тромбофилии у беременных, считаются эндотоксемия, вирусная инфекция, септические осложнения, ожирение, сахарный диабет, сердечно-сосудистые заболевания, операция, гиповолемия и гиподинамия.
Фатальные тромбозы при беременности зачастую обусловлены недооценкой клинических симптомов и факторов риска, неверным диагнозом и неадекватным лечением.
Современные интегральные тесты оценки состояния гемостаза представлены тестом генерации тромбина, тромбоэластографией, тестом тромбодинамики, внедрение которых целесообразно в большинстве крупных акушерско-гинекологических стационаров и клиник. Однако возможность их применения не исключает необходимости проведения рутинных тестов по исследованию коагуляционного потенциала и системы естественных антикоагулянтов, например скрининга нарушений в системе протеина С и других факторов.
Осуществляется балльная оценка риска венозных тромбоэмболических осложнений в акушерстве, включающая данные анамнеза и акушерско-гинекологических факторов. Наличие умеренного риска (2 балла) дает основание для назначения ППК и НМГ в течение шести-семи дней, высокого и очень высокого риска (3 и более баллов) – ППК и НМГ в течение шести недель после родов.
Надропарин кальция и эноксапарин натрия считаются препаратами первого выбора для профилактики и терапии тромбозов во время беременности и после родов. Надропарин кальция благодаря хорошей эффективности и более высокому профилю безопасности, в первую очередь в отношении кровотечений, показан к применению и на ранних сроках беременности.
Далее профессор Н.М. Пасман разобрала три клинических случая ведения беременности при ТЭЛА, в лечении которых принимали участие специалисты городской клинической больницы № 1 г. Новосибирска и Регионального сосудистого центра.
Клинический случай 1. Массивная тромбоэмболия легочной артерии в третьем триместре беременности
Пациентка Т., 32 года, четвертая беременность (в анамнезе три самопроизвольных выкидыша). 30 января 2019 г. доставлена по скорой помощи в отделение патологии беременности городской клинической больницы № 1 г. Новосибирска из женской консультации, куда обратилась, чтобы встать на учет при сроке беременности 24–25 недель. Данные осмотра: жалобы на усталость, одышку при нагрузке, отечность и боль в левой нижней конечности, которые появились с начала января. За неделю до визита состояние ухудшилось: развилась слабость. Артериальное давление повышено (артериальная гипертензия) – 140/90 мм рт. ст.
С 30 января по 4 февраля 2019 г. находилась в отделении патологии беременности с дальнейшим переводом в отделение реанимации и интенсивной терапии № 3, где ей поставлен диагноз: беременность III, 24–25 недель; продольное положение, головное предлежание плода; умеренная преэклампсия; хроническая урогенитальная инфекция; хроническая вторичная плацентарная недостаточность.
Пациентке при поступлении провели лабораторное исследование системы гемостаза крови, результаты которого выявили повышение уровня Д-димера – 7,2. При выполнении компьютерной томографии органов грудной клетки с контрастированием верифицирована двусторонняя тромбоэмболия легочной артерии с плотным очагом S3 левого легкого. Источник – тромбоз левой нижней конечности, по данным ультразвукового исследования вен нижних конечностей.
Клинический диагноз: неокклюзирующий тромбоз подвздошных вен слева; посттромботический тромбоз глубоких вен левой нижней конечности с признаками реканализации; субмассивная двусторонняя тромбоэмболия легочной артерии; беременность IV, 24–25 недель, роды четвертые; гестационная артериальная гипертензия; анемия сочетанного генеза легкой степени тяжести; хроническая урогенитальная инфекция.
Специалистами НМИЦ им. акад. Е.Н. Мешалкина (Новосибирск), в частности профессором А.А. Карпенко, рекомендована терапия с применением НМГ.
При повторном лабораторном исследовании системы гемостаза крови выявлены волчаночный антикоагулянт в среднем титре, чрезмерная активность фактора свертывания крови VIII, гиперагрегация тромбоцитов. Таким образом, был верифицирован диагноз АФС.
Пациентке Т. при массе тела 70 кг была назначена терапия по следующей схеме: НМГ надропарин кальция в лечебной дозе 0,6 мл два раза в сутки, амлодипин 5 мг/сут и метопролол 12,5 мг два раза в сутки. На фоне лечения исчезла одышка, улучшились показатели системы гемостаза: уровень Д-димера снизился с 7,2 до 1,68, увеличился показатель фибриногена до 6,08 мг/л, активированное парциальное тромбопластиновое время выросло до 46,2, протромбиновый индекс составил 113,1. Международное нормализованное отношение анализа крови нормализовалось в сторону гипокоагуляции.
Спустя три недели, 16 февраля 2019 г., у пациентки возник болевой синдром в верхней трети левого бедра. Ультразвуковое исследование вен брюшной полости и нижних конечностей – с отрицательной динамикой. Выявлено прогрессирование неокклюзирующего тромбоза, флотация верхушки тромба до 7 см большой подкожной вены левой нижней конечности.
Клинический диагноз: беременность IV, 27 недель, четвертые роды; комбинированная тромбофилия – АФС в сочетании с носительством тромбогенных полиморфизмов генов системы гемостаза, повышением активности фактора свертывания крови VIII, гипергомоцистеинемия; прогрессивный неокклюзирующий тромбоз (с флотацией) поверхностной бедренной вены левой нижней конечности; субмассивная двусторонняя тромбоэмболия легочной артерии; гестационная гипертензия; анемия сочетанного генеза легкой степени тяжести; хроническая урогенитальная инфекция.
Спустя несколько дней у пациентки стало расти давление в легочной артерии, вновь появились признаки незначительной одышки, несмотря на то что компьютерная томография органов грудной клетки с контрастом от 2 марта 2019 г. ухудшения не выявила.
В связи с усугублением состояния плода (нарушение маточно-плацентарного кровотока второй степени) на сроке 27–28 недель беременности 8 марта 2019 г. было проведено экстренное родоразрешение. Была осуществлена лапаротомия по Пфанненштилю, кесарево сечение в нижнем сегменте поперечным разрезом. Ребенок родился живым, хотя и недоношенным – весом 920 г и ростом 35 см. Общая кровопотеря на фоне использования НМГ составила всего 500 мл.
Терапия НМГ продолжена через восемь часов после родов надропарином кальция в лечебной дозе 0,6 мл два раза в сутки.
Пациентка еще три недели находилась в стационаре по поводу выявленной с помощью ультразвукового исследования подапоневротической гематомы. На 21-е сутки на фоне положительной динамики пациентку Т. выписали домой в удовлетворительном состоянии.
Клинический случай 2. Рецидив тромбоэмболии легочной артерии с выраженной дисфункцией правого желудочка в первом триместре беременности
Пациентка М., 32 года, 7 марта 2019 г. поступила в отделение реанимации и интенсивной терапии № 3 с клиникой ТЭЛА, проявления которой отмечались начиная с сентября 2018 г. Беременность II, роды I.
Клинический диагноз: неспровоцированный эпизод венозных тромбоэмболических осложнений; носительство полиморфизмов генов системы гемостаза – гетерозигота Gp1a, гетерозигота Gpilla, гомозигота фолатного цикла MTHFR, MTRR; неокклюзирующий тромбоз левой подколенной вены; рецидивирующая субмассивная двусторонняя тромбоэмболия легочной артерии от сентября 2018 г., рецидив от 6 марта 2019 г. с формированием участков инфаркта пневмонии в обоих легких; риск летальности по индексу тяжести легочной эмболии (pulmonary embolism severity index – PESI) – 112 баллов, или высокий; легочное сердце с синдромом выраженной легочной гипертензии; расчетное давление в легочной артерии – 56 мм рт. ст.; тромбоз воротной вены, брыжеечной и устья селезеночной вены. Беременность II, 11–14 недель, роды I.
С учетом рецидива ТЭЛА с выраженной дисфункцией правого желудочка было решено провести пациентке системный тромболизис алтеплазой (Актилизе 100 мг). Показаний к хирургическому вмешательству на момент поступления не было. С учетом высокого риска повторных тромбоэмболических осложнений была выбрана выжидательная акушерская тактика.
На фоне лечения отмечалась положительная динамика в виде уменьшения клинических проявлений ТЭЛА: исчезновение одышки, отсутствие тахикардии, стабильная гемодинамика. Однако, несмотря на уменьшение признаков дисфункции правого желудочка по эхокардиографии в динамике и расчетного давления в легочной артерии, по-прежнему в проекции левой ветви и основного ствола определялось объемное образование в виде тромба и отмечалась перегрузка правых отделов. Постепенно начала нарастать правожелудочковая недостаточность.
Был созван расширенный консилиум с участием кардиологов, кардиохирургов и специалистов лучевой диагностики федерального центра – НМИЦ им. акад. Е.Н. Мешалкина, чтобы определить тактику ведения больной с высоким риском венозных тромбоэмболических осложнений и риском формирования хронической тромбоэмболической легочной гипертензии. В рамках консилиума было принято решение о необходимости прервать беременность. После согласия пациентки на сроке беременности в 15 недель ей была проведена операция методом малого кесарева сечения, после чего она продолжила лечение в НИИ патологии кровообращения.
Клинический случай 3. Пролонгирование беременности при массивной тромбоэмболии легочной артерии в первом триместре
Пациентка И., 39 лет, поступила 28 ноября 2018 г. в городскую клиническую больницу № 1 г. Новосибирска в тяжелом состоянии, обусловленном выраженной дыхательной недостаточностью. Из анамнеза: поливалентная аллергия, отсутствие соматической патологии и случаев венозных тромбоэмболических осложнений. При первой беременности в третьем триместре развился отечный синдром. Была выполнена операция кесарева сечения по поводу синдрома внутричерепной гипертензии, в дальнейшем пациентка чувствовала себя удовлетворительно.
Статус при поступлении: тахикардия, по данным эхокардиографии, дилатация правых отделов сердца, дискинезия межжелудочковой перегородки за счет перегрузки правого желудочка, расчетное давление в легочной артерии – 75 мм рт. ст., уровень Д-димера повышен до 3,26, а протромбиновый индекс понижен до 69. Ультразвуковое исследование вен нижних конечностей не выявило признаков тромбоза.
Был собран консилиум в составе ответственного администратора, сосудистого хирурга, акушера-гинеколога, кардиолога, анестезиолога-реаниматолога. Поскольку вероятность ТЭЛА по правилу Уэллса и Женевской шкале – промежуточная, было решено провести пациентке компьютерную томографию органов грудной клетки, на которой выявлена двусторонняя ТЭЛА.
Верифицированный диагноз: рецидивирующая субмассивная тромбоэмболия обеих легочных артерий (PESI 99 баллов) от начала ноября 2018 г. и с рецидивом 24 ноября 2018 г.; инфаркт S6, S8, S9 правого легкого; беременность II, 11–12 недель; рубец на матке после операции кесарева сечения в 2009 г.; впервые выявленный гестационный диабет; избыточная масса тела (индекс массы тела 28,8 кг/м2); гипоксическая гепатопатия; поливалентная аллергия.
По данным биохимического скрининга определен высокий риск трисомии по 13-й паре хромосом (1:5). Однако проведенная диагностика основных трисомий (по хромосомам 13, 18, 21) нарушений не выявила.
По согласованию со специалистами пациентке с беременностью 12 недель выполнен тромболизис с дальнейшим переходом на НМГ в лечебной дозе. Учитывая отсутствие признаков легочной гипертензии, стабильное состояние пациентки, адекватный прирост плода по ультразвуковому исследованию, было решено пролонгировать беременность. Пациентка вынашивала беременность в условиях стационара, а затем родильного дома на фоне непрерывного приема НМГ в лечебных дозах. В 36–37 недель она была родоразрешена операцией кесарева сечения. НМГ был отменен за сутки до операции. Мальчик весом 2630 г и ростом 49 см родился в удовлетворительном состоянии с оценкой по шкале Апгар 7–8 баллов. Общая кровопотеря составила 400 мл.
Прием НМГ в лечебной дозе был возобновлен через восемь часов после кесарева сечения и продолжался в течение шести месяцев после родов.
Заключение
В соответствии с российскими и международными рекомендациями НМГ занимают важное место в профилактике и лечении тромбофилических осложнений в акушерстве. Приведенные экспертами результаты исследований и их собственный клинический опыт доказывают, что НМГ Фраксипарин, обладая более высокой биодоступностью и пролонгированным действием, демонстрирует стабильный антитромботический эффект, высокую безопасность, способствует улучшению исходов беременности и снижению репродуктивных потерь. Медикаментозная профилактика в группах высокого риска развития тромбоэмболических осложнений при беременности с использованием Фраксипарина в течение длительного времени эффективна и безопасна для матери и плода, а также не приводит к увеличению частоты акушерских кровотечений.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.