В последние годы неалкогольную жировую болезнь печени (НАЖБП) рассматривают как неотъемлемый компонент метаболического синдрома (МС). МС представляет собой комплекс связанных между собой факторов, включащих инсулинорезистентность, нарушение углеводного обмена, абдоминально-висцеральное ожирение, артериальную гипертензию, атерогенную дислипидемию и др. Печень при МС является одним из основных органов-мишеней [1, 2]. Согласно данным ряда источников, частота патологии печени у больных с МС составляет от 37 до 64%.
НАЖБП: этиология, патогенез, задачи терапии
К этиологическим факторам развития НАЖБП относятся метаболические расстройства и эндокринопатии (инсулинорезистентность или СД, ожирение, подагра, гиперлипидемия, гипотиреоз, гипертиреоз, синдром Кушинга и др.); нарушение процессов пищеварения и всасывания (патология поджелудочной железы, тонкой кишки, синдром нарушенного всасывания, избыточное питание, голодание, парентеральное питание, синдром избыточного бактериального роста в кишечнике); действие лекарств, химических субстанций, фитотоксинов, токсинов грибов; инфекции; анемия, сердечно-сосудистая и дыхательная недостаточность и др. [3, 4]. НАЖБП имеет несколько стадий развития: от простого стеатоза до стеатогепатита, фиброза и цирроза печени. Симптомы, свойственные заболеваниям печени, отсутствуют у большинства больных, только некоторые из них отмечают незначительный дискомфорт или боль в правом верхнем квадранте живота [1].
У большей части пациентов НАЖБП протекает благоприятно, без значительных клинико-морфологических изменений. Поскольку возможность проведения пункции печени имеется далеко не всегда, истинная распространенность этого заболевания в популяции неизвестна. Чаще больные обращаются к врачам по другим причинам, например по поводу артериальной гипертонии (АГ), желчнокаменной болезни, ишемической болезни сердца (ИБС), заболеваний периферических сосудов и др. [5, 6].
В связи с этим лечение назначается только больным с высоким риском прогрессирования НАЖБП или при наличии выраженных изменений биохимических показателей печени (повышение активности аланин-аминотрансаминазы (АЛТ) и аспартатаминотрансаминазы (АСТ) в крови в 2–3 раза и более). МС обусловливает чрезвычайно высокий риск развития СД 2 типа, ИБС и других заболеваний, связанных с атеросклерозом [7–10], а также жировой болезни печени [2]. Среди механизмов поражения печени необходимо выделить нарушение синтеза и экскреции желчи в гепатоцитах, активацию перекисного окисления липидов (ПОЛ), угнетение активности ретикуло-эндотелиальной системы печени.
В литературе представлены многочисленные данные о возможных патогенетических механизмах повреждения печени при МС, а также о роли печени в развитии и прогрессировании МС. Печень является единственным органом, где осуществляется синтез желчных кислот. Накопление в печени свободных жирных кислот приводит к нарушению проницаемости клеточных мембран, в том числе для глюкозы, к нарушению утилизации глюкозы гепатоцитами, что способствует повышению резистентности тканей к инсулину и поддержанию гипергликемии. В условиях инсулинорезистентности происходит накопление липидов в печени и синтез большого количества липопротеидов очень низкой плотности (ЛПОНП), которые быстро модифицируются в липопротеиды низкой плотности (ЛПНП) и, окисляясь под действием свободных радикалов, являются ведущим фактором развития атеросклероза [7, 10, 11].
Увеличение концентрации холестерина (ХС) в клетках приводит к изменению состава, физических свойств и функций клеточных мембран: рецепторно-опосредованного эндоцитоза, реактивности мембраносвязанных ферментов, проницаемости мембран для ионов и метаболитов. Сохранение определенной концентрации ХС плазматических мембран обеспечивает необходимое постоянство физических свойств и физического состояния бислоя мембран нормально функционирующей клетки, что лежит в основе холестеринового гомеостаза и поддерживается равновесием поступления и выведения ХС из организма. Таким образом, формируется порочный круг: постоянная гиперинсулинемия истощает секреторный аппарат бета-клеток поджелудочной железы, что приводит сначала к высокой гликемии натощак, снижению толерантности к глюкозе и впоследствии к СД 2 типа [12], гиперинсулинемия подавляет распад жиров, что способствует прогрессированию ожирения. В свою очередь адипоциты висцеральной жировой ткани секретируют свободные жирные кислоты, которые поступают непосредственно в воротную вену печени [13].
В последнее время появилось много работ, посвященных изучению влияния гипергликемии на обмен оксида азота как основного связующего звена в механизме патогенеза эндотелиальной дисфункции. При хронической гипергликемии происходит локальное снижение скорости синтеза оксида азота в эндотелии сосудов, что способствует возникновению ишемии [14]. Увеличение потребления кислорода гепатоцитами сопровождается образованием его активных радикалов и усилением реакции перекисного окисления липидов (ПОЛ). Субстрат ПОЛ – свободные жирные кислоты – высокореактивные соединения, накопление которых стимулирует развитие воспалительных реакций [15].
Нарушение метаболизма и всасывания желчных кислот и избыточное всасывание литохолевой кислоты приводят к внутрипеченочному холестазу в результате повреждения холангиоцитов токсическими желчными кислотами, печеночной дисхолии и нарушению химического состава желчи. Первичные желчные кислоты – холевая и хенодезоксихолевая – синтезируются в печени из ХС, конъюгируются с глицином или таурином и секретируются в составе желчи. Вторичные желчные кислоты, включая дезоксихолевую и литохолевую, образуются из первичных желчных кислот в толстой кишке под действием бактерий. Урсодезоксихолевая кислота и ряд других вторичных желчных кислот образуются в ничтожно малых количествах. При хроническом холестазе обнаруживается повышенное количество этих кислот. В норме соотношение количества желчных кислот, конъюгированных с глицином и таурином, составляет 3:1. Серосодержащая аминокислота таурин образует в печени конъюгаты с желчными кислотами. Образовавшиеся конъюгаты, например таурохолевая и тауродезоксихолевая кислоты, входят в состав желчи и, являясь поверхностно-активными веществами, способствуют эмульгированию жиров в кишечнике. В последнее время установлено, что таурин способствует улучшению энергетических и обменных процессов, нормализации функции клеточных мембран, стимулирует репаративные процессы при дистрофических заболеваниях.
Прогрессирование стеатогепатита зависит от уровня активности патологического процесса в печени. Неалкогольный стеатогепатит характеризуется доброкачественным и бессимптомным течением. Тем не менее гистологические изменения обнаруживаются почти у половины пациентов, а у 20% развивается цирроз. В связи с этим все усилия, направленные на лечение больных с неалкогольным стеатогепатитом, рассматриваются как профилактика цирроза печени. Эта цель определяет основные задачи терапии: нормализацию массы тела с помощью диеты и физических нагрузок; отмену гепатотоксичных препаратов; нормализацию показателей углеводного, липидного и пуринового обмена; увеличение содержания в гепатоцитах аминокислот, необходимых для синтеза апопротеинов, и коферментов для синтеза ЛПОНП; уменьшение эндотоксемии; нормализацию активности процессов ПОЛ; выведение токсических метаболитов; ингибирование воспаления в ткани печени и т.д.
Применение таурина в терапии НАЖБП и МС
Базисным методом в терапии НАЖБП является использование гепатопротекторов. Основные механизмы действия гепатопротекторов: повышение обезвреживающей функции гепатоцитов в результате увеличения запасов глютатиона, таурина, сульфатов, повышения активности ферментов, участвующих в окислении ксенобиотиков; стабилизация и репарация структур клеточных мембран в результате купирования реакций ПОЛ и связывания продуктов окисления; стимуляция процессов окисления жирных кислот и ацетата; увеличение синтеза и содержания гликогена в печеночных клетках; восстановление транспортных систем для компонентов желчи.
Продолжается поиск эффективных препаратов, обладающих гиполипидемическими свойствами, для лечения метаболических расстройств. Препараты на основе таурина хорошо зарекомендовали себя в комплексном лечении больных с ССЗ и СД 2 типа. Таурин нетоксичен, не связывается с белками, обладает антиоксидантным, детоксикационным и осморегулирущим эффектом, способствует снижению синтеза оксида азота в макрофагах [16]. Было отмечено положительное влияние препаратов на основе таурина на липидный спектр крови. Таурин – вещество, которое не метаболизируется печенью, непосредственно включается в обмен веществ. Соединяясь с холевой кислотой, таурин образует так называемые парные желчные кислоты и непосредственно участвует во всасывании жиров и жирорастворимых витаминов, а также способствует деградации ХС [17]. Таким образом, таурин может применяться с целью коррекции и профилактики метаболических нарушений в терапии НАЖБП.
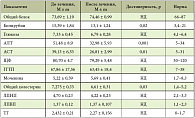
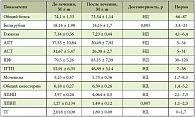
На базе ЦНИИ гастроэнтерологии (Москва) проведено двойное слепое плацебоконтролируемое сравнительное исследование, в котором оценивалась клиническая эффективность таурина у больных с НАЖБП и СД 2 типа (легкое течение, нарушение толерантности к глюкозе) в сравнении с плацебо. В исследовании участвовали 40 больных, соответствующих критериям включения. Продолжительность и схема лечения: пациенты получали препарат Дибикор (фирма-производитель «ПИК-ФАРМА») в дозе 0,5 г 2 раза в день за 20 минут до еды в течение 3 месяцев. Сопутствующая терапия: больные с СД 2 типа (нарушение толерантности к глюкозе) продолжали принимать назначенную эндокринологом терапию: метформина гидрохлорид 1000 мг в сутки; больные с ИБС, гипертонической болезнью, АГ принимали амлодипин 5 мг в сутки и эналаприла малеат 20 мг в сутки. Критериями эффективности являлись динамика клинических и биохимических параметров крови (общий билирубин, АЛТ, АСТ, щелочная фосфатаза (ЩФ), гамма-глутамилтранспептидаза (ГГТП), глюкоза), липидного спектра (ХС, ХС ЛПНП, ХС ЛПВП, ТГ), снижение массы тела. После окончания исследования с целью сравнения результатов больные были разделены на 2 группы: первая группа – больные, получавшие таурин (Дибикор), вторая группа – больные, получавшие плацебо. Для обработки данных был использован стандартный статистический пакет Statistica 6,0 с применением непараметрических методов оценки (критерий Уилкоксона – Манна-Уитни). Критический уровень значимости в исследовании был принят ≤ 0,05.
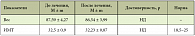
В результате проведенного исследования были получены следующие данные: переносимость препарата оценена как хорошая у 16 больных (50%), принимавших таурин (Дибикор), как удовлетворительная – у 4 больных (12,5%), неудовлетворительной оценки не отмечено. Среди пациентов, принимавших плацебо, хорошая переносимость отмечена у 10 больных (31,25%), удовлетворительная – у 2 (6,25%), неудовлетворительной оценки не зафиксировано. На основании этих результатов можно заключить, что существенной разницы между препаратом и плацебо с точки зрения переносимости не отмечено. На фоне лечения улучшение общего самочувствия отметили 20 больных (из них 18, принимавших Дибикор, и 2, принимавших плацебо): уменьшение быстрой утомляемости –11 больных; уменьшение частоты приступов одышки – 3 больных, приступов стенокардии – 4 больных; не смогли охарактеризовать изменение самочувствия 2 больных. При первичном осмотре избыточная масса тела была выявлена у 50% больных. Больные, получавшие таурин, отмечали более быстрое снижение веса – в среднем на 1 кг за месяц, что было подтверждено объективными данными.
Анализ биохимических показателей крови до лечения показывал повышение уровней АЛТ и АСТ. При этом концентрация АЛТ была выше, чем концентрация АСТ. У больных первой группы отмечался достоверно более выраженный гиполипидемический эффект (снижение уровня ХС) терапии, чем у больных, получавших плацебо (уровни ХС и ЛПНП недостоверно возрастали, причина достоверного повышения ЛПВП пока неясна). Уровень ТГ недостоверно снижался у больных, принимавших Дибикор. На фоне приема таурина показатели щелочной фосфатазы (ЩФ), ХС, ЛПНП, глюкозы снижались, а у больных, принимавших плацебо, – возрастали (табл. 1, 2). Важно отметить, что АЛТ является более специфичным маркером повреждения гепатоцитов, чем АСТ, вследствие преимущественной локализации его в паренхиме печени. Еще одним специфичным печеночным ферментом является гамма-глутамилтранспептидаза (ГГТП), уровень которой также был повышен у 35 пациентов (87,5%). Увеличение уровня билирубина выявлено у 5 больных (12,5%), максимальное значение не превышало 41,1 мкмоль/л. Показатели липидного спектра (общее содержание липидов, ЛПНП, ТГ) у обследованных больных были повышены. Прием Дибикора статистически значимо улучшал показатели билирубина, АСТ, АЛТ, ХС, фибриногена, веса, индекса массы тела (ИМТ) (табл. 3, 4).
Заключение
В результате проведенного исследования были сделаны следующие выводы: прием препарата Дибикор хорошо переносится больными, оказывает гиполипидемический и гепатопротективный эффект, способствует снижению массы тела и улучшению самочувствия больных; применение таурина при НАЖБП приводит к улучшению углеводного и жирового обмена и может быть рекомендовано для лечения и профилактики НАЖБП. Таким образом, применение препаратов на основе таурина в терапии МС и НАЖБП целесообразно не только на стадии повреждения ткани печени или нарушений углеводного обмена, подтвержденных лабораторными данными, но и для профилактики их развития.