Урогенитальные нарушения у женщин в практике уролога: все ли проблемы решает локальная монотерапия эстрогенами
- Аннотация
- Статья
- Ссылки
- English
Она подразумевает ключевую патогенетическую роль возрастного дефицита всех половых гормонов (а не только эстрогенов, как ранее) в патогенезе нарушений урогенитального тракта у женщин при естественном старении. Показана важная роль прогестерона и как биохимического субстрата для дальнейшего синтеза андрогенов и эстрогенов, и как метаболически активного гормона. Отмечено, что прогестерон обладает классическими (репродуктивными) физиологическими эффектами и целым спектром неклассических (нерепродуктивных) эффектов.
Именно поэтому в рамках комплексного и персонифицированного лечения ГУМС патогенетически обосновано применение не только традиционной монотерапии эстрогенами, но и препаратами прогестерона. Еще один аргумент в пользу замещения дефицита прогестерона с помощью локальной гормонозаместительной терапии у женщин с ГУМС – тот факт, что возрастной дефицит прогестерона развивается у них гораздо раньше эстрогеновой недостаточности.
На примере новейших исследований продемонстрированы патогенетическая целесообразность и эффективность применения комбинированного эстроген-гестагенного препарата для локальной гормонозаместительной терапии урогенитальных нарушений у женщин.
Она подразумевает ключевую патогенетическую роль возрастного дефицита всех половых гормонов (а не только эстрогенов, как ранее) в патогенезе нарушений урогенитального тракта у женщин при естественном старении. Показана важная роль прогестерона и как биохимического субстрата для дальнейшего синтеза андрогенов и эстрогенов, и как метаболически активного гормона. Отмечено, что прогестерон обладает классическими (репродуктивными) физиологическими эффектами и целым спектром неклассических (нерепродуктивных) эффектов.
Именно поэтому в рамках комплексного и персонифицированного лечения ГУМС патогенетически обосновано применение не только традиционной монотерапии эстрогенами, но и препаратами прогестерона. Еще один аргумент в пользу замещения дефицита прогестерона с помощью локальной гормонозаместительной терапии у женщин с ГУМС – тот факт, что возрастной дефицит прогестерона развивается у них гораздо раньше эстрогеновой недостаточности.
На примере новейших исследований продемонстрированы патогенетическая целесообразность и эффективность применения комбинированного эстроген-гестагенного препарата для локальной гормонозаместительной терапии урогенитальных нарушений у женщин.


Введение
Согласно официальной статистике, в РФ за последнее десятилетие существенно выросла частота заболеваний мочеполовой системы: с 12 397 693 случаев в 2002 г. до 17 047 406 в 2014 г. (+37,5%). И если в среднем по РФ показатель числа пациентов с заболеваниями мочеполовой системы на 100 тыс. населения в 2002 г. составил 8 675,6, то в 2014 г. он достиг 11 655,0, то есть увеличился на 34,3%. В 2014 г. было зарегистрировано 7 164 083 пациента с впервые в жизни установленным диагнозом заболеваний мочеполовой системы, что на 21,8% больше, чем в 2002 г., когда их было 5 880 034 [1]. Сходная ситуация наблюдается и с урогенитальными нарушениями (УГН) у женщин, частота которых также не имеет тенденции к снижению [2].
Проблема ранней диагностики и эффективной патогенетической фармакотерапии УГН у женщин решена не до конца. Нельзя не согласиться с мнением ряда авторов, которые считают, что этому во многом способствует междисциплинарный характер УГН, поскольку они представляют собой предмет интереса нескольких медицинских специальностей (прежде всего урологии и гинекологии, которые в свою очередь тесно переплетены с эндокринологией). При этом среди урологов и гинекологов, к которым сначала обращаются за медицинской помощью пациентки с УГН, нет единого понимания сущности УГН и согласованности в подходах к лечению. Имеющиеся различия в методах диагностики и терапии нередко приводят к неэффективному лечению либо вовсе к его отсутствию, что на фоне прогрессирования УГН с возрастом резко снижает качество жизни женщин [3].
Однако ошибочно полагать, что УГН затрагивают женщин преимущественно старшего возраста в период менопаузального перехода (40–50 лет) и постменопаузы (после 50 лет). Безусловно, частота и выраженность УГН у женщин с возрастом увеличиваются, что связано с формированием возрастного дефицита половых гормонов, и это известный факт. Но в настоящее время 10–15% женщин репродуктивного возраста (до 40 лет) уже страдают изолированными УГН, что обусловлено ранними гормональными перестройками на фоне стрессов, экологии, неправильного питания, алиментарного дефицита незаменимых микроэлементов и витаминов, метаболического дисбаланса (ожирения, инсулинорезистентности), приема различных лекарственных препаратов, способствующих нарушению гормонального фона и т.д. [4].
Таким образом, при рассмотрении вопроса УГН у женщин следует делать акцент не на возрастном аспекте, а на необходимости выработки единых подходов среди врачей разных специальностей для проведения более эффективной фармакотерапии и обеспечения высокого качества жизни женщины в любом возрасте.
Эпидемиология
Общеизвестно, что с возрастом распространенность УГН и степень их выраженности у женщин увеличиваются [4]. В целом в женской популяции частота УГН составляет 30–35%: от 10–15% в перименопаузе (до 40 лет) до 50% в возрасте 55–60 лет. Иными словами, с наступлением менопаузы и потом в постменопаузе каждая вторая женщина отмечает различные клинические симптомы УГН, существенно ухудшающие ее качество жизни. После 75 лет частота УГН достигает 80% из-за прогрессирования возрастных атрофических изменений в мочеполовой системе, среди которых можно выделить:
- резкое снижение регионарного кровообращения;
- развитие клеточной гипоксии в эпителии урогенитального тракта;
- ослабление митотической активности и репаративной способности эпителия влагалища, уретры, мочевого пузыря;
- уменьшение эластичности связочного и мышечного компартмента тазового дна и детрузора мочевого пузыря (возрастная потеря эластина, коллагена, функционального синцития детрузора);
- снижение природной резистентности уротелия к инфекционным агентам и т.д. [5–7].
По данным С.В. Шмелевой и соавт. (2008), легкая степень УГН наблюдается у 25% женщин с длительностью менопаузы 9–15 лет и 13% женщин с длительностью менопаузы 16 и более лет. При длительности менопаузы более 16 лет средняя степень УГН выявляется примерно в 8% случаев, а тяжелые симптомы УГН – в 5,3% случаев [8]. При этом большинство женщин считают УГН неотъемлемым атрибутом старения и не обращаются за медицинской помощью. Так, D. Barlow и соавт. (1997) опросили 2045 англичанок в возрасте 55–85 лет и выяснили, что урогенитальные симптомы беспокоили каждую вторую из них, но только 11% акцентировали на этом внимание врача [9].
В отличие от вазомоторных симптомов климактерического синдрома, зачастую нивелирующихся со временем, УГН прогрессируют и практически не корректируются без соответствующего лечения, оказывают значительное влияние на сексуальное здоровье и качество жизни женщины.
Наибольшая частота и выраженность УГН отмечаются у курящих женщин, а также у женщин, получающих лечение по поводу рака молочной железы [10].
Клиническая картина
Независимо от возраста дебюта УГН в клинической картине обычно выделяют симптомы, связанные с атрофией влагалища (вагинальную атрофию), и расстройства мочеиспускания (цистоуретральную атрофию). Симптомы цистоуретральной и вагинальной атрофии встречаются почти с одинаковой частотой, что обусловлено сходными морфологическими характеристиками эпителия влагалища и уротелия (табл. 1) [11]. Среди потенциальных клинических симптомов УГН чаще других наблюдаются сухость и зуд во влагалище (78%), нарушения мочеиспускания и различные типы недержания мочи (68%), диспареуния (26–32%), рецидивирующие инфекции влагалища (вагиниты) и мочевого пузыря (циститы) (22–25%) [11].
У 70% женщин с УГН снижается уровень сексуальной активности, поэтому женскую сексуальную дисфункцию тоже можно считать проявлением УГН и корректировать доступными способами [11]. По данным современных эпидемиологических исследований, в общей популяции женщин частота сексуальной дисфункции достигает 46%, в частности снижение сексуального желания (34%), нарушение возбуждения (23%) и оргазма (11%), боль в связи с половым актом (44%). У 47% женщин, сообщивших о снижении либидо, имеет место стрессовое недержание мочи. Еще около 45% женщин с нарушениями оргазма жалуются на ургентное недержание мочи. В целом, у женщин, страдающих УГН, риск развития сексуальной дисфункции в 1,5–2,5 раза выше, чем у здоровых женщин [12].
В настоящее время можно утверждать, что к перечисленным выше «классическим» симптомам УГН у женщин относится также синдром хронической тазовой боли, ассоциированный и с УГН, и с сексуальной дисфункцией [13–15]. Есть данные, что около 60% женщин с нарушением возбуждения и 61% женщин с хронической генитальной (тазовой) болью страдают хроническим рецидивирующим циститом [16].
В Бразилии было проведено исследование с участием 100 женщин с синдромом хронической тазовой боли, вошедших в основную группу, и 100 здоровых женщин, составивших контрольную группу. Оказалось, что женщины с синдромом хронической тазовой боли чаще страдали депрессией (63 против 38%, р = 0,001). При этом у них была выявлена положительная и независимая корреляция между депрессией и сексуальной дисфункцией (р = 0,012), которая при синдроме хронической тазовой боли также встречалась чаще (81 против 58%, р = 0,003). После коррекции по индексу женской сексуальной функции основная группа уступала контрольной по ряду показателей:
- сексуальное желание (3,0 ± 1,3 против 3,6 ± 1,3 балла, р = 0,038);
- возбуждение (2,6 ± 1,6 против 3,4 ± 1,9 балла, р = 0,002);
- увлажненность влагалища (3,2 ± 1,9 против 3,7 ± 2,3 балла, р = 0,011);
- оргазм (3,0 ± 1,9 против 3,6 ± 2,2 балла, р < 0,002);
- боль (2,5 ± 1,7 против 3,4 ± 2,2 балла, р < 0,001).
Вместе с тем между группами не было различий по показателям удовлетворенности (р = 0,337) и общему баллу женской сексуальной функции (р = 0,252) [17].
Врачу-клиницисту следует помнить, что в клинической практике чаще всего наблюдается не моносимптомное, а полисимптомное течение УГН, которое в большинстве случаев требует участия в диагностическом поиске и планировании лечебных мероприятий не только гинеколога, но и уролога.
Итак, в структуру УГН у женщин традиционно включаются заболевания и патологические состояния, развивающиеся в половой системе и нижних отделах мочевой системы. Это объясняется хорошо известным фактом общности эмбрионального происхождения, теснейшими топографо-анатомическими связями и взаимоотношениями нижних мочевых путей и органов женской половой системы, а самое главное – едиными механизмами гормональной регуляции, основанными на важной роли половых гормонов в обеспечении нормального анатомо-функционального состояния урогенитального тракта.
Современная терминология
Еще совсем недавно УГН у женщин традиционно связывались исключительно с возрастным дефицитом эстрогенов, а для общего обозначения процессов старения женского урогенитального тракта рекомендовалось использовать термин «вульвовагинальная атрофия». По сути, он был методологически неверным, поскольку отражал возрастные атрофические процессы только в половой системе, игнорируя аналогичные атрофические процессы в мочевой системе [18]. Очевидно, в определенной степени из-за этого УГН у женщин занимались преимущественно гинекологи. Урологи не всегда могли в соответствии с профильными рекомендациями оказать эффективную помощь таким пациенткам, поскольку рассматривали УГН прежде всего как гинекологическую проблему, связанную с возрастным дефицитом эстрогенов (менопаузой). Можно также предположить, что моногормональная эстрогеновая концепция патогенеза УГН у женщин также во многом сформировала и традиционные терапевтические подходы, в основе которых лежит локальное применение препаратов, содержащих только эстрогены (в виде эстриола) [19].
Революционным прорывом в современной методологии и понимании сущности УГН у женщин можно считать решение экспертов Международного общества по изучению женского сексуального здоровья и Североамериканского сообщества по менопаузе. В 2014 г. они договорились о замене общепринятого, но неполноценно отражавшего суть УГН термина «вульвовагинальная атрофия» новым термином «генитоуринарный менопаузальный синдром» (ГУМС) [20].
Согласно современному определению, ГУМС – это симптомокомплекс, который включает в себя физиологические и анатомические изменения, возникающие на фоне дефицита эстрогенов и других половых стероидов у женщин в наружных половых органах, промежности, влагалище, уретре и мочевом пузыре [20]. По мнению некоторых авторов, следовало бы расширить перечень «традиционных» зон возрастной урогенитальной атрофии за счет соединительнотканных и мышечных структур тазового дна, дисфункция которых играет одну из ключевых ролей в патогенезе УГН у женщин [21]. Однако даже несмотря на это, современное понимание ГУМС как полигормональной проблемы урогенитального тракта, а не как проблемы эстрогенов позволяет, на наш взгляд, более эффективно управлять УГН у женщин в любом возрасте. Кроме того, подобный подход объясняет распространенную недостаточную эффективность местной терапии эстрогенами при лечении многих клинических вариантов УГН, в частности хронических рецидивирующих циститов, синдрома хронической тазовой боли, определенных видов недержания мочи [22–24].
Ключевые эндокринологические механизмы
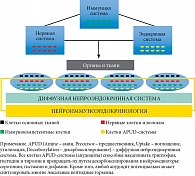
Старение урогенитального тракта следует рассматривать наряду с другими проявлениями общего старения организма, которое находится под контролем нейроиммуноэндокринных механизмов регуляции гомеостаза. Это связано с тем, что именно гармоничное взаимодействие нервной, иммунной и эндокринной систем составляет так называемый ключевой треугольник гомеостаза, обеспечивающий здоровье и активное долголетие (рис. 1) [25, 26].
Половые гормоны (прогестерон, андрогены, эстрогены) в силу их полифункциональной физиологической роли представляются одними из важнейших эндокринных регуляторов большинства функций организма как у мужчин, так и у женщин. С возрастом уровень всех половых гормонов у всех людей снижается, что совпадает с началом формирования и прогрессирования многих ассоциированных с возрастом заболеваний, в том числе и абсолютно гормонозависимого урогенитального тракта. Поэтому у ранее урологически здоровых женщин по мере старения могут появиться различные симптомы нарушений функции мочеполовой системы (стрессовое недержание мочи, гиперактивный мочевой пузырь, ноктурия, рецидивирующие воспалительные заболевания мочевого пузыря (циститы) и т.д.) [27–29].
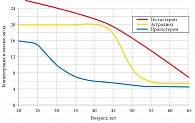
Традиционно считалось, что различные УГН у женщин связаны преимущественно с дефицитом эстрогенов, поэтому их относят к ранним проявлениям климактерического синдрома наряду с приливами и вазомоторными расстройствами [4, 11]. Однако при старении постепенно снижаются синтез и секреция всех половых гормонов. Раньше других гормонов (уже после 35 лет) сокращается выработка прогестерона. Потом начинает уменьшаться секреция андрогенов, к 40 годам их уровень становится практически в два раза ниже такового в 20-летнем возрасте [19, 30]. В период с 40 до 50 лет (менопаузальный переход) снижается синтез эстрогенов, дефицит которых формируется в среднем к 50–52 годам, когда у большинства женщин диагностируется менопауза (происходит последняя менструация) и манифестируют различные проявления эстрогеновой недостаточности (климактерический синдром) [19, 31]. Таким образом, гормональное старение у женщин начинается довольно рано (уже после 35 лет), а заканчивается с наступлением менопаузы (около 50–52 лет). Принимая во внимание этапное и последовательное формирование возрастных дефицитов всех половых гормонов (сначала прогестерона, затем андрогенов и, наконец, эстрогенов), можно сделать два вывода. Первый – рассматривать менопаузу с позиции не только дефицита эстрогенов, но и возрастной полигормональной недостаточности. Второй – признать важнейшую роль дефицита всех трех половых гормонов в процессах системного и клеточного старения, включая урогенитальный тракт, демонстрирующий эмбриологическое, топографо-анатомическое, функциональное единство и выраженную гормонозависимость (рис. 2) [32].
Сходство вагинального эпителия и уротелия, а также способность уротелия синтезировать гликоген известны еще с 1947 г. В 1948 г. описана чувствительность уротелия к эстрогенам, а в 1957 г. показана позитивная реакция уротелия на введение эстрогенов в постменопаузе [33].
Чувствительность структур урогенитального тракта к половым стероидам основана на общности и особенностях эмбриогенеза. И мочевыводящие, и половые пути происходят из промежуточной мезодермы раннего зародыша, что объясняет наличие в них рецепторов к эстрогенам, прогестерону, андрогенам и их высокую чувствительность к половым гормонам [11]. Установлено, что рецепторы к половым гормонам находятся в базальных и парабазальных клетках вагинального эпителия, гладкомышечных клетках сосудов, нижней трети влагалища, коже и поперечно-полосатых мышцах промежности, уротелии, эндотелии сосудов влагалища, стенках мочевого пузыря и уретры [34]. С помощью иммунологических и иммуноцитохимических методов во всех структурах урогенитального тракта выявлена локализация альфа- и бета-эстрогеновых, прогестероновых рецепторов (типа А и В), рецепторов к андрогенам [11]. Рецепторы к эстрогенам, которые имеют наибольшую плотность, располагаются в производных эктодермы и, вероятно, играют доминирующую роль в развитии заболеваний влагалища и вульвы.
Показано, что популяция и плотность рецепторов к половым стероидам в структурах мочевых путей и влагалища различны, что, по-видимому, объясняет разно-временный ответ на заместительную гормонотерапию. Так, если во влагалище, уретре и мочевом пузыре преобладает экспрессия обоих типов эстрогеновых рецепторов, то в промежности и нижней трети влагалища доминируют андрогеновые рецепторы, а значит, эти структуры могут чуть позже отвечать на воздействие терапии эстрогенами [11].
Экспрессия прогестероновых рецепторов в клетках-мишенях в целом и в урогенитальном тракте в частности существенно зависит от уровня эндогенных эстрогенов. Восполнение локального дефицита эстрогенов в гормонозависимых клетках женской мочеполовой системы способно позитивно влиять на эстрогензависимый путь клеточного метаболизма и одновременно активизировать экспрессию в них прогестероновых рецепторов, соответственно усиливая прогестероновый путь регуляции клеточных функций. Но при дефиците эндогенного прогестерона (он обычно начинает формироваться у женщин после 35 лет) этот механизм, несмотря на достаточность эстрогенов, нарушается, а значит, прогестерон не может проявить биологические эффекты.
Таким образом, эстрогены и прогестерон функционируют в одной «гормональной связке» [35]. Поэтому очевидно, что лишение гормонозависимых тканей урогенитального тракта эффектов прогестерона может предопределять недостаточную эффективность традиционной локальной гормонотерапии ГУМС с применением препаратов, содержащих только эстрогены. Например, нормальное анатомо-функциональное состояние влагалища обеспечивается тесным взаимодействием вагинального гормонозависимого эпителия и бактериального микробиоценоза (лактобактерий). Это важнейшие и влияющие друг на друга компоненты системы локального гомеостаза, направленной на поддержание постоянства вагинального рН-баланса на уровне 3,2–4,5 [36]. Под влиянием эстрогенов происходит рост и созревание вагинального эпителия, а также синтез и накопление в нем гликогена – ключевого субстрата для жизнедеятельности лактобактерий, который должен оказаться в просвете влагалища, чтобы его утилизировали лактобактерии. Процесс освобождения гликогена из эпителия влагалища требует обязательного участия прогестерона, который способствует формированию промежуточных слоев вагинального эпителия и его естественной десквамации. Аналогичная ситуация имеет место и в гормонозависимом уротелии нижних мочевых путей, где эстрогены выполняют столь же критические физиологические функции в отношении уротелия. Они обеспечивают его рост и созревание, синтез и накопление в нем гликогена, а также синтез локальных факторов местного иммунитета (иммуноглобулинов) и защитных мукополисахаридов – гликозаминогликанов (гиалуроновой кислоты и ее соли натрия и цинка, хондроитина сульфата, гликопротеинов, муцина). Последние составляют поверхностный гликокаликс слизистой мочевого пузыря – мощную природную систему антибактериальной и противовоспалительной защиты нижних мочевых путей [37, 38]. Однако полноценная природная антибактериальная защита уротелия, уретры и мочевого пузыря у женщин без прогестерона невозможна. Это связано с тем, что эстрогены влияют на синтез гликозаминогликанов в уротелии мочевого пузыря, а прогестерон – на выделение его эпителиальными клетками [39, 40].
Новые экспериментальные данные с культурами клеток уротелия мочевого пузыря свидетельствуют, что экспрессия Toll-подобных рецепторов пятого типа (TLR5), принимающих активное участие в обеспечении врожденного иммунитета слизистой мочевого пузыря за счет регуляции в ней синтеза соответствующего TLR5-белка, и функциональная активность макрофагального интерлейкина 6, задействованного в воспалительных реакциях, модулируются как эстрадиолом, так и прогестероном [41].
В эксперименте показано, что при дополнительном назначении натурального прогестерона лабораторным животным с моделью сепсиса уровни цитокинов системного воспаления (интерлейкина 6 и фактора некроза опухоли альфа) и показателей перекисного окисления липидов (малонового диальдегида) были достоверно ниже, чем в группе нелеченого контроля. На основании полученных результатов было высказано предположение о выраженных противовоспалительных и антиоксидантных свойствах, которые проявляет прогестерон в условиях инфекционной агрессии [42].
Особое значение прогестерон имеет для обеспечения синтеза мышечного белка, в частности в мышцах малого таза и промежности. Некоторые считают эстрогены своеобразными анаболиками для мышечной ткани, способными поддержать метаболизм еще здоровых миоцитов. Однако при уже имеющейся саркопении (дефиците количества и качества мышечной массы) вероятность того, что они смогут остановить потерю мышечной массы и восстановить ее, небольшая. Поэтому они не могут считаться терапией первой линии при саркопении, тем более что с возрастом экспрессия рецепторов к эстрогенам у женщин существенно снижается [43, 44].
При исследовании экспрессии рецепторов к половым гормонам в био-птатах мышечных и фасциальных структур m. levator ani у 55 менопаузальных женщин P. Copas и соавт. (2001) ни в одном образце не нашли доказательств ядерной экспрессии эстрогеновых рецепторов, хотя некоторые клетки мышечной стромы действительно их экспрессировали. Однако при этом экспрессия прогестероновых и андрогеновых рецепторов была обнаружена и в мышечных, и в стромальных элементах m. levator ani и ее фасции [45].
У женщин в постменопаузе терапия эстрадиолом не ассоциировалась с наращиванием мышечной массы и силы, в то время как назначение тестостерона и прогестерона увеличивало фракционную скорость синтеза ряда мышечных белков примерно на 50% по сравнению с контрольной группой и группой плацебо [46–48].
На сегодняшний день у прогестерона доказаны выраженные миелинрепаративные, анксиолитические, антидепрессивные и нейропротективные свойства, которые хорошо изучены как в экспериментальных моделях нейродегенерации, так и в клинических исследованиях (особенно в отношении невропатической боли) [49–52]. Это позволяет рассмотреть возможность назначения прогестерона женщинам по неклассическим, или нерепродуктивным, показаниям. Среди них нарушения сна, тревожно-депрессивный и астенический синдромы, хронический болевой синдром, сосудистые и травматические повреждения нервной системы и т.д. [53–57].
Кроме того, в настоящее время имеется доказательная база на уровне Кокрановского обзора, согласно которой применение натурального прогестерона для коррекции невропатической боли у женщин с идиопатическим синдромом хронической тазовой боли целесообразно и эффективно [22].
Таким образом, с точки зрения современной эндокринологии прогестерон не просто биохимический субстрат для дальнейшего синтеза андрогенов и эстрогенов, а важный самостоятельный гормон, активирующий экспрессию не менее 1800 генов (для сравнения: активация эстрогеновых рецепторов приводит к модуляции экспрессии около 600 генов, андрогеновых рецепторов – около 250 генов) [58].
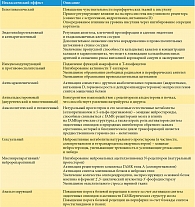
Доступные данные литературы позволяют высказать однозначное мнение, что для обеспечения нормального анатомо-функционального состояния многих органов и систем (в том числе урогенитального тракта) женщинам в любом возрасте необходим достаточный уровень как эндогенных эстрогенов, так и эндогенного прогестерона. Последний обеспечивает целый спектр позитивных эффектов за счет образования многочисленных активных метаболитов (17-альфа-гидроксипрогестерона, 11-дезоксикортикостерона, 20-альфа-дигидропрогестерона, 5-бета-прегнанолона, 5-бета-прегнандиона, 5-альфа-прегнанолона, 5-альфа-прегнандиона) (табл. 2) [59–68].
Клиническая целесообразность и эффективность применения локальной комбинированной эстроген-гестагенной терапии
Согласно общепринятому консенсусу, симптомы УГН (ГУМС) – главное показание для назначения локальной, а при сочетании симптомов УГН (ГУМС) с другими климактерическими нарушениями – системной гормонозаместительной терапии препаратами эстрогенов [4, 11, 19].
Показано, что низкодозированные эстрогены для локального применения при симптомах УГН (ГУМС) в постменопаузе более эффективны, чем системные препараты, и обладают минимальной абсорбцией. Метаанализ 54 исследований продемонстрировал статистически значимую эффективность эстрогенов при лечении симптомов УГН (ГУМС) в постменопаузе. Пик эффективности приходился на третий месяц терапии, которая в некоторых случаях, например при длительном персистировании симптомов УГН (ГУМС), может носить пожизненный характер [4, 11, 19].
Однако, как следует из вышеизложенного, современная полигормональная концепция патогенеза УГН (ГУМС) и установленная важнейшая роль прогестерона в регуляции эффектов эстрогенов в урогенитальном тракте у женщин открывают новые возможности для оптимизации традиционной фармакотерапии УГН (ГУМС). Если ранее рекомендовалось использовать только местные препараты, содержащие эстрогены, то теперь – дополнять их локальными (топическими) формами прогестерона. Таким образом, на смену терапии УГН (ГУМС) местными гормональными монопрепаратами пришла терапия комбинированными препаратами, которая обладает более выраженным патогенетическим воздействием, поскольку позволяет эффективнее достигать целей терапии УГН (ГУМС):
- улучшения кровоснабжения влагалищной стенки и детрузора;
- восстановления транссудативной функции слизистых оболочек урогенитального тракта;
- сохранения оптимального количества коллагена, обеспечивающего достаточную толщину и эластичность эпителия;
- стимуляции секреции иммуноглобулинов и локального иммунитета, препятствующих развитию рецидивирующей инфекции [69].
На данный момент в мире есть только один комбинированный эстрогенгестагенный препарат для комбинированной локальной терапии УГН (ГУМС), который, по счастью, доступен и в России. Пока его больше используют гинекологи, но постепенно он, показывая эффективность и безопасность, получает все большее распространение в урологической и урогинекологической практике.
На кафедре урологии Московского государственного медико-стоматологического университета им. А.И. Евдокимова было проведено проспективное исследование. В него включали женщин в пери- и постменопаузе в возрасте 45–80 лет, которым предстояла хирургическая коррекция пролапса тазовых органов или недержания мочи при условии, что они не получали системной менопаузальной гормонозаместительной терапии в течение шести месяцев, предшествовавших исследованию. Одна группа выступала в качестве группы сравнения. Другой группе проводилась терапия комбинированным эстроген-гестагенным препаратом во время предоперационной подготовки (в течение месяца) и послеоперационном периоде (один месяц), что способствовало более быстрому уменьшению расстройств мочеиспускания и симптомов урогенитальной атрофии, а также нормализации биоценоза влагалища на фоне улучшения показателей качества жизни [70].
Российские урологи наблюдали 125 женщин пери- и постменопаузального возраста с лабораторно подтвержденной клинической картиной атрофического вульвовагинита, которым планировалось проведение хирургической коррекции недержания мочи/пролапса тазовых органов [71]. Все пациентки были прооперированы. Основная группа (n = 95) получала локальную терапию комбинированным эстроген-гестагенным препаратом в два этапа: в течение 30 дней до операции (20 дней по две капсулы и десять дней по одной капсуле) и 30 дней после операции (две капсулы в неделю). Группу контроля составили 30 пациенток. На всех этапах лечения проводилась субъективная и объективная оценка выраженности расстройств мочеиспускания и урогенитальной атрофии (опросник UDI-6), их влияния на качество жизни (опросник IIQ-7), показателей бактериурии и биоценоза влагалища, частоты развития нежелательных явлений и послеоперационных осложнений. По исходным характеристикам группы были сопоставимы. На этапе дооперационной подготовки и в послеоперационном периоде в основной группе значимо (р < 0,05) уменьшилась частота расстройств мочеиспускания и симптомов урогенитальной атрофии, улучшились показатели биоценоза влагалища и качество жизни (табл. 3). Кроме того, в основной группе наблюдалась тенденция к снижению частоты бактериурии (р < 0,05). Однако не было значимых различий по срокам восстановления мочеиспускания после операции и продолжительности пребывания в стационаре, а кроме того, по числу послеоперационных осложнений. Тем не менее авторы пришли к выводу, что применение комбинированного эстроген-гестагенного препарата способствовало снижению выраженности ГУМС у женщин при хирургической коррекции недержания мочи или пролапса гениталий и может быть рекомендовано как в до-, так и в послеоперационном периоде [71].
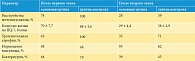
В другое исследование, проведенное российскими урологами, были включены 164 пациентки в пери- и постменопаузе, с лабораторно подтвержденной картиной ГУМС и рецидивирующими инфекциями нижних мочевых путей (циститами и уретритами) [72]. Всем женщинам проводилась стандартная антибактериальная терапия инфекций нижних мочевых путей в соответствии с результатами бактериологического посева мочи, согласно российским клиническим рекомендациям. Кроме того, пациентки основной группы (n = 67) получали комбинированный эстроген-гестагенный препарат интравагинально в два этапа: в течение 20 дней по две капсулы в сутки, затем в течение десяти дней по одной капсуле в сутки. Пациенткам группы сравнения (n = 67) дополнительно был назначен монопрепарат эстрогена в два этапа: в течение 14 дней по одному суппозиторию в день, далее в течение 14 дней по одному суппозиторию два раза в неделю. В группу контроля вошли 30 пациенток, получавших только стандартную антибактериальную терапию по поводу инфекций нижних мочевых путей, локальная гормональная терапия ГУМС им не проводилась. Период наблюдения составил 12 месяцев после окончания курса лечения. По исходным характеристикам группы были сопоставимыми. На всех этапах исследования в группе пациенток, получавших терапию с применением комбинированного эстроген-гестагенного препарата, имела место более выраженная положительная динамика (р < 0,05) (табл. 4). На момент включения в исследование во всех трех группах у 100% пациенток инфекции мочевых путей (цистит, уретрит) носили рецидивирующий характер – не менее трех эпизодов за последний год. За период лечения и наблюдения (12 месяцев) в основной группе не зафиксировано ни одного эпизода инфекции мочевых путей. В группе сравнения рецидив инфекции мочевых путей перенесли 47% пациенток, а в группе контроля – 62% пациенток. Таким образом, применение комбинированного эстроген-гестагенного препарата в комплексной терапии рецидивирующих циститов и уретритов у женщин с ГУМС в пери- и постменопаузе приводило к улучшению результатов лечения инфекций нижних мочевых путей, снижению выраженности симптомов ГУМС и частоты рецидивов и может быть рекомендовано к использованию у таких пациенток [72].
В исследование А.В. Кузьменко и соавт. (2019) включено 60 женщин в возрасте 45–65 лет, страдающих постменопаузальным атрофическим вагинитом и хроническим рецидивирующим бактериальным циститом в стадии обострения [73]. Пациентки были разделены на две группы по 30 человек. Всем женщинам в течение трех месяцев проводилась этиотропная антибиотикотерапия, в первой группе – в сочетании с местной монотерапией эстрогенами, во второй группе – в сочетании с комбинированным эстроген-гестагенным препаратом. Эффективность лечения оценивали на первые, седьмые сутки терапии и через три месяца. Нормализация рH влагалища, восстановление его биоценоза и вследствие этого уменьшение жалоб на сухость и жжение во влагалище, а также диспареунию отмечены у 83,3% женщин первой группы и 96,7% женщин второй группы. Поддерживающий прием комбинированного препарата в течение трех месяцев позволил сохранить нормобиоценоз влагалища до восстановления его трофики, уменьшить частоту бактериурии и лейкоцитурии на 20% по сравнению с результатами первой группы и статистически значимо (р < 0,05) сократить количество рецидивов инфекции [73].
Таким образом, доступный клинический опыт применения комбинированного эстроген-гестагенного препарата для локальной терапии УГН (ГУМС) у женщин показывает его выраженный и стойкий лечебно-профилактический эффект в отношении различных клинических вариантов УГН (ГУМС) по сравнению с традиционной местной монотерапией эстрогенами, что позволяет рекомендовать его более широкое внедрение в рутинную урологическую практику.
Заключение
Сегодня назрела необходимость оптимизации современной локальной гормонотерапии различных УГН у женщин, объединенных методологически правильным современным термином ГУМС.
Нужно учитывать, что урогенитальный тракт – одна из самых гормонозависимых систем организма, а половые гормоны (и прежде всего эстрогены и прогестерон) тесно взаимодействуют в процессе регуляции всех функций в организме женщины. С этой точки зрения прогестерон, обладающий уникальными и позитивными локальными эффектами, может стать важным дополнением к местному лечению УГН (ГУМС) эстрогенами. Кроме того, дефицит прогестерона при естественном старении женщины развивается гораздо раньше эстрогеновой недостаточности и, безусловно, требует замещения.
Знакомство урологов с новой концепцией УГН (ГУМС) у женщин и современными подходами к патогенетической локальной гормонозаместительной терапии этих нарушений представляется сейчас крайне важным. К урологам обращается за помощью большое число пациенток с ГУМС, а спектр лечебных мероприятий, которые они могут предложить, ограничен. В результате искусственно создается ситуация «неизлечимого» заболевания. Между тем большинству из этих женщин можно помочь, если, опираясь на новую концепцию УГН (ГУМС), оптимизировать локальную гормонозаместительную терапию УГН (ГУМС) путем более широкого применения в клинической урологической практике эффективного и безопасного комбинированного препарата, содержащего эстроген и прогестерон.
I.A. Tyuzikov, PhD
Medical Сenter ‘Tandem-Plus’, Yaroslavl
Contact person: Igor A. Tyuzikov, phoenix-67@list.ru
The review article deals with the actual problem of optimization of local hormone therapy of urogenital disorders in women from the standpoint of evidence-based medicine based on the modern multifactorial concept of genitourinary syndrome of menopause, which implies a key pathogenetic role of age deficiency of all sex steroid hormones (and not only estrogen) in the pathogenesis of urogenital tract disorders in women with natural aging. From the standpoint of the new methodology of urogenital disorders in women, the important role of progesterone is shown not only as a biochemical substrate for the further synthesis of androgens and estrogens, but as a metabolically active hormone that has not only classical (reproductive) physiological effects in a woman’s body, but also a whole spectrum of non-classical (non-productive) effects, which are pathogenetic justification of expediency of additional appointment of local preparations of progesterone to traditional estrogen containing monotherapy within the complex and personalized treatment of various clinical manifestations of genitourinary syndrome of menopause. Another justification for the need to replace progesterone deficiency in local hormone replacement therapy genitourinary syndrome of menopause in women is the fact that age-related progesterone deficiency develops in them much earlier than estrogen deficiency. In addition the pathogenetic expediency and effectiveness of the use of estrogen-progesterone combination for local hormone replacement therapy of urogenital disorders in women have been demonstrated by the example of recent studies.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.