Гормональные механизмы патогенеза хронического рецидивирующего цистита у женщин как перспективная фармакотерапевтическая опция управления заболеванием
- Аннотация
- Статья
- Ссылки
- English
Неуклонный рост антибиотикорезистентности на фоне ограниченного количества эффективных антимикробных химиопрепаратов снижает успех терапии и профилактики данного заболевания, а невысокая результативность традиционного моноантибактериального подхода обусловливает необходимость поиска новых методов лечения хронического рецидивирующего цистита.
Мочевой пузырь является гормонозависимым органом, и современная эндокринно-аутокринно-паракринная теория его регуляции позволяет рассматривать хронический рецидивирующий цистит как своеобразную инфекционно-бактериальную вершину айсберга гормонального нездоровья мочевого пузыря у женщин.
В статье подробно описываются достоверно изученные механизмы участия эстрогенов, прогестерона, андрогенов и витамина D в патогенезе хронического рецидивирующего цистита у женщин. Отмечается, что коррекция их дефицита влияет на клинико-лабораторные и морфометрические параметры при этом заболевании. Анализ доступных данных показал, что управление метаболизмом и природной антимикробной защитой мочевого пузыря через гормональные механизмы его регуляции, очевидно, можно считать перспективной и эффективной фармакотерапевтической опцией при хроническом рецидивирующем цистите. По сравнению с традиционной этиотропной антимикробной монохимиотерапией она позволяет существенно улучшить лечебно-профилактические результаты и качество жизни пациенток.
Неуклонный рост антибиотикорезистентности на фоне ограниченного количества эффективных антимикробных химиопрепаратов снижает успех терапии и профилактики данного заболевания, а невысокая результативность традиционного моноантибактериального подхода обусловливает необходимость поиска новых методов лечения хронического рецидивирующего цистита.
Мочевой пузырь является гормонозависимым органом, и современная эндокринно-аутокринно-паракринная теория его регуляции позволяет рассматривать хронический рецидивирующий цистит как своеобразную инфекционно-бактериальную вершину айсберга гормонального нездоровья мочевого пузыря у женщин.
В статье подробно описываются достоверно изученные механизмы участия эстрогенов, прогестерона, андрогенов и витамина D в патогенезе хронического рецидивирующего цистита у женщин. Отмечается, что коррекция их дефицита влияет на клинико-лабораторные и морфометрические параметры при этом заболевании. Анализ доступных данных показал, что управление метаболизмом и природной антимикробной защитой мочевого пузыря через гормональные механизмы его регуляции, очевидно, можно считать перспективной и эффективной фармакотерапевтической опцией при хроническом рецидивирующем цистите. По сравнению с традиционной этиотропной антимикробной монохимиотерапией она позволяет существенно улучшить лечебно-профилактические результаты и качество жизни пациенток.

Введение
Инфекции нижних мочевыводящих путей (циститы) у женщин – одна из самых актуальных проблем современной амбулаторной урологии, что обусловлено прежде всего их высокой распространенностью, причем частота заболеваемости увеличивается с возрастом. Согласно имеющимся данным, каждый год около 15% сексуально активных женщин репродуктивного возраста переносят по крайней мере один эпизод острого бактериального цистита и не менее 60% женщин хотя бы раз страдали этим заболеванием [1]. После острого бактериального цистита примерно у 50% женщин в течение года развиваются рецидивы заболевания, которые в 15–25% случаев переходят в хронический рецидивирующий цистит (ХРЦ). Во многих случаях ХРЦ приобретает упорное клиническое течение и характеризуется недостаточной эффективностью проводимых фармакотерапевтических мероприятий, что сопровождается тяжелой медико-социальной и психологической дезадаптацией пациенток и резким ухудшением их качества жизни [2–4].
В настоящее время практически все исследователи и клиницисты отмечают мультифакторную природу феномена снижения эффективности современной антибактериальной терапии ХРЦ, которая чаще всего представлена сочетанием нескольких патогенетических механизмов.
Во-первых, механизмы микроорганизмов [5, 6]:
- способность бактерий к формированию биопленок в слизистой мочевого пузыря;
- способность бактерий передавать следующим поколениям штаммов мутации, приводящие к повышению экспрессии ключевых ферментов распада антибиотиков;
- структурная модификация синтезируемых бактериями эндо- и экзотоксинов и др.
Во-вторых, механизмы макроорганизма [7, 8]:
- снижение механизмов природной и приобретенной иммунологической реактивности (например, снижение синтеза уротелием секреторного иммуноглобулина A и защитных гликозаминогликанов слизистой);
- высокая чувствительность к аллергенам, что во многих случаях ограничивает проведение антимикробной терапии;
- хронические заболевания, сопровождающиеся потенциальной способностью изменять метаболизм антибиотика в организме (заболевания печени и желудочно-кишечного тракта, микроэкологические нарушения кишечника и т.д.).
В-третьих, фармакологические механизмы [9–11]:
- практически полное отсутствие синтеза новых эффективных классов антибиотиков за последние десятилетия;
- ограниченный механизм действия ряда антимикробных химиопрепаратов;
- бесконтрольное и нерациональное назначение антибиотиков в клинической практике;
- использование некачественных дженериков;
- широкое назначение ветеринарных антибиотиков животным, ведущее к последующей сенсибилизации иммунной системы человека при употреблении мяса таких животных, и др.
Мировая волна антибиотикорезистентности в различных ее проявлениях, захлестнувшая подавляющее большинство стран мира, включая Россию, заставляет сегодня активно искать пути более эффективного решения проблемы фармакотерапии многих инфекционных заболеваний, в том числе ХРЦ у женщин. Поскольку возможности синтеза новых эффективных антибиотиков для борьбы с микроорганизмами в настоящее время ограничены, следует обратить внимание на второго участника инфекционно-воспалительного процесса – макроорганизм, который противостоит патогену. Исход инфекционного воспаления зависит не от микроорганизма и макроорганизма по отдельности, а представляет собой результат их противостояния и взаимодействия, опосредованный огромным количеством механизмов с обеих сторон. В частности, это необходимо учитывать при рассмотрении инфекционного поражения мочевого пузыря, который с физиологической точки зрения не просто выполняет роль пассивного резервуара для мочи, а является гормонозависимым органом. Все его структуры находятся под определенным гормональным контролем, который обеспечивает многие физиологические функции: от накопительно-резервуарной и эвакуаторной до уротелий-протективной, нейроэндотелиальной (иннервация и кровоснабжение) и особенно локальной бактерицидной. Последняя функция обусловливает известный и достаточно высокий уровень природной антибактериальной резистентности уротелия мочевого пузыря [12–14]. Очевидно, что рассмотрение вопросов патогенеза ХРЦ с позиций гендерной эндокринологии позволит найти новые фармакотерапевтические опции для более эффективного управления этим распространенным среди женщин заболеванием.
Роль гормональных механизмов в регуляции функций мочевого пузыря у женщин
Зависимость состояния уротелия мочевого пузыря у женщин от уровня половых гормонов была установлена еще в 1947 г. [15]. В дальнейших исследованиях была показана ключевая роль половых гормонов (в частности, эстрогенов и прогестерона) в обеспечении синтеза уротелием защитных мукополисахаридов (гликозаминогликанов): гиалуроновой кислоты и ее солей натрия и цинка, хондроитина сульфата, гликопротеинов, муцина. Они составляют поверхностный гликокаликс слизистой мочевого пузыря – мощную природную систему антибактериальной защиты (антиадгезивный фактор), утрата которой закономерно повышает восприимчивость уротелия к различным неблагоприятным воздействиям, включая инфекционные агенты. Сегодня это считается одним из ключевых проявлений дисфункции уротелия, лежащей в основе патогенеза ХРЦ и его рецидивов [16–19].
Работы последних десятилетий свидетельствуют, что ХРЦ может рассматриваться как своеобразная инфекционная верхушка айсберга метаболического и гормонального нездоровья мочевого пузыря, поскольку при общем нездоровье частота ХРЦ повышается [20–22]. Следует отметить распространенность различных гормонально-метаболических нарушений у современных женщин: ожирения, инсулинорезистентности, дислипидемии, артериальной гипертензии (эндотелиальной дисфункции), сахарного диабета второго типа, саркопении (дефицита количества и качества мышечной массы), дефицита витамина D, возрастного дефицита половых гормонов и т.д. При указанных метаболических нарушениях риск развития и рецидивирования ХРЦ существенно возрастает [23–26].
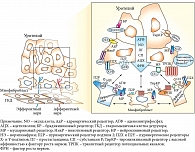
К настоящему времени накоплено огромное количество научных клинико-экспериментальных исследований, позволяющих говорить о том, что мочевой пузырь – единая функциональная система. И все ее элементы (уротелиальные клетки, нервные окончания (нейротелий), сосуды (эндотелий), миоциты и миофибробласты (миотелий)) находятся в постоянном и активном взаимодействии, направленном на поддержание физиологической комплаентности органа с целью адаптации и обеспечения его оптимальных функций в постоянно меняющихся условиях внешней и внутренней среды. Уротелиальные и другие клетки мочевого пузыря могут быть активированы или заблокированы посредством различных гормональных механизмов, как системных эндокринных (дистанционно через централизованную эндокринную систему), так и клеточных аутокринных и паракринных (локально через диссеминированную нейроэндокринную систему). Эта новая гипотетическая модель функционирования и регуляции мочевого пузыря получила название эндокринно-аутокринно-паракринной модели (рис. 1) [20].
Согласно эндокринно-аутокринно-паракринной модели, гормональная регуляция мочевого пузыря, как и многих других органов, осуществляется биологически активными веществами различной химической природы – гормонами. Они синтезируются в специализированных эндокринных железах и попадают в клетки органов и тканей, в которых имеется экспрессия соответствующих рецепторов, через системный кровоток (дистанционная гормональная регуляция). В настоящее время доказана важная роль половых гормонов (эстрогенов, прогестерона, андрогенов), витамина D, инсулина в обеспечении метаболизма и энергетического обмена во всех клетках мочевого пузыря (установлена экспрессия в мочевом пузыре рецепторов к соответствующим гормонам). Кроме того, показано большое значение в этом процессе гормона сна (мелатонина), гормона роста (соматотропина), оказывающего физиологические эффекты через инсулиноподобный фактор роста 1, а также гормонов жировой ткани (лептина, адипонектина, адипсина, резистина, десмина и др.) [27–35].
Кроме классического дистанционного механизма гормональной регуляции, осуществляемой гормонами специализированной эндокринной системы, в клетках мочевого пузыря имеются и локальные гормональные сигнальные пути, реализуемые через аутокринные и паракринные механизмы. При аутокринном механизме клетка способна к самостоятельному синтезу местного гормона (гормоноподобного вещества) и при этом имеет к нему же соответствующие рецепторы. Иными словами, клетка одновременно является и продуцентом гормона, и клеткой-мишенью. В качестве примера можно привести эндотелины, вырабатываемые клетками эндотелия, в том числе в сосудах мочевого пузыря, которые непосредственно влияют на функцию этих же эндотелиальных клеток. Паракринный механизм регуляции заключается в том, что секретируемые клетками-продуцентами биологически активные вещества (местные гормоны) распространяются в ткани за счет диффузии и действуют на соседние клетки-мишени. Так функционируют многие митогенные стимуляторы (полипептидные ростовые факторы): эпидермальный фактор роста, фактор роста тромбоцитов, интерлейкин 2 (фактор роста Т-клеток), фактор роста нервов и др. [36].
Известно, что, с одной стороны, стимуляция рецепторов и мембранных каналов в уротелиальных клетках может приводить к высвобождению многих медиаторов, которые регулируют функции нервных окончаний и других типов клеток мочевого пузыря. С другой стороны, клетки уротелия сами могут быть мишенью для медиаторов, высвобождаемых клетками нейротелия, эндотелия или других типов клеток. Местные медиаторы в тканях мочевого пузыря высвобождаются благодаря адаптивному взаимодействию симпатического и парасимпатического отделов вегетативной нервной системы при участии системных и локальных гормональных механизмов (нейроэндокринная регуляция), что позволяет мочевому пузырю, морфологически состоящему из различных типов клеток, работать как единый функциональный синцитий [20]. В этой слаженной системе важная роль отводится централизованному эндокринному компоненту нейровегетативной регуляции функций мочевого пузыря, поскольку гормоны воздействуют на анатомо-функциональное состояние всех структурных элементов мочевого пузыря как прямо, так и опосредованно, регулируя функциональную активность и экспрессию различных рецепторов в уротелии и нейромышечных элементах детрузора. Известно, что у женщин эффекты эстрогенов реализуются через модуляцию активности и экспрессии преимущественно альфа-адренорецепторов сосудов мочевого пузыря, а эффекты прогестерона – через бета-адренорецепторы в клетках детрузора [12].
Результаты современных исследований доказывают важную роль всех половых гормонов в регуляции различных физиологических процессов у женщин (транскрипции, связывании металлов и ДНК, внутриклеточной передаче сигнала, активации генов синтеза белков, углеводном и жировом обмене, функционировании митохондрий клеток и т.д.). В этих процессах участвуют и эстрогены (активация эстрогеновых рецепторов приводит к модулированию экспрессии около 600 генов), и прогестерон (активация прогестероновых рецепторов вызывает модулирование около 1800 генов), и андрогены (активация андрогеновых рецепторов ведет к изменениям экспрессии около 250 генов) [37]. Активация рецепторов витамина D приводит к модулированию экспрессии не менее 2727 генов, что отражает крайнюю физиологическую важность постоянства баланса витамина D в организме, поскольку этот витамин, будучи по сути активным стероидным гормоном, регулирует не менее 3% генома человека, в том числе гены инсулинового рецептора, обмена глюкозы и стероидогенеза [38–40].
С возрастом уровень всех половых стероидных гормонов и витамина D у представителей обоих полов снижается, что совпадает с началом формирования и прогрессирования большинства возраст-ассоциированных заболеваний, в том числе урогенитального тракта [41]. Поэтому у женщин с возрастом могут манифестировать различные симптомы нарушений функции мочеполовой системы, которых раньше не было: стрессовое недержание мочи, гиперактивный мочевой пузырь, ноктурия, рецидивирующие воспалительные заболевания мочевого пузыря (циститы) и т.д. [42–44].
Различные урогенитальные нарушения у женщин наряду с приливами и вазомоторными расстройствами традиционно относят к ранним проявлениям эстрогенового дефицита [41]. Однако, согласно современной точке зрения, женщины (как и мужчины) физиологически нуждаются во всех половых гормонах (гестагенах, андрогенах, эстрогенах), синтез которых постепенно снижается по мере старения. Раньше других гормонов (уже после 35 лет) сокращается выработка прогестерона. Далее начинает уменьшаться уровень андрогенов, к 40 годам сокращаясь практически в два раза по сравнению с 20-летним возрастом [41, 45]. В период с 40 до 50 лет (менопаузальный переход) снижается синтез эстрогенов, дефицит которых формируется в среднем к 50–52 годам, когда у большинства женщин диагностируется менопауза и манифестируют различные симптомы эстрогеновой недостаточности (климактерический синдром), в том числе довольно рано возникающие урогенитальные расстройства (рис. 2) [46, 47]. При этом в каждом временном промежутке по мере снижения синтеза и ослабления действия того или иного полового гормона можно наблюдать соответствующие клинические проявления со стороны нижних мочевых путей [48–51].
Роль эстрогенов в патогенезе хронического рецидивирующего цистита у женщин
Рецепторы к эстрогенам типов альфа и бета – основные внутриклеточные механизмы реализации физиологических эффектов эстрогенов во всех органах и тканях, включая самые эстрогензависимые структуры женского организма – мочеполовую и репродуктивную системы [52]. Эстрогеновые рецепторы у женщин в большом количестве экспрессируются слизистыми оболочками, мышцами, нейротелием и сосудами влагалища (в базальном и парабазальном слоях), уретры, треугольника Льето, дна мочевого пузыря, детрузора и нижней трети мочеточников, а также в связочном аппарате малого таза [53]. Эстрогены модулируют экспрессию рецепторов к прогестерону, а прогестерон в свою очередь влияет на эффекты эстрогенов [53]. В уротелии нижних мочевых путей и вагинальном эпителии эстрогены выполняют самые критические физиологические функции по обеспечению природной защиты от инфекции:
- обеспечивают рост и созревание многослойного плоского эпителия;
- обеспечивают синтез и накопление в плоском эпителии гликогена, необходимого для метаболизма лактобактерий системы вагинального биотопа и поддержания кислого рН-баланса во влагалище, играющего ключевую роль в обеспечении местного иммунитета и антибактериальной защиты;
- регулируют синтез цервикальной слизи и иммуноглобулина A – дополнительный плацдарм антибактериальной защиты мочеполовой системы [54];
- активно участвуют в регуляции локального кровообращения в мочевом пузыре, уретре и органах малого таза (описаны их эндотелийзависимый и эндотелийнезависимый вазомодулирующий эффект) [55].
В норме при достаточном уровне эндогенных эстрогенов естественные механизмы локального кровообращения и бактериальной защиты урогенитального тракта работают адекватно, защищая женщину более чем от 90% инфектов, поступающих извне во влагалище, шейку матки и уретру [54]. Это достигается как за счет метаболизма лактобактерий (продукция молочной кислоты и перекиси водорода), обеспечивающего кислую рН-среду вагинального и цервикального секретов (закисление влагалища и непрямой бактерицидный эффект в отношении патогенной микрофлоры), так и благодаря непосредственной секреции лактобактериями биосурфактантов, факторов коагрегации и бактериоцинов, оказывающих прямое бактерицидное влияние на любую патогенную микрофлору влагалища и периуретральной зоны [55].
Дефицит эстрогенов у женщин сопровождается нарушением кровоснабжения мочевого пузыря и уретры, резким ослаблением барьерной функции уротелия и влагалища в результате снижения эстрогензависимой митотической активности и пролиферации эпителия влагалища и уретры, а также потерей эластичности детрузора на фоне формирования трабекулярности и атрофии слизистых оболочек. Следствием этого становится резкое ухудшение естественного местного иммунитета уротелия и повышение частоты ХРЦ, как при менопаузальных циститах, когда в качестве первой линии проводится именно локальная заместительная гормональная терапия препаратами эстрогенов [56].
Бактериальная обсемененность мочевого пузыря – только предпосылка к воспалению, реализация которого происходит при нарушении структуры и функции мочевого пузыря. Считается, что контроль эпителиальной проницаемости в мочевом пузыре традиционно осуществляется благодаря уникальному строению эпителия, который представляет собой ионную помпу из-за специальных соединений между клетками. В то же время известно, что изнутри уротелий покрыт тонким защитным слоем протеогликанов, или гликозаминогликанов, с помощью которого создается и поддерживается барьер между стенкой мочевого пузыря и мочой (барьер «кровь – моча»). Поверхностные протеогликаны, или муцин, выполняют в мочевом пузыре различные защитные функции, включая антиадгезивную, и регулируют трансэпителиальное движение растворов. Переходные клетки наружной поверхности гликозаминогликанового слоя способны предотвращать адгезию бактерий, кристаллов, протеинов и ионов.
В защитной системе слизистой оболочки мочевого пузыря важная роль отводится гликопротеину, который покрывает слизистую мочевого пузыря, тем самым защищая подлежащие ткани мочевого пузыря от воздействия мочи как агрессивного химического фактора, а также выполняет антисептическую функцию.
Гликокаликс вырабатывается переходным эпителием. Обволакивая микроорганизмы, попавшие в мочевой пузырь, он их элиминирует. Образование мукополисахаридного слоя уротелия (локальная продукция муцина слизистой) у женщин – облигатно гормонозависимый процесс, где эстрогены влияют на его синтез, а прогестерон – на выделение его при периодической десквамации уротелиальных поверхностных клеток, четко соответствующей цикличности эндометрия, вагинального и цервикального эпителия в течение менструального цикла [44, 57].
Роль прогестерона в патогенезе хронического рецидивирующего цистита у женщин
В мочевом пузыре экспрессируется две изоформы прогестероновых рецепторов (А и В) [58, 59]. По данным последних исследований, прогестерон активирует релаксацию мышечных элементов шейки мочевого пузыря, воздействуя на синтез циклического гуанозинмонофосфата и оксида азота (NO), а также активизируя АТФ-зависимые и кальцийзависимые калиевые каналы мембран уротелиальных клеток, что приводит к ингибированию выхода ионов кальция из клетки в межклеточное пространство [60]. Без участия прогестерона невозможна полноценная природная антибактериальная защита многослойного плоского эпителия уретры, мочевого пузыря и влагалища. Именно прогестерон вместе с эстрогенами обеспечивает цитолиз и десквамацию многослойного плоского эпителия влагалища и нижних мочевых путей. В результате происходит высвобождение гликогена, необходимого для жизнедеятельности лактобактерий влагалища, он же способствует синтезу ими молочной кислоты и перекиси водорода, обеспечивающей закисление влагалища и постоянство рН вагинального секрета. Так проявляется мощный природный защитный механизм от патогенной анаэробной микрофлоры [61, 62].
В уротелии прогестерон активно взаимодействует не только с эстрогеновыми рецепторами, но и с андрогеновыми рецепторами первого типа, причем он регулирует активность фермента 5-альфа-редуктазы, трансформирующей тестостерон в более активный метаболит 5-альфа-дигидротестостерон, что делает прогестерон природным ингибитором 5-альфа-редуктазы. Кроме того, прогестерон выступает в роли конкурента андрогенов при регуляции активности андрогеновых рецепторов [63, 64].
В настоящее время доказано, что прогестерон оказывает мощный нейрорепаративный и нейропротективный эффект, который проявляется в способности индуцировать и активировать процессы синтеза миелина в шванновских клетках, регулировать миелинизацию нервных волокон в центральной и периферической нервной системе и препятствовать деградации миелина. Это обусловливает перспективы его применения в профилактике и лечении демиелинизирующих, нейродистрофических и нейродегенеративных заболеваний различных локализаций, а также в коррекции невропатического хронического болевого синдрома у женщин [65–67].
Кроме того, у прогестерона обнаружены выраженные васкулотропные эффекты, благодаря которым он влияет на состояние регионарной гемодинамики органов малого таза, включая матку, влагалище и мочевой пузырь [68]. Показано, что назначение препаратов натурального прогестерона после овариэктомии и в постменопаузе способствовало быстрой ликвидации явлений тазовой венозной конгестии – одного из важнейших факторов, поддерживающих хроническое рецидивирующее воспаление мочевого пузыря вследствие персистенции инфекции в условиях функциональной гипоксии уротелия [69].
Прогестерон и его важнейший мозговой метаболит аллопрегнанолон относятся к основным мозговым нейротрансмиттерам (нейростероидам), участвующим в центральных механизмах рецепции и перцепции боли [70]. С одной стороны, они задействованы в процессах адаптации, обеспечивая стрессоустойчивость. Наблюдаемое увеличение синтеза прогестерона в ткани головного мозга, установленное в экспериментальных исследованиях, рассматривается как ответная реакция нервных клеток на любое повреждение, поэтому не зря прогестерон называют гормоном спокойствия и релаксации [71]. С другой стороны, клиническому течению ХРЦ всегда сопутствуют психоэмоциональные нарушения различной степени выраженности (от повышенной тревожности и астенического синдрома до тяжелых астено-депрессивных проявлений). По этой причине дополнительный прием прогестерона при его диагностированном дефиците (лютеиновой недостаточности) у женщин репродуктивного возраста сегодня рассматривается как новая фармакотерапевтическая возможность патогенетической коррекции не только общих психосоматических нарушений, связанных с ХРЦ, но и локального синдрома хронической тазовой боли, с которым часто ассоциируется ХРЦ и который может выступать как его своеобразная клиническая «маска» [72, 73].
Роль андрогенов в патогенезе хронического рецидивирующего цистита у женщин
С возрастом у женщин значительно снижается уровень не только прогестерона и эстрогенов, но и андрогенов. Например, концентрация общего и свободного тестостерона, андростендиона и дегидроэпиандростерона в 45-летнем возрасте составляет в среднем 50%, в 60-летнем – около 30%, в 70-летнем – 10% от уровня этих гормонов в возрасте 20 лет [74–76]. Дефицит андрогенов, которому у женщин практически не уделяется внимания, негативно влияет на все органы и системы организма, включая мочеполовую, поскольку андрогеновые рецепторы в изобилии представлены во всех ее структурных элементах. Кроме того, известно, что от уровня эстрогенов зависит экспрессия андрогеновых рецепторов, а прогестерон выступает в качестве гормона, обеспечивающего модуляцию эффектов как эстрогенов, так и тестостерона [77–79].
Показана физиологическая роль андрогенов в поддержании рефлекторных путей тазовой части автономной нервной системы, в частности ответственных за накопление мочи в мочевом пузыре [80]. В женской мочевой системе на основе экспериментальных исследований обнаружена экспрессия гена фосфодиэстеразы пятого типа и NO-синтаз, основной функцией которых является участие в синтезе оксида азота и регуляции NO-зависимой вазодилатации, иннервации, метаболизма и энергетического обмена органов урогенитального тракта [81].
По данным M.Н. Ho и соавт. (2004), андрогены оказывают анаболическое влияние на скелетные мышцы, опосредованное целым рядом механизмов (индукцией синтеза белка, модуляцией трансформации плюрипотентных мезенхимальных клеток в миоциты и т.д.). В мышцах тазового дна и нижних мочевых путях содержится огромное количество андрогеновых рецепторов, что делает эти мышцы высокочувствительными к анаболическим эффектам андрогенов, в том числе у женщин [82]. Показано, что в мышце-леваторе ануса у крыс плотность андрогеновых рецепторов оказалась существенно выше, чем в любой другой скелетной мышце организма [83].
Блокада андрогеновых рецепторов в эксперименте приводила к изменениям в мышцах тазового дна, аналогичным тем, которые происходят при их денервации, а восполнение дефицита тестостерона способствовало коррекции в этих мышцах морфологических нарушений [84, 85].
У женщин без пролапса матки плотность андрогеновых рецепторов в мышечных и соединительнотканных структурах тазового дна и связочного аппарата матки была в 3,57 раза выше, чем у женщин с генитальным пролапсом [86].
Концентрация андрогенов в моче у женщин с недержанием мочи положительно коррелирует со степенью опущения шейки мочевого пузыря, определяемой при ультразвуковом исследовании [87].
Тестостерон в мочевой системе выступает в качестве одного из ключевых строительных анаболических гормонов, обеспечивающих количество и качество мышечных элементов детрузора, уретры, сфинктеров и тазового дна. Как показано на лабораторных моделях самок со стрессовым недержанием мочи, назначение тестостерона благоприятно влияет на анатомо-функциональное состояние мышц тазового дна, что подтверждается гистопатоморфологическими исследованиями, и уменьшает степень выраженности стрессового недержания мочи, сопутствующего ХРЦ [88].
F. Cayan и соавт. (2008) в экспериментальном исследовании выявили существенные нарушения функции мочевого пузыря у самок крыс, подвергшихся овариэктомии. Добавление к терапии эстрогенами препаратов тестостерона привело к более выраженному увеличению мышечной массы детрузора и улучшению коллагенового статуса мочевого пузыря по сравнению с группой контроля [89].
Одним из механизмов универсального воздействия андрогенов на нижние мочевые пути может быть противовоспалительное влияние на мышечную ткань, благодаря которому инактивируются эффекты в отношении деградации мышечных белков и их участия в активации NO-синтаз и L-аргиназ – клеточно-тканевых ферментов, активно задействованных в синтезе оксида азота в нейроэндотелии и мышечных белков у обоих полов. Андрогены усиливают экспрессию NO-синтазы и регулируют активность L-аргиназы (основного биохимического конкурента NO-синтазы в процессе гидролиза L-аргинина как субстрата для синтеза NO) в клетках урогенитального тракта, что может проявляться в облегчении релаксации гладких мышц влагалища, малого таза и детрузора [90]. Эстрогены способны снижать активность NO-синтазы и повышать активность L-аргиназы, что может привести к ухудшению регионарной миорелаксации за счет возникающего дефицита оксида азота и, как следствие, тканевой и клеточной гипоксии. Таким образом, баланс внутриклеточных эффектов андрогенов и эстрогенов представляет собой важную гомеостатическую константу. Она необходима для обеспечения адекватного локального кровообращения тканей мочевого пузыря и косвенно отражает его способность к восприимчивости к разного рода инфекционным агентам [91, 92].
Сегодня достоверно известно, что поддержание нормального уровня тестостерона у женщин ассоциируется с более поздними проявлениями генитоуринарного менопаузального синдрома, которые ранее объединяли под термином «вульвовагинальная атрофия» и неверно ассоциировали исключительно с возрастной эстрогеновой недостаточностью. Новый термин «генитоуринарный менопаузальный синдром» официально одобрен в 2014 г. соответствующими комитетами Северо-Американского общества по менопаузе, Международным обществом по изучению сексуального здоровья женщин и Международным обществом по менопаузе [93]. В настоящее время генитоуринарный менопаузальный синдром определяется как совокупность жалоб и симптомов, связанных со снижением уровня эстрогенов и других половых гормонов, включая изменения больших и малых половых губ, клитора, преддверия влагалища, входа во влагалище, влагалища, уретры и мочевого пузыря. Помимо прочего, данный синдром может включать:
симптомы со стороны половых органов, в том числе сухость, жжение и раздражение;
сексуальные нарушения, например недостаточную секрецию смазки, дискомфорт или боль, функциональные расстройства;
симптомы со стороны мочевыводящих путей, в частности императивные позывы, дизурию и рецидивирующие инфекции мочевыводящих путей (циститы).
Интересный эксперимент провели Y. Yu и соавт. (2009) [94], разделив взрослых крыс-самок на семь групп: группа 1 – здоровый контроль; группа 2 – овариэктомированные самки, которым лечение не проводилось; группа 3 – овариэктомированные самки, получавшие низкие дозы эстрогенов; группа 4 – овариэктомированные самки, получавшие высокие дозы эстрогенов; группа 5 – овариэктомированные самки, получавшие прогестерон; группа 6 – овариэктомированные самки, получавшие комбинированную терапию эстрогенами и прогестероном; группа 7 – овариэктомированные самки, получавшие тестостерон.
Лечение продолжалось в течение четырех недель. У всех самок определялись уровни соответствующих половых гормонов в крови и экспрессия эндотелиального фактора роста в мочевом пузыре, измерялись вес мочевого пузыря и толщина уротелия. По данным исследования, у овариэктомированных крыс группы 2 наблюдались самый тонкий уротелий и наименьшая компактность распределения мышечных элементов и коллагена в тканях детрузора по сравнению с другими группами. Терапия эстрогенами приводила к ликвидации указанных морфологических нарушений, а тестостерон достоверно повышал толщину мышечной стенки мочевого пузыря. Экспрессия эндотелиального фактора роста в уротелии и эндотелии мочевого пузыря после овариэктомии практически отсутствовала. В группах, получавших эстрогены и тестостерон, экспрессия эндотелиального фактора роста оказалась наибольшей по сравнению с другими группами, но все-таки оставалась ниже показателей здорового контроля. Авторы сделали вывод, что половые гормоны играют важную роль в интеграции структур мочевого пузыря, обращая вспять детрузорную мышечную атрофию после овариэктомии, но одни половые гормоны не могут обеспечить полноценное восстановление экспрессии эндотелиального фактора роста в мочевом пузыре [94]. Данный эксперимент наглядно показал тесное синергическое взаимодействие эстрогенов, прогестерона и андрогенов, направленное на обеспечение максимальной адаптивности детрузора, уротелия и сфинктерного аппарата мочевого пузыря.
Роль витамина D в патогенезе хронического рецидивирующего цистита у женщин
В отличие от других витаминов витамин D – не витамин в классическом понимании этого термина, поскольку, будучи исходно биологически неактивным соединением, он только за счет двухступенчатого метаболизма превращается в организме в метаболически активную форму [38, 39]. Согласно сегодняшним представлениям, термин «витамин D» объединяет группу сходных по химическому строению веществ, которые относятся к классу секостероидов: D1, D2, D3 (именно его рассматривают как «истинный» витамин D, тогда как другие представители этой группы считаются модифицированными производными витамина D), D4, D5 [38]. Лучше всего из них изучены холекальциферол (витамин D3) и эргокальциферол (витамин D2).
Витамин D2 можно получить только из пищи растительного происхождения (дрожжей, хлеба, грибов, некоторых овощей). Витамин D3, более важный для человека, синтезируется в коже под действием ультрафиолетовых лучей или поступает из пищевых продуктов в основном животного происхождения (рыбьего жира, сливочного масла, яиц, молока). Витамин D3 биологически инертен и должен пройти дальнейшие этапы трансформации с образованием активных метаболитов, причем этот процесс и биологическое действие витамина D происходят вдали от места непосредственного образования, что свойственно больше для гормонов. От классических витаминов витамин D3 отличает и то, что он не является кофактором ни одного из известных ферментов и может самостоятельно синтезироваться в организме (из холестерина – общего источника для синтеза всех стероидных гормонов). Наконец, к активной форме витамина D3 (1,25(ОН)2D, или кальцитриолу) в клетках различных тканей, а также в митохондриях всех клеток организма человека имеются специфические рецепторы (рецепторы к витамину D), что характерно исключительно для гормонов [38, 39]. Это позволяет рассматривать витамин D именно как гормон D, работающий в рамках так называемой эндокринной системы D-гормона. Ее функции состоят в способности генерировать и модулировать биологические реакции более чем в 40 тканях-мишенях за счет регуляции транскрипции генов в ядре клетки (медленный геномный механизм) или активации внутриклеточных трансмиттеров на поверхности клетки (быстрый негеномный молекулярно-клеточный механизм) [40]. Геномный путь регуляции приводит к изменениям в транскрипции генов-мишеней в течение нескольких часов и дней, негеномный – в течение нескольких секунд и минут соответственно [95]. Важно отметить, что витамин (гормон) D регулирует экспрессию около 3% генов человека (2727 генов), включая гены, отвечающие за синтез половых гормонов и регулирующие обмен глюкозы [96, 97].
Новые представления о витамине D как о мощном стероидном гормоне привели к существенной переоценке его физиологической роли в организме человека в разные периоды его жизни. Оказалось, что достаточный уровень гормона D необходим человеку на протяжении всей жизни: от периода новорожденности до самой глубокой старости, поскольку регулирует крайне важные гены, отвечающие за синтез половых гормонов и углеводный обмен, а потому нарушение их функции закономерно ведет к низкому качеству жизни и ускоренному старению [98]. Это связано с тем, что кроме «классических» эффектов (регуляция фосфорно-кальциевого обмена и костного метаболизма) витамин (гормон) D выполняет в организме целый ряд важных «неклассических» эффектов. К ним относятся торможение клеточной пролиферации и ангиогенеза (антиапоптотический и противоопухолевый эффект), контроль секреции инсулина (гипогликемический эффект), активация синтеза в клетках природных белков-антибиотиков (кателицидинов и дефензинов) (антибактериальный, противовоспалительный и репаративный тканевой эффект), ингибирование продукции ренина, антигипертензивный и целый ряд других [38–40, 99, 100].
В настоящее время выявлены достоверные ассоциации между низким плазменным уровнем 25(ОН)D и высокой частотой бактериального вагиноза у женщин, достигающей 70% [101]. Между тем известно, что бактериальный вагиноз как следствие микроэкологических нарушений вагинального микробиома на фоне нарушения вагинального рН-баланса существенно ухудшает естественные бактерицидные свойства вагинального секрета и повышает частоту инфицирования как влагалища и шейки матки, так и нижних мочевых путей [24]. Низкий плазменный уровень витамина D достоверно ассоциируется с усиленным ростом Clostridium difficile и Mycobacterium tuberculosis, повышая тяжесть клинического течения этих инфекций, что отражает мощный антибактериальный, противовоспалительный и иммуномодулирующий эффект витамина D, который следует изучить более детально применительно к проблеме ХРЦ [102–104].
По данным последних исследований, дефицит витамина D сопровождается снижением емкости мочевого пузыря и усилением его спонтанной активности, таким образом, «имитируя» клинику ХРЦ или гиперактивного мочевого пузыря, а коррекция дефицита витамина D его аналогами успешно и быстро ликвидирует все вышеописанные нарушения [30]. Более того, плазменный уровень витамина D < 15 нг/мл достоверно ассоциируется с рецидивами инфекций нижних мочевых путей у женщин в постменопаузе, что открывает новые возможности терапии этой в целом непростой с клинической точки зрения группы пациенток, особенно в условиях современной антибиотикорезистентности [105].
Заключение
В условиях современного усиливающегося роста уровня антибиотикорезистентности большинства уропатогенов, вызывающих хронические рецидивирующие инфекции нижних мочевыводящих путей (циститы) у женщин, возможности фармакотерапии весьма ограничены и представлены в основном этиотропной антимикробной химиотерапией. Однако клиническая практика показывает, что даже рациональное целенаправленное применение антибиотиков по показаниям не позволяет во многих случаях осуществить эффективную санацию мочевого пузыря и существенно удлинить период стойкой клинико-лабораторной ремиссии ХРЦ.
Роль микроорганизма в патогенезе любого инфекционно-воспалительного процесса несомненна, но сегодня следует больше внимания уделять макроорганизму – второму участнику процесса хронического рецидивирующего инфекционного воспаления.
Мочевой пузырь у женщин – гормонозависимый орган, поэтому нормальный уровень половых стероидных гормонов и витамина D представляется одним из ключевых условий адекватного обеспечения всех его физиологических функций, включая природные бактерицидные свойства.
Современная эндокринно-аутокринно-паракринная теория регуляции функций мочевого пузыря рассматривает ХРЦ как своеобразную инфекционно-бактериальную вершину айсберга гормонального нездоровья мочевого пузыря у женщин. Своевременное и эффективное управление гормональными механизмами ХРЦ у женщин различного возраста может стать в недалекой перспективе одной из эффективных фармакотерапевтических и профилактических опций при данном заболевании.
I.A. Tyuzikov, PhD
Medical Center ‘Tandem-Plus’, Yaroslavl
Contact person: Igor A. Tyuzikov, phoenix-67@list.ru
Based on the results of modern clinical and experimental studies, the review article examines the general and particular issues of hormonal regulation of the bladder and the role of sex steroid hormones (estrogens, progesterone, androgens) and vitamin D, inextricably linked to their endocrinology, in the pathogenesis of chronic recurrent cystitis – the most common outpatient urological pathology in women. The steady increase in antibiotic resistance against the background of a limited number of effective antimicrobial chemotherapy drugs today does not allow to fully managing either the therapy or the prevention of this disease. The low effectiveness of the traditional ‘monoantibacterial’ approach to the treatment of chronic recurrent cystitis in women makes us look for other effective pharmacotherapeutic options of its spread disease. The bladder is a hormone-dependent organ, and the modern endocrine-autocrine-paracrine theory of its regulation allows us to consider chronic recurrent cystitis as a kind of infectious and bacterial ‘tip of the iceberg’ of hormonal bladder disease in women. This article discusses in more detail the reliably studied mechanisms of the participation of estrogens, progesterone, androgens and vitamin D in the pathogenesis of chronic recurrent cystitis in women and presents the results of the correction of their deficiencies in the clinical, laboratory and morphometric parameters of chronic recurrent cystitis. Analysis of the available data showed that the management of the metabolism and natural antimicrobial protection of the bladder through hormonal mechanisms of its regulation in women, obviously, can already be considered today as a promising and effective pharmacotherapeutic option that can significantly improve the therapeutic and prophylactic results in this pathology and the quality of life of patients by compared with traditional ethiotropic antimicrobial monochemotherapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.