Мужской пол как неблагоприятный фенотип аутоиммунного гепатита
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – изучить особенности течения и исходы АИГ у мужчин на основании анализа клинических, иммунологических и гистологических маркеров АИГ с выделением фенотипа АИГ у мужчин.
Материал и методы. В наблюдательном когортном проспективном с элементами ретроспективного исследовании приняли участие 259 пациентов с АИГ, в том числе 53 (20,5%) мужчины. Методы исследования включали клинические данные, результаты стандартных лабораторных, иммунологических (иммуноглобулин G (IgG) и профиль аутоантител) и гистологических методов, а также проверки на гены риска аллелей HLA. Все пациенты получали иммуносупрессивную терапию (ИСТ). Оценивали ответ на ИСТ, динамику фиброза печени, особенности течения клинических исходов у пациентов мужчин с АИГ. На основании анализа полученных результатов определены благоприятные и неблагоприятные факторы течения и исхода АИГ у мужчин.
Результаты. Мужчины с АИГ чаще имели цирроз печени (ЦП) при постановке диагноза, чем женщины – 43,3 и 27,7% соответственно, р = 0,049. Среди пациентов мужчины позже и реже достигали полного биохимического ответа (ПБО) на терапию, чем женщины (р < 0,001). Вероятность достижения ПБО у женщин в 2,5 раза выше в однофакторном анализе – отношение рисков (ОР) 2,48; 95%-ный доверительный интервал (ДИ) 1,74–3,54 (р < 0,001) и в 2,3 раза в многофакторном – ОР 2,26; 95% ДИ 1,58–3,25 (р < 0,001). У мужчин по сравнению с женщинами чаще отмечалось прогрессирование портальной гипертензии при ЦП – 52 и 34% (р = 0,012); прогрессирование фиброза печени до тяжелого (F3-4 по METAVIR) – 52,8 и 6,8% (р = 0,020); развитие перекрестного синдрома – 24,5 и 7,3% (р = 0,041); развитие рецидива после отмены ИСТ – 64,1 и 41,2% (р = 0,050); развитие гепатоцеллюлярной карциномы – 5,7 и 0,5% (р = 0,006).
Заключение. Модификатором тяжести АИГ (более тяжелое течение и неблагоприятные исходы) у пациентов с АИГ является мужской пол. Выделение фенотипа АИГ у мужчин позволит использовать более персонифицированный подход к наблюдению и выбору оптимальной ИСТ для пациентов мужчин с АИГ с целью улучшения исходов заболевания.
Цель исследования – изучить особенности течения и исходы АИГ у мужчин на основании анализа клинических, иммунологических и гистологических маркеров АИГ с выделением фенотипа АИГ у мужчин.
Материал и методы. В наблюдательном когортном проспективном с элементами ретроспективного исследовании приняли участие 259 пациентов с АИГ, в том числе 53 (20,5%) мужчины. Методы исследования включали клинические данные, результаты стандартных лабораторных, иммунологических (иммуноглобулин G (IgG) и профиль аутоантител) и гистологических методов, а также проверки на гены риска аллелей HLA. Все пациенты получали иммуносупрессивную терапию (ИСТ). Оценивали ответ на ИСТ, динамику фиброза печени, особенности течения клинических исходов у пациентов мужчин с АИГ. На основании анализа полученных результатов определены благоприятные и неблагоприятные факторы течения и исхода АИГ у мужчин.
Результаты. Мужчины с АИГ чаще имели цирроз печени (ЦП) при постановке диагноза, чем женщины – 43,3 и 27,7% соответственно, р = 0,049. Среди пациентов мужчины позже и реже достигали полного биохимического ответа (ПБО) на терапию, чем женщины (р < 0,001). Вероятность достижения ПБО у женщин в 2,5 раза выше в однофакторном анализе – отношение рисков (ОР) 2,48; 95%-ный доверительный интервал (ДИ) 1,74–3,54 (р < 0,001) и в 2,3 раза в многофакторном – ОР 2,26; 95% ДИ 1,58–3,25 (р < 0,001). У мужчин по сравнению с женщинами чаще отмечалось прогрессирование портальной гипертензии при ЦП – 52 и 34% (р = 0,012); прогрессирование фиброза печени до тяжелого (F3-4 по METAVIR) – 52,8 и 6,8% (р = 0,020); развитие перекрестного синдрома – 24,5 и 7,3% (р = 0,041); развитие рецидива после отмены ИСТ – 64,1 и 41,2% (р = 0,050); развитие гепатоцеллюлярной карциномы – 5,7 и 0,5% (р = 0,006).
Заключение. Модификатором тяжести АИГ (более тяжелое течение и неблагоприятные исходы) у пациентов с АИГ является мужской пол. Выделение фенотипа АИГ у мужчин позволит использовать более персонифицированный подход к наблюдению и выбору оптимальной ИСТ для пациентов мужчин с АИГ с целью улучшения исходов заболевания.




Введение
Аутоиммунный гепатит (АИГ) – иммуноопосредованное многофакторное заболевание печени с хроническим гепатоцеллюлярным повреждением, развивающееся у лиц преимущественно женского пола с генетической предрасположенностью и аберрантным иммунным ответом под влиянием факторов окружающей среды, с широким спектром клинической картины, профилем аутоантител (АТ), гистологических признаков и прогрессирующее в отсутствии лечения [1–3].
Отсутствие высокоспецифичных диагностических признаков, их вариабельность в гендерных и различных возрастных группах, наличие особых форм и субтипов АИГ могут создавать сложности для своевременной диагностики и выбора более оптимизированных схем терапии, что обусловливает необходимость тщательного анализа различных фенотипов заболевания. Понятие фенотипа имеет основополагающее значение для анализа биологических систем и болезней человека, поэтому описание и сравнение фенотипов пациентов и заболеваний имеет давнюю традицию, выходящую за рамки возникновения академических дисциплин [4].
Фенотип заболевания характеризует наблюдаемые проявления конкретной нозологии, охватывая один признак или комбинацию признаков заболевания, которые определяют различия между людьми с конкретным заболеванием. Эти признаки должны быть связаны с клинически значимыми результатами, такими как симптомы течения болезни, обострения, реакция на терапию, скорость прогрессирования заболевания или смертность [5].
Известно, что женский пол является фактором риска аутоиммунных нарушений для всех аутоиммунных заболеваний (АИЗ) [6] и явным фактором риска развития АИГ: во всех популяциях 3/4 пациентов с АИГ составляют женщины [7].
Гены, связанные с функциями иммунной системы, кодируются на половых хромосомах X и Y [8], и половой диморфизм очевиден у пациентов с АИГ: пациенты мужского пола чаще характеризуются повышенной экспрессией HLA-DR3, тогда как экспрессия HLA-DR4 чаще повышена у женщин с АИГ [9].
Женское гендерно-зависимое преобладание в аутоиммунитете зависит не только от Х-хромосомы, но и от широкого спектра влияния половых гормонов на иммунную систему и органы-мишени [8].
Наличие женского пола используется в качестве значимого предиктора АИГ в пересмотренных диагностических балльных критериях [10].
Имеются данные немногочисленных исследований, в которых рассматривали пол пациента с АИГ как вероятный прогностический фактор. Доказательства основывались на ретроспективных когортных небольших исследованиях с противоречивыми результатами относительно пола [11, 12],
на основании которых были сделаны заключения, что не существует определенного соответствующего прогностического фактора, связанного с полом.
Мужской пол сам по себе может выступать как модификатор тяжести заболевания при различных аутоиммунных состояниях: гендерные различия определяют иммунные механизмы печени, развитие АИЗ печени и отражаются на эпидемиологии и клинических фенотипах заболеваний [13].
Большой опыт в распознавании фенотипа АИГ в целом, а также в различных клинических ситуациях помогает определять типичные характеристики АИГ в конкретных группах пациентов, выделять предикторы неблагоприятных исходов и прогнозировать их для создания оптимизированного и персонифицированного подхода в выборе схем иммуносупрессивной терапии (ИСТ) с целью улучшения прогноза заболевания.
Цель исследования – изучить особенности течения и исходы АИГ у мужчин на основании анализа клинических, иммунологических и гистологических маркеров АИГ с выделением фенотипа АИГ у мужчин.
Материал и методы
В наблюдательном когортном проспективном исследовании с элементами ретроспективного анализа данных приняли участие 259 пациентов с верифицированным диагнозом АИГ. Ретроспективно был включен в исследование 61 пациент, в том числе когорта пациентов с дебютом заболевания в детском возрасте (n = 35), диагноз АИГ и начало терапии были зафиксированы в медицинской документации, которая имела все необходимые данные, подтверждающие диагноз АИГ, а также клинико-лабораторные показатели в динамике, позволяющие оценить первоначальный ответ на ИСТ и дальнейшее течение заболевания.
Критерии включения в исследование: пациенты женского и мужского пола в возрасте ≥ 18 лет; установленный диагноз АИГ (согласно упрощенной и пересмотренной диагностической балльной системе оценки АИГ, утвержденной международной рабочей группой по изучению АИГ); наличие письменного информированного согласия на участие в исследовании.
Критерии невключения в исследование: пациенты без достаточного объема данных обязательных исследований для постановки диагноза; перекрестный синдром АИГ и первичный билиарный холангит (ПБХ) или АИГ и первичный склерозирующий холангит (ПСХ) на этапе постановки диагноза; активный вирусный гепатит; декомпенсированный цирроз печени (класс С по Чайлд – Пью) в исходе возможного АИГ; наличие клинически значимого тяжелого заболевания, затрудняющего участие пациента в исследовании; клинически значимое употребление алкоголя (более 20 и 30 г этанола в сутки для женщин и мужчин соответственно).
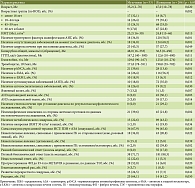
В таблице 1 представлена общая характеристика всех пациентов с АИГ. Женщины в исследовании составили преимущественное большинство: 206 из 259 участников (79,5%), доля мужчин с АИГ составила 20,5%. Общая медиана (Ме) возраста дебюта заболевания – 46 (2–78) лет отражает средний возраст пациентов по классификации Всемирной организации здравоохранения (ВОЗ). Ме общего времени наблюдения за пациентами от начала терапии составила 4,6 года, минимально – 3 года, максимально – 22 года.
Методы исследования включали данные объективного осмотра пациентов, анализ анамнеза заболевания, стандартные лабораторные показатели (клинический анализ крови, биохимический: аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза (ЩФ), гамма-глутамилтранспептидаза (ГГТП), общей билирубин и его фракции, общий белок и его фракции, коагулограмма; иммунологический: IgG и профиль АТ), гистологические признаки по результатам первичной и повторной биопсии печени с оценкой стадии фиброза печени (ФП) по METAVIR и индекса гистологической активности (ИГА) по Knodell, генетическое исследование (определение генов риска АИГ на основании секвенирования аллелей HLA).
Диагноз АИГ устанавливали на основании анализа исходных показателей (клинических, лабораторных, иммунологических и гистологических) с помощью упрощенных диагностических критериев балльной системы оценки от 2008 г. [14], расширенных пересмотренных критериев от 1999 г., рекомендуемых Международной рабочей группой по АИГ (IAIHG) [10], с учетом обновленных данных по методам определения АТ и их титра [15], а также гистологических критериев 2022 г. [16].
Всем пациентам выполняли ультразвуковое исследование органов брюшной полости, исходно
и в динамике на фоне ИСТ транзиентную эластографию (ТЭГ) печени для определения эластичности ткани печени и соответствующей ей стадии ФП (F), при необходимости – ЭГДС и колоноскопию. Все пациенты получали ИСТ по схемам, утвержденным экспертами клинических рекомендаций по диагностике АИГ [1–3, 17]. Всем пациентам проводили оценку эффективности ИСТ на основании исследования динамики лабораторных и иммунологических маркеров, развития нежелательных явлений с коррекцией при необходимости. Согласно рекомендациям специалистов по изучению АИГ, первую оценку ответа на терапию проводили через четыре недели от начала терапии и в случае снижения трансаминаз менее чем на 50% классифицировали как отсутствие ответа на ИСТ. Основную точку ответа на терапию оценивали через шесть месяцев как полный биохимический ответ (ПБО) или недостаточный ответ [17, 18]. Дальнейшие точки динамики ответа на ИСТ рассматривали через 12 и 24 месяца от начала терапии. Особенности течения заболевания анализировали на фоне ИСТ: проводили оценку динамики ФП, гистологической активности, определяли наличие ремиссии заболевания, а также наличие рецидива после отмены ИСТ.
Неблагоприятным течением заболевания считали следующие варианты: несвоевременное достижение ПБО через шесть месяцев от начала ИСТ или если пациенты достигли, но не удерживали ПБО в течение двух лет ИСТ; развитие рецидива после отмены терапии; развитие перекрестного синдрома (ПС); прогрессирование ФП на фоне ИСТ; декомпенсация заболевания (кровотечение из варикозно-расширенных вен, асцит и др. критерии декомпенсированного цирроза печени (ЦП)) [17, 18]. Неблагоприятные исходы оценивали в случае смерти, трансплантации печени, развитии гепатоцеллюлярной карциномы (ГЦК) [18].
Статистический анализ проводили с использованием статистического пакета R 4.4 (США). Для описания данных были использованы методы описательной статистики: данные представлены посредством медианы (Me) с диапазоном по минимальным и максимальным значениям или интерквартильными значениями. Для оценки различий между двумя независимыми выборками использовали U-критерий Манна – Уитни, для оценки общей выживаемости – метод Каплана – Мейера, для сравнения кривых – логранговый тест. Анализ прогностических факторов неблагоприятных клинических исходов в бессобытийном анализе проводили с использованием модели регрессии Кокса, в которой для каждой независимой переменной была выбрана опорная группа в качестве группы сравнения для вычисления относительных рисков (ОР) с 95%-ными доверительными интервалами (95% ДИ). Для определения наиболее значимых параметров, имеющих значение для формирования фенотипа, проводили статистический анализ данных в программе IBM SPSS Statistics v.27.0 (США) и MedCalc Software Ltd v.23.2.1 (Бельгия), использовали дисперсионный анализ с расчетом двустороннего точного критерия Фишера (ДТКФ). Наибольший вклад вносят признаки с большим значением ДТКФ, показывающем величину дисперсии и силу влияния признаков при определяемом фенотипе АИГ. Порог статистической значимости p-value во всех тестах был принят 0,05.
Результаты
В результате анализа пациентов по полу определили, что мужчины с АИГ составили 20,5% (53 из 259 человек) от всех пациентов, соотношение женщин и мужчин – 3,9 : 1. Были изучены исходные характеристики, а также их динамика на фоне терапии и последующего наблюдения в двух группах пациентов с АИГ: у мужчин и у женщин. В таблице 2 представлены только статистически значимые показатели. Медиана (Ме) возраста дебюта заболевания у мужчин составила 35,2 года с диапазоном 2–70 лет, у женщин – 47,0 лет с диапазоном 10–78 лет (р = 0,020). Длительность наблюдения в исследовании мужчин и женщин от момента постановки диагноза значимо не отличались: у мужчин Me составила 69,6 месяца с диапазоном 35–266 месяцев, у женщин – 53,2 месяца с диапазоном 37–247 месяцев (р = 0,26). ЦП на момент постановки диагноза у мужчин определяли в 43,3% случаев, у женщин – в 27,7%, р = 0,048.
Дополнительно проведен дисперсионный анализ статистически значимых признаков с расчетом ДТКФ. Данные представлены в табл. 3.
На основании проведенного анализа мы определили наиболее характерные признаки АИГ, по которым пациенты мужчины отличались от пациенток женщин с АИГ, и выделили фенотип АИГ у мужчин.
Пациенты мужчины на момент дебюта заболевания имели более молодой возраст (Ме = 35 лет) в сравнении с женщинами (Ме = 47 лет). Дебют у мужчин чаще наблюдался в детском возрасте: 32,1% в сравнении с 8,7% у женщин, реже в пожилом – 17,0 и 22,8% соответственно, при этом у мужчин и женщин АИГ одинаково часто встречался в молодом и среднем возрасте. По исходным лабораторным показателям пациенты мужчины не отличались от пациенток, за исключением показателей общего билирубина, ГГТП и гемоглобина, медианы которых были выше, а также тромбоцитов, медианы которых ниже, что, вероятно, связано с более частой встречаемостью ЦП у мужчин на момент установления диагноза – 43,3 и 27,7% соответственно. Сопутствующие заболевания на момент постановки диагноза встречались у мужчин в 34% случаев, у женщин – почти в два раза чаще; мужчины реже имели избыточный вес и ожирение, чем женщины, – 1,8 и 21,4% соответственно; у мужчин не было выявлено ни одного случая неалкогольной жировой болезни печени (НАЖБП). Пациенты мужского пола отличались по спектру внепеченочных иммуноопосредованных заболеваний: реже имели АИЗ – 18,8% в сравнении с 35,7% у женского пола; не имели аутоиммунного тиреоидита и ревматологических заболеваний. При этом у мужчин значимо чаще выявляли язвенный колит (13,2% в сравнении с 1,5% у женщин) и некоторые другие аутовоспалительные заболевания (псориаз, витилиго) – 26,4% в сравнении с 9,2% у женщин. Пациенты мужского пола имели значимые различия по спектру и частоте выявляемых АТ: у них гораздо реже выявляли АТ к SMA (26,9 и 56,6%), значимо чаще – АТ к LKM1 (18,9 и 6,3%) и pANCA (39,6 и 13,6%).
В гистологической картине у мужчин отмечались несколько чаще неспецифические признаки поражения желчных протоков (недеструктивные изменения желчных протоков): 39,6% в сравнении с 21,8% у женщин при отсутствии на тот момент признаков ПС. У 13 (24,5%) пациентов мужского пола в процессе наблюдения диагностирован ПС (АИГ с признаками ПСХ) в сравнении с 7,3% случаев у пациентов женского пола, у которых наблюдался ПС (АИГ с признаками ПБХ). Ме времени от установления диагноза АИГ до появления признаков ПС составила 49,5 месяца с диапазоном 22–130 месяцев. Таким образом, прогрессирование заболевания и неблагоприятное течение у мужчин с АИГ отмечались чаще, чем у женщин.
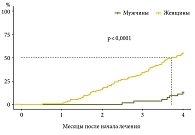
Анализ ответа на ИСТ показал, что мужчины и женщины имели отличительные особенности ДТКФ = 30,808 (р < 0,0001): наблюдались значимые различия по частоте и времени достижения раннего и ПБО (рис. 1 и 2). Женщины чаще и быстрее достигали как раннего, так и своевременного ПБО; ПБО не был достигнут в 28,3% случаев у мужчин и в 11,7% у женщин.
У пациентов мужского пола чаще отмечался недостаточный ответ на ИСТ (22,6% в сравнении с 5,3% у женщин), что требовало повышения доз преднизолона (ПЗН) или азатиоприна (АЗА).
Результаты однофакторного и многофакторного анализов продемонстрировали, что женский пол увеличивает вероятность достигнуть ПБО на терапию в 2,5 раза и в 2,3 раза чаще по сравнению с мужчинами: ОР – 2,48; 95% ДИ 1,74–3,54 (р < 0,001) и ОР 2,26; 95% ДИ 1,58–3,25 (р < 0,001) соответственно.
Анализ назначаемых схем ИСТ не показал значимых различий, за исключением того, что пациентам мужчинам чаще назначались комбинированные схемы: ПЗН и АЗА (66,6% в сравнении с 50,0% у женщин), реже применялись низкие дозы ПЗН (3,5 и 36,9% соответственно). На фоне ИСТ у мужчин чаще, чем у женщин, отмечались нежелательные явления, связанные с АЗА: цитопения (15,1 и 5,8%), признаки холестаза (41,5 и 26,3%).
Было выявлено, что у пациентов мужчин на фоне ИСТ чаще отмечалось прогрессирование признаков портальной гипертензии (52 и 34% соответственно), в том числе спленомегалии (56,6 и 35,4%), а также прогрессирование ФП в динамике до стадии 3–4 по METAVIR, по данным ТЭГ.
Рецидив после отмены ИСТ наблюдался у мужчин в 64,1% случаев и в 41,2% случаев у женщин при пограничном значении р = 0,050.
Анализ таких неблагоприятных исходов, как смерть, ГЦК или трансплантация печени, показал следующее: смертельный исход отмечен
у 3/53 (5,7%) мужчин и у 7/206 (3,4%) женщин, р = 0,128; ГЦК у 3 (5,7%) мужчин и у 1 (0,5%) женщины, р = 0,006; из всех семи случаев трансплантации печени: 1 (1,9%) случай у мужчин и 6 (2,9%) случаев у женщин, р = 0,24.
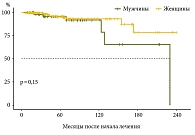
При проведении анализа прогностических факторов бессобытийной выживаемости, в том числе по полу пациента, не наблюдалось статистической разницы на этапе наблюдения за пациентами. Однако, как демонстрирует кривая выживаемости (рис. 3), значимая разница начинает отмечаться после 120 месяцев наблюдения, в то время как общая медиана наблюдения в нашем исследовании составила 55,4 месяца.
На основании полученных результатов был дополнительно проведен разведывательный анализ фенотипов, которые могут иметь статистически значимую связь с неблагоприятным течением и неблагоприятным исходом. Если выполнялось одно из следующих условий, исход считался неблагоприятным: смерть, рак печени, трансплантация печени, декомпенсация цирроза печени. Если выполнялось одно из условий клинического прогрессирования заболевания: несвоевременное достижение ПБО, прогрессирование ФП по данным ТЭГ, рецидив, то течение АИГ считалось неблагоприятным.
Обсуждение
В нашем исследовании пациенты мужчины с АИГ составили 20,5% от всех пациентов, соотношение 3,9 : 1. В когортном исследовании A.M. Baragiotta и соавт. (2001) АИГ у мужчин выявлен в 16% случаев, из них 53% пациентов имели ЦП на момент постановки диагноза [19].
В исследовании S. Malakar и соавт. (2024) показано, что ЦП выявлен в 20% случаев у мужчин и в 30% случаев у женщин (p = 0,25) [20]. В том же исследовании определено, что АИЗ реже встречались у мужчин в сравнении с женщинами – 16 и 35,5% соответственно (p = 0,02).
В нашем исследовании ЦП на момент постановки диагноза определяли в 43,3% случаев у мужчин и в 27,7% случаев у женщин (р = 0,049). У мужчин с АИГ в два раза реже выявляли АИЗ, чем у женщин (р = 0,033).
В настоящее время не сформировано однозначного мнения, насколько различия, связанные с полом, у пациентов с АИГ могут влиять на ответ, течение и исходы заболевания [18]. В некоторых исследованиях указано, что мужской пол у пациентов с АИГ может определять худшие результаты течения и более высокие показатели осложнений заболевания [21, 22]. В датском когортном исследовании был показан высокий уровень смертности у мужчин [23].
Эти различия могут быть связаны с сопутствующими заболеваниями в зависимости от пола и обусловлены различиями в иммуногенетике, гипоталамо-гипофизарной системе и половыми гормонами, которые могут влиять на активность и прогрессирование заболевания, а также различиями в соблюдении рекомендаций по лечению [13, 24].
Предполагается, что гендерные эффекты могут действовать на уровне гаплотипов человеческого лейкоцитарного антигена (HLA) при определении или изменении восприимчивости к АИГ и другим АИЗ, влиять на восприимчивость и клинические проявления, но не на исход заболевания [11].
При сравнении выявляемых гаплотипов в генах рисках аллелей HLA в нашем исследовании у мужчин и женщин выявлены следующие различия: гаплотип DR1*04 выявлен в 25% случаев у мужчин в сравнении с 39,1% у женщин (р = 0,17), DR1*03 – в 41,3% в сравнении с 29,2% (р = 0,12), A*01 – в 58,1% в сравнении с 20,1% (р = 0,037) соответственно. Ряд исследователей указывают на то, что пациенты мужского пола характеризуются повышенной экспрессией HLA-DR3 (DRB1*0301), тогда как HLA-DR4 (DRB1*0401) повышен у пациентов женского пола [25, 11].
Также в работе T. Al-Chalabi и соавт. показано, что гаплотипы HLA A*01 и DR1*03 чаще встречались у мужчин, чем у женщин: 63 и 45% (p = 0,049) и 50 и 23% (p = 0,003), при этом не было выявлено существенных различий в начальных клинических проявлениях, однако у мужчин наблюдался более высокий уровень рецидивов – 71% в сравнении с 55% у женщин (p = 0,059) [25].
В работе индийских исследователей было отмечено, что мужчины с АИГ не отличались от женщин по достижению ПБО, однако значимо отличались по частоте рецидивов [20].
В исследовании T. Al-Chalabi и соавт. показано, что несмотря на более высокую частоту рецидивов у мужчин, у женщин значительно чаще наблюдалась смертность или необходимость в трансплантации печени (p = 0,024) [25].
В нашем исследовании мужчины значимо хуже достигали ПБО и чаще имели недостаточный ответ, рецидивы отмечались несколько чаще у мужчин, но при пограничном р = 0,050.
Согласно проведенному отчету Международной группы экспертов по АИГ на основании крупного ретроспективного регистра, отсутствие ПБО при АИГ приводит к неблагоприятному исходу, так же как и ЦП (ОР 3,5; 95% ДИ 2,3–5,5), ПС (АИГ и ПСХ) и отсутствие биохимического ответа на терапию в течение шести месяцев (ОР 5,7; 95% ДИ 3,4–9,6) были независимыми прогностическими факторами неблагоприятных исходов через 10 лет наблюдения [26].
Кроме того, отмечается, что частота рецидивов выше у пациентов, принимавших только ПЗН, чем у пациентов, принимавших ПЗН и АЗА [27]. В когорте пациентов мужчин чаще отмечалась комбинированная терапия и гораздо реже – монотерапия ПЗН, что могло в том числе повлиять на пограничное значение р = 0,050 при анализе частоты рецидивов между мужчинами и женщинами.
Еще в одном крупном популяционном когортном исследовании было показано, что такие факторы, как ЦП, прогрессирование портальной гипертензии, развитие ПС, связаны с более высоким риском неблагоприятных исходов у пациентов с АИГ [28].
Заключение
Анализ полученных нами результатов позволяет сделать вывод, что мужской пол в когорте пациентов с АИГ по сравнению с женским полом определял худшие результаты ответа на ИСТ, течения заболевания (развитие ПС, рецидивы после отмены ИСТ, прогрессирование ФП до тяжелой стадии и ЦП), а также некоторых показателей неблагоприятного исхода (смерть и ГЦК). Анализ клинико-лабораторных, иммунологических и гистологических показателей, характера ответа на ИСТ, течения АИГ и исходов заболевания подтверждают гипотезу ряда исследователей о том, что мужской пол является модификатором более тяжелого течения АИГ и фенотип АИГ у мужчин ассоциирован с более тяжелым течением заболевания и некоторыми неблагоприятными исходами в сравнении с этими параметрами у пациентов с АИГ женского пола. Выделение фенотипа АИГ у мужчин позволит использовать более персонифицированный подход к наблюдению и выбору оптимизированных схем ИСТ для пациентов мужчин с АИГ с целью улучшения исходов заболевания.
Авторы заявляют об отсутствии конфликта интересов.
Yu.G. Sandler, PhD, E.V. Vinnitskaya, PhD, E.N. Alexandrova, PhD, S.G. Khomeriki, PhD, Prof., K.G. Saliev, PhD, A.S. Dorofeev, T.Yu. Khaimenova, PhD, E.M. Desyatskova
A.S. Loginov Moscow Clinical Scientific Center
Moscow Regional Clinical Anti-Tuberculosis Dispensary
Contact person: Yulia G. Sandler, sandlerjulia2012@gmail.com
The multifactorial immunopathogenesis of autoimmune hepatitis (AIH) with a wide spectrum of clinical presentation in gender and different age groups predetermines the heterogeneity of subtypes and special forms of AIH, which creates difficulties for timely diagnosis, reduces the chances of successful therapy and motivates an in-depth study of the clinical phenotypes of the disease. AIH occurs predominantly in women and there are not many studies on the AIH in men.
The aim of the study is to investigate the course and outcomes of AIH in men based on the analysis of clinical, immunological and histological markers of AIH with the identification of the phenotype AIH in men. Material and methods. The observational cohort prospective study with elements of retrospective involved 259 patients with AIH, 53 of which (20.5%) were men.
The study methods included clinical data, the results of standard laboratory, immunological (immunoglobulin (Ig) G and autoantibody profile) and histological diagnostics, as well as testing for risk genes of HLA alleles.
All patients received immunosuppressive therapy (IST). The response to IST, the dynamics of liver fibrosis, and the course of clinical outcomes in male patients with AIH were assessed. Based on the analysis of the obtained results, favorable and unfavorable factors of the course and outcome of AIH in men were determined.
Results. Male patients with AIH more often had liver cirrhosis (LC) at diagnosis than women – 43.3 and 27.7%, respectively, p = 0.049. Among patients, men later and less often achieved a complete biochemical response (CBR) to therapy than women (p < 0.001). The probability of achieving CBR in women is 2.5 times higher in a univariate analysis – odds ratio (OR) 2.48; 95% confidence interval (CI) 1.74–3.54 (p < 0.001) – and 2.3 times in multivariate – OR 2.26; 95% CI 1.58–3.25 (p < 0.001).
In men compared to women, progression of portal hypertension in cirrhosis was more often observed – 52 and 34% (p = 0.012); progression of liver fibrosis towards a severe stage (F3/4) – 52.8 and 6.8% (p = 0.020); development of overlap syndrome – 24.5 and 7.3% (p = 0.041); development of relapse after IST discontinuation – 64.1 and 41.2% (p = 0.050); development of hepatocellular carcinoma – 5.7 and 0.5% (p = 0.006).
Conclusion. The modifier of the severity of AIH (more severe course and unfavorable outcomes) in patients with AIH is male gender. Identification of the AIH phenotype in men will allow using a more personalized approach to monitoring and choosing the optimal IST for male patients with AIH in order to improve disease outcomes.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.