COVID-19: генез, клиническая картина, лечение, прогноз
- Аннотация
- Статья
- Ссылки
- English

Введение
Коронавирусная инфекция, которая воспринимается как новая, официально зарегистрированная в 2019 г. (COVID-19), вызывается SARS-CoV-2 и характеризуется тяжелым острым респираторным синдромом. Инфекция быстро распространилась по всему миру и в начале 2020 г. приобрела характер пандемии.
Первоначальное определение заболевания «тяжелый острый респираторный синдром» становится условным и традиционным. С течением времени появляется все больше данных о системности заболевания с возможностью поражения всех органов и тканей, вариабельностью клинической картины и риском отдаленных неблагоприятных исходов.
COVID-19 отражается на ментальном статусе пациентов [1, 2]. Первая эпидемия, по клинической картине сходная с COVTD-19 и зарегистрированная в 1960-х гг., проникла в Россию из Средней Азии, распространившись в Европу, где получила название русского гриппа. Наиболее подверженными инфицированию оказались пожилые люди и лица с хроническими заболеваниями. Таков очень краткий экскурс в историю [3].
Согласно палеогенетическим исследованиям, механизмы адаптации в геноме хозяина служат информативным адресом древних вирусных эпидемий. Палеовирусологи утверждают, что история коронавирусов началась более 20 000 лет назад в восточной части Азии. Обнаружение следа древней эпидемии коронавируса в этом регионе в проекте 1000 геномов (более 2500 человек из 26 популяций мира) служит хорошим примером исследований, раскрывающих предысторию древней эпидемии коронавируса в Восточной Азии [4]. И это очень осторожная датировка. Неандертальцы, жившие на территории Европы и в некоторых частях Азии около 400 000–40 000 лет назад, были генетически близки к Homo sapiens. Есть свидетельства того, что неандертальцы скрещивались с сапиенсами, что оставило след в геноме современного человека. Очищающий отбор в популяции сапиенсов поддержал ряд неандертальских генов, связанных с иммунной системой [5]. Заражение новыми вирусами и адаптивную способность к устойчивости к ним можно объяснить скрещиванием неандертальцев и Homo sapiens [6]. Вирусные инфекции и селекция древних аллелей, происходящая в результате этого, вызвали эволюцию в геноме человека из-за перекрестного воздействия с неандертальцами около 60 000–40 000 лет назад, и эти гаплотипы вошли в геном человека посредством потока генов [7]. На хромосоме 3 выявлена область, связанная с тяжелым течением COVID-19, а также с генами неандертальцев. Кроме того, обнаружен другой гаплотип на хромосоме 12, связанный с более мягким вариантом течения COVID-19 (на 22% меньший риск), который также унаследован от неандертальцев. В результате неандертальский гаплотип может быть потенциальным фактором риска развития тяжелой формы COVID-19 [8–10]. Прав был Екклесиаст (Ветхий Завет): «Что было, то и будет; и что делалось, то и будет делаться, и нет ничего нового под солнцем. Бывает нечто, о чем говорят: смотри, вот это новое; но это было уже в веках, бывших прежде нас».
Эпидемиология
Коронавирус считается сравнительно высокоинфекционным [11], хотя контагиозность SARS-CoV-2 существенно ниже по сравнению с рядом детских респираторных инфекций (рис. 1) [12]. Как видно из рис. 1, контагиозность COVID-19 близка к контагиозности вируса гриппа. В этом случае жесткие карантинные меры, которые были предприняты во время пандемии, могут быть оправданы только вероятными тяжелыми непосредственными и отдаленными исходами, требующими дальнейшего изучения. Вирус после завершения пандемии из общества не ушел. В настоящее время в структуре острых респираторных инфекций (простудных заболеваний) детского возраста на него приходится не менее 10–15% [13]. Основным путем передачи является респираторный. Но, исходя из патогенеза COVID-19, входными воротами инфекции наряду с респираторным трактом считают орган зрения. Впервые о том, что глаз и периокулярные ткани могут быть входными воротами инфекции, сообщили во время эпидемии гриппа («испанки») более 100 лет тому назад. Позднее это подтвердилось на примере аденовирусов и многих других вирусов, в том числе коронавируса [14, 15].
Глаз подвержен аэрозольному воздействию больше, чем нос или полость рта за одинаковый промежуток времени. В частности, у взрослого европеоида общая площадь двух глаз между веками составляет 600 мм2. Если принять за единицу длительность разговора двух лиц, когда создаются содержащие вирусы аэрозольные микрочастицы, глаз оказывается прикрыт в момент мигания на период времени, равный всего 0,03 длительности разговора. Средняя площадь рта при разговоре составляет 500 мм+, длительность пребывания рта в закрытом состоянии или во время выдоха – 0,7 от того же условного промежутка времени. Общая площадь ноздрей составляет 200 мм2, длительность выдоха (закрытые для аэрозоля ноздри) – 0,5 от той же длительности разговора. Таким образом, открытая площадь глаза, подвергающаяся аэрозольному загрязнению, и период, в течение которого глаз открыт для контакта с аэрозолем, значительно больше, чем площадь и длительность контакта аэрозоля с носом и ртом. Но говорим мы не постоянно, акт дыхания включает в себя и выдох, так что инфицирование через глаз оказывается едва ли не основным. К этому надо добавить и путь инфицирования «рука – глаз». Со склеры и конъюнктивы за счет постоянного самоочищения слеза смывает аэрозоль и с ним стекает в слезно-носовой канал. Канал открывается под нижней носовой раковиной, откуда слеза вместе с растворенными в ней частицами через носо- и ротоглотку быстро попадает в бронхи и желудочно-кишечный тракт. В эксперименте на добровольцах в слезный мешочек вводили Bacillus prodigiosus (Serratia marcescens). Микроорганизмы обнаруживались в носу (через пять минут), в глотке (через 15 минут) и в каловых массах (через сутки) [16, 17].
SARS-CoV-2 может оставаться жизнеспособным на различных поверхностях в течение нескольких часов или дней, хотя передача через респираторные капли и аэрозольные частицы происходит гораздо чаще, чем через фомиты. Выделение вируса с фекалиями наблюдается в течение нескольких недель после постановки диагноза. Это позволяет говорить о фекально-оральной передаче вируса. Крайне сомнительна вертикальная внутриутробная передача вируса от матери плоду. Вероятно, инфицирование происходит при прохождении через родовые пути. У матерей с положительным результатом теста на COVID-19 более высокий риск прерывания беременности с помощью операции кесарева сечения. На сегодняшний день SARS-CoV-2 не обнаружен в грудном молоке [18].
Важную роль в передаче инфекции играет семейная кластеризация. Дети старшего возраста и подростки с большей вероятностью передают SARS-CoV-2 членам семьи, чем дети младшего возраста [19].
По статистике США, частота госпитализаций среди взрослых в 2020 г. составила 164,5:100 000, частота госпитализации детей младше 18 лет – 8,0:100 000 популяции. Максимальная частота регистрировалась среди детей младше двух лет – 24,8:100 000. Частота госпитализаций среди детей от двух до 17 лет составила 4,2:100 000. Среди выходцев из Латинской Америки этот показатель составил 16,4:100 000, среди афроамериканцев – 10,5:100 000, среди белых жителей – 2,1:100 000. Самыми частыми сопутствующими состояниями у детей и подростков были ожирение (37,8%), хронические болезни легких (18,0%), недоношенность (гестационный возраст менее 37 недель при рождении определяли только в группе детей младше двух лет (15,4%)). Частота сопутствующих состояний у латиноамериканцев (45,7%) и афроамериканцев (29,8%) выше, чем у белых детей (14,9%). Таким образом, среди факторов заболеваемости и вариантов течения заболевания имели место не только биологические, но и социальные.
Истинная заболеваемость COVID-19 у детей неизвестна из-за отсутствия повсеместного тестирования. Частота госпитализации по поводу COVID-19 в детской популяции значительно ниже, чем во взрослой. Это говорит о том, что у детей может быть менее тяжелая форма заболевания COVID-19 по сравнению со взрослыми.
Патофизиология
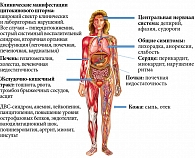
Прикрепление вируса происходит за счет рецепторов ангиотензинпревращающего фермента 2 (ACE2). Плотность рецепторов ACE2 у детей значительно меньше, чем у взрослых. Вполне вероятно, что это объясняет и меньшую подверженность детей COVID-19, и редкость артериальной гипертензии в этом возрасте. Вирус через рецепторы ACE2 взаимодействует с трансмембранной протеазой (серин 2; TMPRSS2). Возникают эндотелит, васкулит, гиперкоагуляция, запускаются аутоиммунные реакции. Проникновение вируса в клетку блокируется ингибиторами протеазы (рис. 2).
Геном коронавируса (CoV) кодирует четыре основных структурных белка: белки шипа (S), мембраны (M), оболочки (E) и нуклеокапсида (N). Каждый из них необходим для образования структурно завершенной вирусной частицы. Некоторым CoV не требуется полный спектр белков для формирования полноценного вириона, то есть некоторые структурные белки могут быть необязательными или кодировать дополнительные белки с перекрывающимися компенсаторными функциями.
Белок S опосредует прикрепление CoV к поверхностным рецепторам клетки хозяина и слияние мембран вируса и клетки хозяина, чтобы облегчить проникновение вируса в клетку хозяина. Экспрессия S на мембране способствует слиянию инфицированных и неинфицированных клеток. Образование гигантских многоядерных клеток (синцитий) обеспечивает прямое распространение вируса между клетками, не вступая в контакт с вируснейтрализующими антителами. Белок М – наиболее распространенный структурный белок – определяет форму вирусной оболочки, центральный организатор сборки CoV. Взаимодействие S и M необходимо для удержания S в промежуточном компартменте комплекса Гольджи и его включения в новые вирионы, но необязательно для процесса сборки. Связывание М с N стабилизирует нуклеокапсид и внутреннее ядро вирионов, способствует завершению сборки вируса. М и Е составляют вирусную оболочку, их взаимодействия достаточно для производства и высвобождения вирусоподобных частиц. Гемагглютинин распознает клетки-мишени, присоединяясь к рецепторам этих клеток (очень охотно – к эритроцитам!), содержащих сиаловую кислоту. После захвата вируса в эндосому клетки обеспечивает проникновение в клетку хозяина вирусного генома, обеспечивая слияние мембраны эндосомы с капсидом CoV.
N-протеин связывается с геномом РНК CoV, образуя нуклеокапсид, участвует в других аспектах цикла репликации CoV и реакции клеток хозяина на вирусную инфекцию. Локализация N в области эндоплазматического ретикулума Гольджи предполагает его участие в сборке и почковании CoV. Временная экспрессия N существенно увеличивает выработку вирусоподобных частиц у некоторых CoV, что позволяет предположить, что она может быть необходима не для формирования оболочки, а для полного формирования вириона.
Белок Е обеспечивает производство и созревание вируса. Сложность строения ангинного состава вируса объясняет полиморфизм заболевания.
Тяжелый острый респираторный синдром, обусловленный SARS-CoV-2, характеризуется начальным цитокиновым штормом, который может привести к острому респираторному дистресс-синдрому и синдрому активации макрофагов (рис. 3). За начальной фазой следует период иммунной дисрегуляции, который становится основной причиной смертельных исходов, связанных с сепсисом [19, 20].
Основа патофизиологии (патогенеза) COVID-19 – иммунопатология, включающая лимфопению, нейтропению, анемию, дисрегуляцию моноцитов и макрофагов, замедленный или усиленный ответ интерферона I, антитело-зависимое усиление (ADE) и особенно цитокиновый шторм. Пациент с COVID-19 характеризуется атипичным иммунным профилем – крайне высокой воспалительной реакцией врожденного иммунитета и крайне низкой защитной реакцией приобретенного иммунитета. B-клетки синтезируют нейтрализующие антитела к рецепторам ACE2, защищая клетки от проникновения коронавируса. Но продуцируемые В-клетками нейтрализующие антитела не всегда являются защитными. Это определяется элементом вируса, на который они нацелены, и Fc-регионом антитела. ADE представляет собой явление, при котором ранее существовавшие нейтрализующие антитела, нацеленные на один серотип данного вируса, усиливают проникновение не только этого вируса, но и другого серотипа вируса в лейкоциты посредством взаимодействия между Fc-регионом антитела и Fc-рецепторами или рецепторами комплемента на таких клетках. Феномен ADE наблюдается при инфицировании разнообразными вирусами: денге, флавивирусом, SARS-CoV, MERS-CoV, Эбола. Цитокиновый шторм (гиперцитокинемия) – ведущий фактор патогенеза многих летальных инфекций. Речь, в частности, идет:
- о системном воспалительном синдроме (SIRS);
- испанском гриппе («испанка» 1918 г., смертность – 10% (пандемия));
- тяжелом остром респираторном синдроме (SARS) (смертность – 10% (пандемия));
- сезонном гриппе;
- сепсисе (смертность – 25–50%);
- вирусе денге;
- хантавирусе (смертность – 30%).
Большинство исследований цитокинового шторма были сосредоточены на прямых измерениях уровней нескольких цитокинов и хемокинов в периферической крови и не позволили изучить весь иммунный каскад в контексте инфекционного патогена. В то же время исследование периферической крови не дает информации о точной концентрации цитокинов в организме. Локализация первичной инфекции, по-видимому, не является определяющим фактором тяжести местного и системного цитокинового шторма. Все они могут привести к неразличимым клиническим синдромам острого повреждения легких с дыхательной недостаточностью, сепсисом и цитокиновым штормом [21].
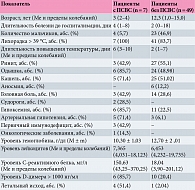
По нашим данным, цитокиновый шторм (полисистемный воспалительный синдром, ПСВС) протекает с общим недомоганием, потерей аппетита. гриппоподобным синдромом (повышение температуры, боль в горле, респираторные симптомы, цефалгия, миалгия). Нередко регистрируются абдоминальные симптомы (таблица). Как видно из таблицы, ПСВС отмечался у детей младшего возраста на фоне поздней госпитализации. Последнее могло быть связано с предшествующей патологией, на фоне которой воспалительная активность в дебюте заболевания была не выражена. Для этой небольшой группы во время госпитализации были характерны высокая лихорадка и длительный период повышенной температуры, поражение центральной нервной системы в виде судорожного синдрома, одышка, гипоксемия, снижение концентрации гемоглобина, высокие показатели С-реактивного белка и D-димера. Примечательно, что ПСВС у подавляющего большинства обследованных нами пациентов развился на фоне первичных иммунодефицитов и онкологических заболеваний. В какой-то степени эти данные могут быть обусловлены специализацией клиник, в которых мы наблюдали часть наших больных. Нарушение обоняния и вкуса связывают с COVID-19. Отсутствие случаев аносмии в группе пациентов с ПСВС, вероятно, обусловлено младшим возрастом, который не позволял получить сведения о субъективных ощущениях.
Клиническая картина
Типичный инкубационный период COVID-19 – от одного до 14 дней, в среднем 3–7 дней. Признаки и симптомы заболевания: астения, лихорадка, возможны кожная сыпь, диарея, ринорея, заложенность носа, кашель, рвота, боль в животе, тахипноэ, тахикардия. Риск тяжелого течения присущ детям с сопутствующими заболеваниями (врожденным пороком сердца, бронхиальной астмой, гипоплазией легких, аномалией дыхательных путей, анемией, метаболическими заболеваниями, иммунодефицитом). На тяжелое течение заболевания указывают:
- частота дыхания > 50 в минуту у детей в возрасте от двух до 12 месяцев, > 40 в минуту у детей в возрасте от года до пяти лет, > 30 в минуту у пациентов старше пяти лет (после исключения эффектов лихорадки и плача);
- постоянная высокая температура в течение 3–5 дней;
- вялость, нарушение сознания;
- повышенные уровни ферментов миокарда и печени, лактатдегидрогеназы;
- метаболический ацидоз;
- двусторонняя или многодольная инфильтрация, плевральный выпот или быстрое прогрессирование состояний в течение очень короткого периода времени;
- внелегочные осложнения;
- другие вирусные и бактериальные коинфекции [22].
Специфических лабораторных изменений не выявлено. Возможны лимфопения, повышение активности лактатдегидрогеназы и трансаминаз, в тяжелых случаях отмечаются катастрофические изменения гемограммы. Диагноз основывается на обнаружении вирусной РНК, специфических антител.
Обычные результаты рентгенографии грудной клетки у детей с пневмонией, обусловленной COVID-19, включают двусторонние периферические и субплевральные матово-стеклянные затемнения и консолидацию.
Дифференциальный диагноз проводят с аденовирусной инфекцией, гриппом, парагриппом, респираторно-синцитиальной, метапневмовирусной и риновирусной инфекцией, бактериальной пневмонией, Chlamydia pneumoniae, Mycoplasma pneumoniae [23].
Лечение
Лечение проводится на основании местных клинических рекомендаций [24]. Рекомендации по поддерживающему уходу за детьми с COVID-19 аналогичны рекомендациям для взрослых: постельный режим, достаточное потребление калорий и воды.
Противовирусные препараты. Ремдесивир показан для лечения COVID-19 легкой и средней степени у взрослых и детей (в возрасте до 18 лет и весом не менее 1,5 кг), которые госпитализированы или не госпитализированы, но имеют высокий риск прогрессирования до тяжелой формы, включая госпитализацию или смерть. Применение ремдесивира у госпитализированных пациентов с запущенной формой COVID-19 и поражением легких ассоциируется с более быстрым выздоровлением по сравнению с плацебо.
Нирматрелвир/ритонавир (Паксловид) одобрен FDA для лечения COVID-19 легкой и средней степени у взрослых с высоким риском прогрессирования до тяжелой формы, включая госпитализацию и смерть. Нирматрелвир ингибирует протеазу SARS-CoV-2-3CL и репликацию вируса на стадии протеолиза (до репликации вирусной РНК). Нирматрелвир сочетается с низкой дозой ритонавира для замедления его метаболизма и обеспечения более высокого системного воздействия.
Глюкокортикостероиды (ГКС). Использование ГКС улучшает выживаемость госпитализированных пациентов с тяжелой формой заболевания, которым требуется дополнительный кислород. При этом наибольшая польза отмечается у тех, кому требуется искусственная вентиляция легких. Согласно результатам исследования RECOVERY (2020), дексаметазон стал первым препаратом, снизившим смертность от COVID-19.
Иммуномодуляторы. Помимо ГКС тоцилизумаб и барицитиниб являются препаратами, которые существенно снижают гипервоспаление, вызванное высвобождением цитокинов. Ингибитор интерлейкина 6 тоцилизумаб рекомендован для госпитализированных взрослых и детей (от двух лет) с COVID-19, которым требуется дополнительный кислород, неинвазивная или инвазивная искусственная вентиляция легких либо экстракорпоральная мембранная оксигенация (ЭКМО). Барицитиниб – ингибитор янус-киназы. Предложен для лечения предполагаемой или лабораторно подтвержденной коронавирусной инфекции у госпитализированных пациентов в возрасте от двух лет, которым требуются дополнительный кислород, инвазивная искусственная вентиляция легких или ЭКМО.
Любой из этих препаратов может использоваться с ремдесивиром или без него в зависимости от стадии COVID-19.
Профилактика
Предусмотрены общегигиенические мероприятия, ношение маски. Специфическая профилактика предусматривает вакцинацию в соответствии с рекомендациями Минздрава России.
Прогноз
Существует мнение, что, хотя дети заражаются COVID-19 так же, как и взрослые, у них чаще отмечается бессимптомное или более легкое течение заболевания [25]. Но не исключено развитие постковидного синдрома.
Заключение
Эксперты Всемирной организации здравоохранения констатировали завершение пандемии COVID-19. Но инфекция не исчезла, она протекает бессимптомно, в легкой, тяжелой и даже фатальной формах. Переход от бессимптомного или легкого течения к тяжелому может быть стремительным. Классическая симптоматика включает в себя лихорадку, кашель, одышку (в тяжелых случаях). Возможны глазные, неврологические, кишечные симптомы, кардит, геморрагии, ПСВС. В исходе вероятны недостаточность кровообращения, пневмосклероз, неврологический дефицит, синдром хронической усталости. COVID-19 следует исключать при наличии лихорадки, респираторных симптомов, аносмии и нарушения вкуса (преимущественно у взрослых). Рентгеновские исследования у пациентов с соответствующей клинической картиной выявляют двухстороннюю легочную инфильтрацию. Лабораторно обнаруживают лимфопению, повышение активности лактатдегидрогеназы и трансаминаз. Диагноз основывается на обнаружении вирусной РНК, специфических антител.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Финансирование. Отсутствует.
V.M. Delyagin, PhD, Prof.
Dmitry Rogachev National Medical Research Center for Pediatric Hematology, Oncology and Immunology
Contact person: Vasily M. Delyagin, delyagin-doktor@yandex.ru
Based on the results of our own research and literature data, the genesis of the new coronavirus infection, epidemiology, pathophysiology, clinical and instrumental picture, differential diagnosis, treatment and prognosis are analyzed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.