Мигрень. Междисциплинарные аспекты
- Аннотация
- Статья
- Ссылки
- English
Введение
Мигрень (G43 по Международной классификации головной боли 3-го пересмотра, МКГБ-3) – комплекс нейрососудистых состояний, характеризующихся повторными эпизодами головной боли, часто односторонней, нередко сочетающейся со зрительными или сенсорными расстройствами, определяемыми как аура и обычно предшествующими головной боли, хотя иногда возникающими после приступа цефалгии. Исходя из этого, мигрень классифицируют как мигрень с аурой (G43.1) и без ауры (G43.0).
Мигрень имеет явную генетическую предрасположенность и чаще регистрируется у женщин с дебютом в молодом возрасте. Особенностью мигрени является сенсибилизация к боли ноцицептивных нейронов центральной нервной системы. В итоге малейшее внешнее раздражение способно вызвать сильную головную боль, вплоть до неврологических расстройств. Возникает хронизация процесса, вследствие чего резко снижается качество жизни [1]. Нередко мигрень ассоциируется с системными процессами и риском сердечно-сосудистых заболеваний.
Проблемы своевременной диагностики и дифференциальной диагностики синдрома головной боли, лечения, профилактики осложнений мигрени приводят пациентов к неврологам, семейным врачам, терапевтам, специалистам по функциональной и визуальной диагностике.
Распространенность
По нашим данным, во время диспансерного обследования из 485 городских женщин в возрасте 20–39 лет о мигрени заявили 72 (14,85%). По итогам объективной диагностики, мигрень зарегистрирована у 24 (4,95%) женщин. По результатам обследования 350 женщин этого же возраста в сельской местности и небольших райцентрах, о мигрени сообщили 28 (8%) опрошенных. Согласно данным объективной диагностики, мигрень выявлена в семи (2%) случаях. В развитых странах мигрень зарегистрирована у 7% детей школьного возраста и 15% взрослого населения, из них 2/3 – женщины. Пик распространенности приходится на 35–40 лет, у 75% мигрень дебютирует в возрасте до 35 лет. С возрастом частота приступов, их интенсивность и общая распространенность мигрени снижаются. Начало мигрени в возрасте старше 50 лет заставляет исключать вторичную головную боль.
Диагностика
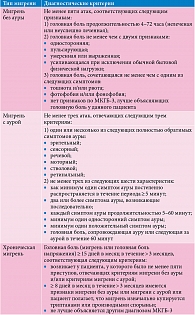
Диагностика строится на критериях МКГБ-3: мигрень без ауры, мигрень с аурой и хроническая мигрень [2] (таблица). Более развернутая классификация представлена в Международной классификации болезней 10-го пересмотра [3]. Аура при мигрени обычно описывается как мерцания или скотома, реже как гемисенсорные симптомы или нарушения речи. Обратимые очаговые неврологические симптомы развиваются постепенно в течение 5–60 минут. В ближайший час после начала ауры появляется головная боль. Но аура может возникнуть как в период боли, так и в период ее отсутствия.
Физиологическая основа ауры при мигрени – самораспространяющаяся волна деполяризации коры головного мозга, что нарушает ионные градиенты и приводит к церебральной гипоперфузии. Возникает головная боль. Гемодинамические нарушения отмечаются по результатам нейровизуализации только у пациентов с мигренью с аурой, но не регистрируются у пациентов без ауры. Волна деполяризации коры головного мозга временно открывает нейронный канал паннексин-1. В итоге освобождаются медиаторы воспаления: оксид азота и простаноиды. Внутричерепные сосуды по законам воспаления (rubor, tumor, dolor, color, functia lesae) расширяются, появляются отек и боль.
Обследование должно включать общий терапевтический и неврологические осмотры, хотя обычно аномальных результатов не бывает. На высоте приступа на ЭЭГ может регистрироваться эпилептиформная активность. Мигрень – клинический диагноз. Диагностические исследования проводятся только для исключения структурных, метаболических, воспалительных и других причин головной боли, которые имитируют или сосуществуют с мигренью. Выбор лабораторных и/или визуализирующих исследований определяется клинической картиной в каждом конкретном случае. В частности, у пожилых людей с похожими симптомами (например, болезненностью кожи головы) измерение скорости оседания эритроцитов и С-реактивного белка может быть целесообразным для исключения височного/гигантоклеточного артериита. Тестирование поля зрения следует проводить при наличии стойких зрительных симптомов. Разработка объективного количественного биологического измерения тяжести цефалгии способна улучшить диагностику мигрени и обеспечить точную оценку эффективности лечения. Количественное сенсорное тестирование позволяет выявлять значительные различия в восприятии вибротактильной стимуляции у пациентов с мигренью по сравнению с контрольной группой, включая различение амплитуды стимула, оценку временного порядка и различение продолжительности [4]. Высокие концентрации пептида, связанного с геном кальцитонина (CGRP), в периферической крови, нейротрансмиттера, вызывающего расширение сосудов, могут помочь в диагностике хронической мигрени, выступая в качестве биомаркера постоянной тригеминоваскулярной активации.
В исследовании у пациентов с мигренью уровень CGRP составил 74,90 пг/мл, значительно превысив аналогичный показатель у пациентов контрольной группы. Образцы крови в исследовании были получены между, но не в период приступов мигрени. Кроме того, у пациентов с хронической мигренью с аурой в анамнезе уровень CGRP был значительно выше, чем у пациентов с хронической мигренью, у которых никогда не было ауры [5].
Дифференциальный диагноз мигрени включает другую первичную головную боль, в основном типа головной боли напряжения, некоторую вторичную головную боль, особенно посттравматическую. Исключить немигренозную боль требуется:
- при первой или самой сильной головной боли в жизни пациента, особенно быстро начавшейся;
- изменении частоты, тяжести и/или клинических признаков приступа;
- новой прогрессирующей головной боли, которая сохраняется в течение нескольких дней;
- усилении или появлении головной боли при пробах Вальсальвы (натуживание, кашель, чихание);
- наличии сопутствующих неврологических признаков или симптомов (диплопия, потеря чувствительности, слабость, атаксия);
- начале головной боли в возрасте старше 55 лет;
- головной боли, развивающейся после черепно-мозговой или другой серьезной травмы;
- постоянной односторонней пульсирующей головной боли;
- головной боли, сопровождающейся ригидностью затылочных мышц и/или лихорадкой;
- типичном анамнезе или необычном характере, не отвечающем критериям мигрени;
- неадекватной реакции на оптимальную терапию.
Немигренозная головная боль может наблюдаться при внутричерепных аневризмах и геморрагиях, хронической пароксизмальной гемикрании, кластерной боли, вирусных и бактериальных менингитах и энцефалитах, синдроме Толоза – Хант (болезненная рецидивирующая офтальмоплегия: сильная периорбитальная головная боль, уменьшение и болезненность движений глаз; симптомы обычно поражают только один глаз), височном гигантоклеточном артериите и др. [6].
Генетика мигрени
В исследованиях обнаружено не менее 123 локусов, позволяющих оценить общие и различные генетические компоненты двух основных подтипов мигрени: мигрени с аурой и мигрени без ауры. Стратификация локусов риска выявила три варианта риска, которые, вероятно, специфичны для мигрени с аурой (в HMOX2, CACNA1A и MPPED2), два, которые, по-видимому, специфичны для мигрени без ауры (близкие к SPINK2 и FECH), и девять, которые увеличивают предрасположенность к мигрени независимо от ее подтипа. Локусы риска включают гены, кодирующие мишени для ее лечения, а именно: пептид, родственный гену кальцитонина (CALCA/CALCB), и рецептор серотонина 1F (HTR1F). В целом с мигренью ассоциировались прежде всего геномные локусы, связанные с сосудами, тканями/клетками центральной нервной системы и висцеральной гладкой мускулатурой, что подтверждает приоритетность нейроваскулярных механизмов в основе патофизиологии мигрени [7, 8].
Обращают на себя внимание гены, участвующие в транспорте ионов в синапсах и глутаматергической передаче. Изучение семейной мигрени с родословной ауры также выявило другие каузальные гены моногенных форм мигрени. Учитывая преобладание женщин, страдающих мигренью (3:1), можно предположить, что гормональные или Х-связанные компоненты способствуют мигрени. Не подвергаются сомнению генетические варианты митохондриальной ДНК (митохондрии передаются потомству только матерью!). Эпигенетические варианты продемонстрировали связь между гормональными вариациями и изменениями метилирования ДНК и экспрессии генов. Таким образом, мигрень – полигенное заболевание, за исключением небольшого числа моногенных синдромов (например, семейная гемиплегическая мигрень).
Близнецовые и семейные исследования показади, что мигрень наследуется с вероятностью 49%. Мы наблюдали 17 семей, в которых матери страдали мигренью (четыре с аурой, 13 – без ауры). У двух из них имел место синдром Элерса – Данлоса, у двух – Марфана, у семи – синдром гипермобильности суставов. К 45 годам приступы мигрени постепенно прекратились у восьми женщин, к 55 годам – практически у всех. В трех случаях приступы возобновлялись как менее выраженные при позднем засыпании, эмоциональных стрессах. В этих семьях отслеживалось состояние здоровья у 15 детей. У семерых (все девочки) в препубертатном и пубертатном возрасте появились приступы мигрени без ауры. У всех 15 наблюдалась дисплазия соединительной ткани, в том числе у троих – синдром Элерса – Данлоса. У одного ребенка в 29-летнем возрасте на фоне синдрома Элерса – Данлоса, пролапса митрального клапана, аритмии диагностирован неспецифический язвенный колит.
Патогенез
Анатомо-физиологическим субстратом мигрени считается тригеминоваскулярная система. Внутри нее ноцицептивная передача приводит к появлению боли при мигрени [8, 9]. Возникновение мигрени зависит от активации и сенсибилизации тригеминоваскулярных нейронов первого порядка. Афферентные волокна этих нейронов иннервируют мозговые оболочки и их сосуды, проецируют структуры в центральную нервную систему. Активация нейронов высвобождает вазоактивные пептиды и вызывает местные воспалительные реакции [10, 11]. Данный процесс в свою очередь сенсибилизирует и разряжает вторичные нейроны в стволе мозга, затем нейроны третьего порядка в таламусе до тех пор, пока ноцицептивные импульсы достигнут соматосенсорных и других регионов коры, вовлеченных в восприятие боли.
Механизмы, запускающие приступ мигрени, неясны. Одни данные свидетельствуют в пользу периферического происхождения на периваскулярном уровне тройничного нерва. Другие данные указывают на генезис в центральной нервной системе, связанной с дисфункцией нейронов в стволе мозга и промежуточном мозге. Мигрень может быть результатом нарушения обмена глюкозы в мозге. Возникает митохондриальная дисфункция головного мозга, снижаются уровень глюкозы в мозге и объем серого вещества в определенных областях головного мозга. Более того, периферическая инсулинорезистентность может распространяться на мозг, приводя к резистентности мозга к инсулину. Это состояние подавляет рецепторы инсулина в астроцитах и нейронах, вызывая снижение поглощения глюкозы и синтеза гликогена, главным образом при высокой метаболической потребности [12]. Неотъемлемой чертой мигрени является ее повторяемость. Пациенты часто описывают факторы (некоторые продукты, голодание, стресс, нарушения сна), которые они воспринимают как провоцирующие приступ мигрени. Но ретроспективные оценки крайне субъективны, предвзяты, ограничены ложной атрибутацией. Post hoc, ergo propter hoc (после этого – вследствие этого; лат.) – логическая ошибка, заставляющая воспринимать временную случайную последовательность событий как причинно-зависимую.
В эксперименте вызвать приступ мигрени провоцирующими факторами, на которые ссылались пациенты, удалось только у троих из 27. В клинических моделях мигрени выявлены сигнальные молекулы, вызывающие ее приступ. Эти молекулы – мощные сосудорасширяющие соединения, широко представленные в тригеминоваскулярной системе: пептид, родственный гену кальцитонина (CGRP), пептид, активирующий аденилатциклазу гипофиза, 38 (PACAP-38), оксид азота. При введении оксида азота (индуцированный тринитроглицерином) мигрень разыгрывалась у 80% пациентов, при инфузии CGRP – у 57%, PACAP-38 – у 58% [13–15]. Происходит повышение концентрации внутриклеточного циклического гуанозинмонофосфата (цГМФ), CGRP и PACAP-38 вызывают увеличение внутриклеточного циклического аденозинмонофосфата (цАМФ5). Активация цАМФ и цГМФ опосредованно приводит к открытию АТФ-чувствительных калиевых каналов. Модуляция ноцицептивной передачи по ионным (в основном калиевым) каналам может быть универсальным путем генеза приступа мигрени [16–18]. Действительно, после внутривенного введения левкромакалина, активатора калиевого АТФ-канала, у всех пациентов с мигренью развивается приступ болезни. Вероятно, что во время атаки мигрени на стенках внутричерепных артерий в гладкомышечных клетках открываются калиевые АТФ-каналы, что приводит к дилатации сосудов. Активируются периваскулярные афферентные веточки тройничного нерва, генерирующие ноцицептивные импульсы. Последние передаются в подкорковые структуры и кору мозга, появляется восприятие боли. Повышение внеклеточной концентрации не только калия, но и других катионов активирует и сенсибилизирует периваскулярные первичные афферентные нейроны тройничного нерва. Модуляторная активность ионных каналов описана и при других пароксизмальных болевых расстройствах, например при семейном эпизодическом болевом синдроме.
Клинические модели мигрени, созданные на основе молекул тригеминоваскулярной системы, открывают перспективы разработки специфической терапии мигрени. В частности, предлагается применение ингибиторов синтазы азота, антагонистов CGRP или его рецептора. В перспективе возможно использование препаратов, воздействующих на PACAP-38 или аденилатциклазу гипофиза. Для профилактики и лечения мигрени в эксперименте применяли моноклональные антитела к рецептору полипептида типа I (PAC1) и PACAP-38 [19–21].
Ведение пациентов с мигренью
В процесс ведения пациентов с мигренью могут вовлекаться многие специалисты: терапевт (врач общей практики), невролог, нейроофтальмолог, психолог, гинеколог (менструальная мигрень), специалисты функциональной диагностики, альтернативных методов лечения и др. Важно отрегулировать режимные и психологические проблемы. Но эффективность неинвазивных нейромодулирующих устройств, биоповеденческой терапии, иглоукалывания, физиотерапии, хиропрактики, диеты убедительно не доказана. На наш взгляд, указанные методики применимы только как отвлекающие процедуры у невротизированных пациенток.
Следует избегать излишних обследований. Американское общество головной боли выпустило перечень из пяти часто выполняемых тестов или процедур, которые не всегда необходимы при лечении мигрени и головной боли, в рамках кампании Фонда Американского совета по внутренним болезням (ABIM) «Выбор с умом» [20–22]:
- не проводить нейровизуализационные исследования у пациентов со стабильной головной болью, которая соответствует критериям мигрени;
- не выполнять компьютерную томографию при головной боли, когда доступна магнитно-резонансная томография, за исключением случаев неотложной помощи;
- не рекомендуется хирургическая деактивация триггерных точек мигрени вне клинических испытаний;
- не назначать препараты, содержащие опиоиды или барбитураты, в качестве терапии первой линии при повторяющихся головных болях;
- не рекомендуется длительное или частое использование безрецептурных обезболивающих препаратов при головной боли.
Лекарственная терапия – основа лечения мигрени. Как правило, препараты, используемые в клинической практике для облегчения или снятия боли, следует назначать в начале приступа мигрени, когда их эффективность значительно выше, чем при позднем приеме [3]. В качестве первой линии при нетяжелых приступах боли можно назначать анальгетики и/или некомбинированные нестероидные противовоспалительные препараты (НПВП). Предпочтительны ацетилсалициловая кислота, ибупрофен, диклофенак. Возможно использование прокинетиков (домперидон). В купировании приступа эффективны агонисты серотониновых рецепторов типа 5HT (триптаны) – препараты второй линии. Триптаны имеют преимущество у пациентов с тяжелыми приступами и выраженной дезадаптацией, а также при длительном течении мигрени, когда эффективность других препаратов снижается. Переход с одного перорального триптана на другой рекомендуется, если лечение трех приступов мигрени не увенчалось успехом. Если пероральный триптан снимает боль недостаточно, целесообразно использовать комбинацию перорального триптана и быстродействующего НПВП (например, напроксена). Подкожные инъекции суматриптана – наиболее эффективный метод при неэффективности пероральных форм, рвоте, быстро нарастающей головной боли.
Следует помнить о риске передозировки лекарственных препаратов при частой и ежедневной головной боли.
Профилактическое лечение. Мигрень – рецидивирующее расстройство и может потребовать профилактического лечения. Цель – не лечение мигрени, а уменьшение частоты, продолжительности или тяжести ее приступов. Профилактическое лечение инициируется в ходе индивидуального лечения [21]. Такое лечение обычно рекомендуют пациентам, страдающим мигренью не менее двух дней в месяц при снижении качества жизни, несмотря на проводимую терапию. Широко используются гипотензивные препараты (бета-блокаторы, кандесартан), антидепрессанты (например, амитриптилин), противосудорожные (топирамат, вальпроат натрия) и блокаторы кальциевых каналов. В качестве профилактического лечения используют моноклональные антитела, нацеленные на CGRP или его рецептор, эффективность которых подтверждена в рандомизированных исследованиях. При хронической мигрени эффективны топирамат и онаботулотоксин А (Ботокс). Клинический опыт свидетельствует о том, что ответ на профилактическое лечение можно оценить и/или заменить препарат через два-три месяца [23, 24].
Заключение
Мигрень – достаточно распространенное заболевание, требующее комплексного подхода и междисциплинарного взаимодействия. Несмотря на большие успехи в расшифровке патогенеза мигрени, разработку новых методов лечения, проблемы остаются. Необходимы дальнейшие молекулярно-генетические исследования, поиск таргетных препаратов.
Источник финансирования.
Авторы заявляют об отсутствии финансирования при проведении исследования.
Конфликт интересов.
Авторы заявляют об отсутствии явных и потенциальных конфликтов интересов при публикации данной статьи.
V.M. Delyagin, PhD, Prof., Zh.M. Moskovtseva, PhD, N.S. Aksyonova
Dmitry Rogachev National Medical Research Center of Pediatric Hematology, Oncology and Immunology
City Children's Clinic № 150, Moscow
Contact person: Vasily M. Delyagin, delyagin-doktor@yandex.ru
Migraine is a complex of common neurological disorders that more often affects women, has a clear genetic basis, more common among urban women and is often associated with connective tissue dysplasia and other genetic diseases. Diagnosis is based on clinical criteria of the International Classification of Headache 3rd Revision. The common symptoms of migraine are recurrent attacks of moderate to severe headache, lasting 4–72 hours, unilateral, throbbing, worse with exertion. Associated symptoms: nausea, vomiting, photo- and phonophobia.
In some cases, migraine is preceded by an aura, which is defined as reversible focal neurological symptoms, including visual or hemisensory disorders. The trigeminovascular system is involved in the pathogenesis of migraine. Nociceptive signals from the trigeminovascular system are transmitted to the centers of the brain responsible for the perception of pain. The treatment of migraine is based on the identification of molecules involved in the genesis of its attack. Based on domestic and foreign recommendations, the main methods of treatment are presented.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.