Витамин D и гормональный канцерогенез при раке предстательной железы
- Аннотация
- Статья
- Ссылки
- English

Введение
Первое упоминание о наиболее частом проявлении дефицита витамина D (рахите) встречается еще в трудах Сорана Эфесского (98–138 гг. н.э.) и античного медика Галена (131–211 гг. н.э.). В новой истории рахит описал английский терапевт Д. Уистлер в 1645 г. В 1919 г. К. Гульдчинский открыл эффективное действие ртутно-кварцевой лампы (искусственное горное солнце) при лечении больных рахитом детей. Только в 1924 г. витамин D был выделен А. Гессом и М. Вейнштоком при воздействии на растительные масла ультафиолетовыми волнами в диапазоне 280–315 нм. В 1928 г. A. Виндаус получил Нобелевскую премию по химии «за работы по изучению строения стеринов и их связи с витаминной группой», определив химическую структуру витамина D и его предшественников. Долгое время традиционные представления о витамине D были связаны прежде всего с его ключевой ролью в кальциево-фосфорном обмене и влиянии на минеральную плотность костной ткани (профилактика и лечение рахита). Однако в последние десятилетия накоплено огромное количество достоверных научных данных, свидетельствующих о том, что такие представления о витамине D безнадежно устарели [1].
Витамин D как стероидный гормон и его физиологические неклассические эффекты
Термин «витамин D» объединяет целую группу сходных по химическому строению веществ, которые относятся к классу секостероидов: D1, D2, D3 (именно его рассматривают как истинный витамин D, тогда как другие представители этой группы считают модифицированными производными витамина D), D4, D5 [1]. Лучше всего изучены холекальциферол – витамин D3 и эргокальциферол – витамин D2. Витамин D2 можно получить только из пищи растительного происхождения (дрожжи, хлеб, грибы, некоторые овощи). Витамин D3 также может поступать из продуктов питания, в основном животного происхождения (рыбий жир, сливочное масло, яйца, молоко). Однако пищевые продукты не способны возмещать физиологическую потребность в витамине D3, поэтому основной источник витамина D3 – воздействие солнечного света. В-ультрафиолетовый диапазон солнечного спектра (длина волны от 290 до 315 нм) стимулирует синтез витамина D3 (холекальциферола) из провитамина D (7-дегидрохолестерола) в эпидермисе кожи.
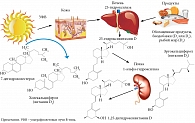
Витамин D – не витамин в классическом понимании. Он исходно биологически инертен и должен пройти два процесса гидроксилирования для превращения в метаболически активную форму, причем этот процесс и биологическое действие проявляются не в месте непосредственного образования [1]. Из кожи подавляющее большинство синтезированного витамина D3 (холекальциферола) поступает в кровообращение и транспортируется в печень, где происходит его первое гидроксилирование с образованием 25-гидроксивитамина-D3 (25(ОН)D), или кальцидиола, – транспортной формы витамина D3. В почках под влиянием гидроксилазы в ходе второго гидроксилирования образуется 1,25-дигидроксивитамин-D3 (1,25(ОН)2D), или кальцитриол, – активная форма витамина D3 [2, 3]. Кератиноциты эпидермиса в отличие от других клеток организма человека имеют весь необходимый набор собственных ферментов-гидроксилаз, которые способствуют преобразованию витамина D3 в активную форму 1,25(ОН)2D непосредственно в коже. Именно эта форма витамина регулирует пролиферацию и дифференцировку эпидермиса (рис. 1) [2–5], и с ней связано большинство физиологических эффектов витамина D3.
От классических витаминов витамин D3 также отличает то, что он не является кофактором ни одного из известных ферментов и может самостоятельно синтезироваться в организме (из холестерина – общего источника для синтеза всех стероидных гормонов).
Наконец, витамин D3 имеет специфический ядерный рецептор в клетках различных органов и тканей, что характерно исключительно для гормонов [1–3]. К активной форме витамина D3 (1,25(ОН)2D) в клетках различных тканей (головной мозг, предстательная и молочная железы, кишечник, матка, иммунокомпетентные клетки, яички, яичники, сперматозоиды, яйцеклетки), а также в митохондриях всех клеток организма человека выявлены специфические рецепторы. Это позволяет рассматривать витамин D именно как гормон D, работающий в рамках так называемой эндокринной системы D-гормона. Функции этой системы заключаются в способности генерировать и модулировать биологические реакции более чем в 40 тканях-мишенях путем регуляции транскрипции генов в ядре клетки (медленный геномный механизм) или активации внутриклеточных трансмиттеров на поверхности клетки (быстрый негеномный молекулярно-клеточный механизм) [6–8]. Геномный путь регуляции приводит к изменениям в транскрипции генов-мишеней в течение нескольких часов и дней, негеномный – в течение нескольких секунд и минут соответственно [9, 10].
Новые представления о витамине D как о мощном стероидном гормоне привели к существенной переоценке его физиологической роли в организме человека [11]. Оказалось, что достаточный уровень гормона D необходим человеку на протяжении всей жизни: от периода новорожденности до самой глубокой старости, поскольку витамин D3 влияет на транскрипцию около 3% человеческого генома, в том числе регулирует важные гены, отвечающие за синтез половых гормонов и регуляцию углеводного обмена, нарушения функции которых закономерно сопровождаются низким качеством жизни и ускоренным старением человека [9, 10, 12].
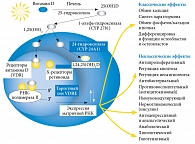
Принято выделять классические эффекты витамина (гормона) D (регуляцию фосфорно-кальциевого обмена и костного метаболизма) и неклассические: торможение клеточной пролиферации и ангиогенеза (антиапоптический и противоопухолевый эффект), контроль секреции инсулина (гипогликемический эффект), активация синтеза в клетках природных белков-антибиотиков (кателицидинов) (антибактериальный и противовоспалительный эффект) и др. (рис. 2) [2, 6].
Распространенность дефицита витамина D
С учетом особенностей синтеза витамина D в коже, невозможного без интенсивного ультрафиолетового B-излучения, и дефицита потребления достаточного количества продуктов животного происхождения, содержащих витамин D, проблема дефицита/недостатка витамина D приобрела глобальное значение.
В группу риска по развитию дефицита витамина (гормона) D входят младенцы, беременные, пожилые лица, лица с ограниченным пребыванием на солнце, темнокожие, пациенты с ожирением, заболеваниями, сопровождающимися нарушением всасывания жиров, в том числе перенесшие шунтирование желудка [2, 3].
Особенно подвержены развитию дефицита или недостаточности гормона D люди, проживающие севернее 35-й параллели северной широты, что обусловлено недостаточным уровнем инсоляции большую часть года [2, 3, 6]. В силу географического фактора россияне относятся к группе высокого риска в отношении дефицита/недостаточности витамина (гормона) D, поэтому решение этой проблемы должно стать краеугольным камнем концепции оздоровления нации [12].
Данные о частоте дефицита витамина (гормона) D в мировой популяции неоднозначные и порой противоречивые, что во многом объясняется географией района исследования, уровнем годовой инсоляции, климатом, характером и привычками питания. Однако можно утверждать, что не менее 50% населения Земли испытывают симптомы дефицита/недостатка витамина (гормона) D [2, 13].
С возрастом все больше людей (до 80–90%), в том числе даже те, кто проживает в регионах с достаточным уровнем инсоляции, имеют дефицит витамина D. С неуклонным ростом степени выраженности дефицита/недостатка витамина (гормона) D увеличивается частота разнообразных ассоциированных с возрастом заболеваний. Последние эпидемиологические и экспериментальные данные показали, что низкий уровень витамина (гормона) D тесно связан с высоким риском общей смертности, сердечно-сосудистыми и онкологическими заболеваниями, артериальной гипертензией, саркопенией (дефицитом мышечной массы), ожирением, метаболическим синдромом, остеопорозом, а также инсулинорезистентностью и сахарным диабетом первого и второго типов у взрослых людей (табл.) [14–23].
Дефицит витамина D и канцерогенез
В настоящее время на фоне высокой распространенности дефицита витамина D продолжается рост числа онкологических заболеваний, поэтому можно предположить, что дефицит витамина D вносит вклад в канцерогенез. В наибольшем количестве исследований изучалась связь дефицита/недостаточности витамина D и рака молочной железы и предстательной железы (РПЖ) как наиболее частых форм рака у женщин и мужчин соответственно.
Общие потенциальные механизмы участия витамина D в канцерогенезе
Витамин D выполняет важные физиологические функции в организме, нарушение которых может запускать избыточную клеточную пролиферацию, снижение апоптоза и усиление неоангиогенеза – ключевые молекулярные механизмы развития любой злокачественной опухоли. Опухоль прогрессирует на фоне системного хронического воспаления, выраженного окислительного стресса, обусловленного гиперпродукцией свободных радикалов, и энергетического клеточного дисбаланса, вызванного нарушением функции тирозинкиназных рецепторов [24, 25]. Согласно общепринятой точке зрения, рецепторы тирозинкиназы имеют особое значение для развития и прогрессирования рака.
В опухолевой клетке имеются рецепторы к инсулину и инсулиноподобным факторам роста 1 и 2 [26]. Инсулин – единственный гормон, регулирующий внутриклеточный транспорт глюкозы, – осуществляет клеточные регуляторные функции посредством тирозинкиназного рецептора. Поэтому любая гиперинсулинемия вследствие снижения чувствительности тканей к инсулину (инсулинорезистентности) (что наблюдается при сахарном диабете, ожирении, любом окислительном стрессе и старении) закономерно приводит к избыточной активации тирозинкиназных рецепторов как в здоровых, так и потенциально раковых клетках. Именно инсулин и тирозинкиназный рецептор, обусловливающие развитие инсулинорезистентности, играют важную роль в биологии рака [25, 26].
С одной стороны, витамин D регулирует экспрессию инсулиновых рецепторов, и его дефицит закономерно приводит к инсулинорезистентности, ожирению, сахарному диабету второго типа, а через них – к промоции (вторая стадия канцерогенеза). С другой стороны, выраженный дефицит витамина D – важного жиромобилизующего стероидного гормона – практически всегда сопутствует ожирению. Его роль в канцерогенезе считается ключевой. Около 20% всех новых случаев рака вызваны ожирением [27, 28].
Согласно данным последних метаанализов, большинство современных доказательных исследований подтверждают положительную связь между ожирением и риском рака в целом, а также между ожирением и низким уровнем витамина D в крови независимо от возраста, места проживания и методов определения уровня витамина D в крови [27, 28]. Вместе с тем, по мнению авторов одного из метаанализов, значение посреднической роли витамина D в биологических механизмах, связывающих ожирение и рак, пока недостаточно ясно. В этой связи в дальнейшем необходимы исследования, которые бы одновременно изучали связь ожирения, дефицита витамина D, рака с полиморфизмом рецепторов витамина D [27]. Несмотря на это, имеющиеся в литературе данные однозначно указывают на митогенные эффекты инсулина в условиях патологической гиперинсулинемии/инсулинорезистентности, в том числе на фоне дефицита витамина D:
- прямые митогенные эффекты инсулина (посредством цАМФ-зависимого механизма через тирозинкиназные рецепторы, экспрессия которых имеется как в нормальных, так и потенциально раковых клетках);
- клеточно-пролиферативный эффект инсулина (механизм не ясен);
- замедление клеточного апоптоза (с помощью внутриклеточного инсулиноподобного фактора роста 1);
- усиление окислительного стресса посредством нарушения функции цикла Кребса в митохондриях (митохондриальная дисфункция); гормональный канцерогенез. Ожирение ведет к инсулинорезистентности, которая в свою очередь усугубляет ожирение, что в совокупности приводит к снижению секреции половых гормонов и витамина D (регуляторов инсулиновых рецепторов), прогрессированию инсулинорезистентности, замыкая порочный круг канцерогенеза [29, 30].
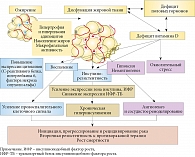
Потенциальные гормональные механизмы канцерогенеза представлены на рис. 3, одну из центральных ролей играет дефицит/недостаток витамина D [31, 32].
Витамин D и рак предстательной железы
В настоящее время уточнены уже известные и выявлены новые механизмы канцерогенеза РПЖ, которые позволяют говорить об определенной роли витамина D в этом процессе, хотя связь между витамином D и РПЖ до сих пор вызывает научные дискуссии, а имеющиеся данные неоднозначны, а в ряде случаев противоречивы [20].
Так, H.E. Meyer и соавт. (2013) в контролируемом исследовании (n = 2106) выявили положительные корреляции между уровнем в крови 25(OH)D > 30 нмоль/л и риском РПЖ (отношение рисков 1,15, 95%-ный доверительный интервал 1,04–1,27) [22].
Польские ученые установили, что у пациентов с РПЖ наблюдается более тяжелый дефицит витамина D по сравнению с таковым у мужчин с ДГПЖ [33].
В метаанализе, который включил 126 исследований, посвященных влиянию полиморфизма генов рецепторов к витамину D (BsmI, TaqI, FokI и ApaI) на риск развития РПЖ, достоверно показано, что риск развития РПЖ может быть связан не только с уровнем витамина D в крови, но и полиморфизмом гена рецепторов к нему [23]. Так, во всех исследованиях был установлен достоверно более высокий риск РПЖ для мужчин-носителей гена BsmI. При дальнейшей стратификации рисков для носителей гена BsmI, особенно для представителей европеоидной расы, выявлен повышенный риск развития колоректального рака и рака кожи. Однако для других генов таких значимых ассоциаций выявлено не было. У носителей гена TaqI был выше риск развития рака ротовой полости, грудных желез и базальноклеточного рака, в то время как риск РПЖ оказался низким. Носительство гена FokI ассоциировалось с повышенным риском развития рака кожи и пониженным риском глиомы. Носители гена ApaI, особенно лица азиатской популяции, имели повышенный риск развития базальноклеточного рака. Таким образом, ген BamI – наиболее важный генетический предиктор развития рака в популяции в целом, а ген TaqI снижает риск развития РПЖ [23].
В крупном систематическом обзоре 2013 г. не установлено влияния дополнительного приема витамина D на сердечно-сосудистую заболеваемость, риск развития рака и общую смертность [34]. Аналогичное заключение было сделано и в более раннем метаанализе 2011 г. [35].
A.B. Murphy и соавт. (2014) обследовали 667 мужчин в возрасте от 40 до 79 лет, впервые подвергшихся диагностической биопсии предстательной железы. У американцев европейского происхождения уровень 25(ОН)D в крови менее 12 нг/мл ассоциировался с более злокачественным РПЖ по шкале Глисона (4 + 4) и более запущенной стадией заболевания. У американцев негроидной расы уровень 25(ОН)D в крови менее 20 нг/мл достоверно коррелировал с повышенной вероятностью диагноза РПЖ при биопсии [36].
По данным W.B. Grant (2014), дефицит витамина D ассоциировался с увеличением риска развития более агрессивного РПЖ у пациентов с повышенным уровнем ПСА или подозрением на РПЖ по результатам пальцевого ректального исследования предстательной железы [37]. Поэтому у таких пациентов для прогнозирования положительных или отрицательных результатов биопсии может иметь значение предварительное определение уровня витамина D в крови.
Наличие у мужчин с РПЖ некорректированного дефицита витамина D существенно снижает общую выживаемость, в том числе после радикальной простатэктомии [38, 39]. Радикальная простатэктомия избавляет пациента от РПЖ на ранних стадиях. Однако онкологи недостаточно осведомлены о канцеропротективных эффектах витамина D, поэтому не определяют у пациентов уровень 25(ОН)D в крови до операции и не назначают им препараты витамина D при выявлении его дефицита после радикального лечения РПЖ.
Одно из недавних исследований наглядно показало, что средний уровень в крови витамина D у мужчин 42–79 лет после радикальной простатэктомии составляет 26 нг/мл, при этом у 65% имеет место недостаточность витамина D (< 30 нг/мл), а у 32% – его дефицит (< 20 нг/мл). Однако авторы не выявили достоверных корреляций между уровнем витамина D в крови и возрастом, градацией РПЖ по шкале Глисона, стадией или частотой позитивного края опухоли [40].
В литературе в последние годы все чаще высказывается мысль о том, что витамин D регулирует дифференцировку клеток РПЖ. В этой связи есть вероятность того, что наблюдаемый в течение долгого времени дефицит витамина D может вносить вклад в прогрессирование РПЖ от субклинической до клинической стадии [41]. Это особенно актуально для мужчин негроидной расы, у которых распространен дефицит витамина D, а также выше уровень заболеваемости РПЖ и смертности от РПЖ по сравнению с мужчинами европеоидной расы.
Недавно завершено открытое клиническое исследование, в котором оценивались безопасность и потенциальная эффективность витамина D3 в суточной дозе 4000 международных единиц (МЕ) в течение года у мужчин с диагнозом РПЖ ранней стадии и низким уровнем риска РПЖ при активном наблюдении. Более чем у 50% включенных в исследование мужчин уменьшилось число положительных ядер клеток на повторной биопсии простаты [41]. После года применения препаратов витамина D не выявлялось разницы в уровне витамина D в крови у мужчин негроидной и европеоидной расы, которые завершили исследование. Это важно еще с той точки зрения, что черный цвет кожи – фактор риска развития дефицита витамина D, а частота РПЖ у афроамериканцев, переезжающих в США, в разы выше, чем у местных мужчин европеоидной расы [41].
Наконец, согласно новейшим эпидемиологическим данным, дефицит витамина D независимо повышает риск смертности от онкологических заболеваний на 14%, а риск смертности от всех причин – на 35% [42, 43]. За этими цифрами стоят десятки и сотни тысяч пациентов, поэтому недальновидно и безнравственно отказывать им в компенсации дефицита витамина D, что может способствовать как профилактике РПЖ, так и улучшению результатов любых вариантов его лечения на всех стадиях процесса.
Диагностика и лечение дефицита витамина D
Наиболее адекватный метод оценки уровня витамина D – определение в крови его промежуточного метаболита 25(OH)D. 25(OH)D в полной мере отражает суммарное количество витамина D, производимого в коже из 7-дигидрохолестерола под действием ультрафиолетовых В-лучей и получаемого из пищевых продуктов и пищевых добавок, и имеет довольно продолжительный период полураспада в крови – порядка 15 дней [1]. Золотым стандартом определения концентрации 25(ОН)D в крови во всем мире является метод тандемной хромато-масс-спектрометрии (мультистероидный анализ). Он позволяет максимально точно (в отличие от наиболее распространенного радиоиммунного анализа) выявить дефицит или недостаток витамина D.
Дефицит витамина D определяется как уровень 25(OH)D в крови менее 20 нг/мл (50 нмоль/л). Этого мнения придерживаются и эксперты Международного эндокринологического общества. Многие специалисты считают, что уровень 20–30 нг/мл (50–75 нмоль/л) следует расценивать как недостаток витамина D, а оптимальный уровень составляет более 30 нг/мл (75 нмоль/л). Однако уже сейчас существует целый ряд исследований, демонстрирующих значительные преимущества в отношении здоровья и качества жизни при достижении более высокого уровня 25(OH)D [44, 45]. Согласно рекомендациям Канадского общества экспертов по изучению витамина D, оптимальным уровнем 25(OH)D в крови можно считать 100–150 нмоль/л (40–60 нг/мл). Достижение такой концентрации 25(OH)D позволит снизить риск ассоциированных с возрастом заболеваний (остеопороза, сахарного диабета первого и второго типов, онкологических заболеваний) и увеличить продолжительность жизни [46].
Восполнение дефицита витамина D с помощью препаратов витамина D в настоящее время – необходимое условие достижения и поддержания нормальной концентрации транспортной формы 25(OH)D в крови. Согласно рекомендациям международных экспертов, для профилактики и лечения дефицита витамина D применяется холекальциферол (витамин D3), реже эргокальциферол (витамин D2). Оптимальная доза витамина D подбирается в зависимости от исходной концентрации 25(OH)D в крови. Измерение 25(OH)D – обязательный этап при подборе начальной дозы и определении достаточности компенсации дефицита на фоне терапии.
В различных странах рекомендуемое суточное потребление витамина D3 составляет 400–600 МЕ/сут для взрослых. В настоящее время активно обсуждается повышение суточной дозы до 2000–4000 МЕ/сут, а для лечения ожирения могут потребоваться дозы 6000–10 000 МЕ/сут [2, 3]. Современные исследования показывают, что ежедневный прием 10000 МЕ абсолютно безопасен с точки зрения негативного влияния на кальциевый обмен и процессы ренального литогенеза [47].
Таким образом, долговременное поддержание оптимальной концентрации витамина D в крови – физиологическая и патогенетическая стратегия профилактики и лечения практически всех ассоциированных с возрастом заболеваний, к которым прежде всего относятся стремительно молодеющие сегодня онкологические заболевания, включая РПЖ.
Заключение
К настоящему времени получены убедительные данные о том, что в механизмах канцерогенеза существенную роль играют гормональные факторы, особенно когда речь идет о таких распространенных гормонзависимых раках, как рак молочной железы и РПЖ.
В условиях качественного и количественного дефицита инсоляции у современных жителей мегаполисов все очевиднее будет прослеживаться негативная роль дефицита/недостатка витамина D – мощного метаболически активного стероидного гормона.
Полное избегание прямых солнечных лучей из-за боязни ускоренного фотостарения и рака кожи приводит к тому, что в условиях прогрессирующего с возрастом дефицита витамина D человек быстрее стареет, имеет повышенный риск развития сердечно-сосудистых и онкологических заболеваний. Не надо бояться солнца! Как сказал один из ведущих экспертов по витамину D профессор Марк Соренсон, «…солнечный свет бесплатен. Никто не продает его. Он не имеет ни маркетинговой команды, ни адвоката, чтобы защитить его от лжи и тотального нападения со стороны тех, кто зарабатывает миллиарды долларов ежегодно, проповедуя „солнечную токсичность“ вместо сбалансированного использования солнечного света».
I.A. Tyuzikov, S.Yu. Kalinchenko, M.I. Zhilenko
Clinic of Professor Kalinchenko, Moscow
Peoples’ Friendship University of Russia, Moscow
Contact person: Igor Adamovich Tyuzikov, phoenix-67@list.ru
This review discusses the problem of little attention in the national literature – the role of vitamin D deficiency in the general mechanism of hormone-dependent carcinogenesis. Differences of vitamin D from classical vitamins were revealed. Shown the importance of vitamin D as a powerful metabolic hormone with many so-called non-classical effects (antiproliferative, antiapoptosis and antiangiogenesis), which allow us to consider vitamin D as a steroid hormone with oncostatic and cancer preventive efficiency. Provided possible mechanisms of vitamin D deficiency involvement in the processes of carcinogenesis in general. And on the example of the most relevant gender cancer – prostate cancer – discussed in details pathogenic mechanisms of realization of the carcinogenic mechanisms associated with vitamin D deficiency as well as anti-cancer effects achieved by the way of vitamin D deficiency correction. Based on the analysis of available evidence-based research conclusions were made that the optimal level of 25(OH)D in the blood (vitamin D primary transport form) in the body is one of the most effective methods of cancer prevention, particularly prostate cancer in men.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.