Витамин D и хронический простатит
- Аннотация
- Статья
- Ссылки
- English
Введение
Традиционные представления о важной роли витамина D только в обеспечении кальциево-фосфорного гомеостаза и минеральной плотности костной ткани (совместно с кальцием) в настоящее время устарели [1]. Витамин D не является витамином в классическом понимании. Он образуется de novo в организме из предшественников в биологически неактивной форме (25(ОН)D, или кальцидиол) и только за счет двухступенчатого метаболизма в печени и почках превращается в активную форму (1,25(ОН)2D, или кальцитриол) [1]. Истинные витамины в свою очередь выполняют роль ко-факторов различных клеточных ферментных систем. Кроме того, к активной форме витамина D (1,25(ОН)2D) в клетках различных органов и тканей (головного мозга, предстательной железы, молочной железы, кишечника, мышечной ткани, иммунокомпетентных и половых клетках и т.д.) выявлены специфические рецепторы. Это позволяет рассматривать витамин D не как истинный витамин, а как D-гормон, который генерирует и модулирует медленные геномные и быстрые негеномные молекулярно-клеточные реакции более чем в 40 тканях-мишенях, образуя при этом специфическую D-эндокринную систему, тесно взаимодействующую с другими гормональными сигнальными молекулами [2]. С биохимической точки зрения витамин D представлен целым семейством секостероидных гормонов, из которых для человека наибольшее значение имеют витамин D3 (холекальциферол) животного происхождения и витамин D2 (эргокальциферол) растительного происхождения [1, 2]. Безусловно, следует помнить, что в кератиноцитах кожи человека происходит эндогенный синтез витамина D3 (холекальциферола) под влиянием ультрафиолетового излучения с длиной волны 280–315 нм [1, 2].
Дефицит витамина (гормона) D – новая неинфекционная пандемия XXI в. среди взрослых и детей, проживающих севернее 35-й параллели северной широты (в зоне географической «витаминной зимы»). Подобная ситуация обусловлена резким снижением длительности пребывания на солнце современных людей и недостаточным содержанием этого витамина в продуктах питания.
С дефицитом витамина (гормона) D тесно патогенетически связаны большинство современных заболеваний, с ним ассоциируется повышенный риск общей, онкологической и сердечно-сосудистой смертности (в частности, у мужчин) независимо от возраста [3–5]. Согласно современным данным, D-гормон регулирует от 3 до 10% всего генома человека, включая гены углеводного обмена, стероидогенеза, иммунитета и репродукции, что делает его одним из ключевых полифункциональных гормонов, необходимых человеку в достаточном количестве от внутриутробного развития и далее в течение всей жизни до глубокой старости [6].
Роль витамина D в развитии предстательной железы
В эксперименте в рационе мышей-самок основной группы в течение беременности и лактации отсутствовали источники витамина D, в контрольной группе мыши-самки получали стандартный рацион, содержащий витамин D. Масса предстательной железы детенышей-самцов, появившихся у мышей первой группы, была достоверно выше таковой детенышей-самцов, родившихся у мышей второй группы. В дальнейшем содержание самцов на витамин D-дефицитном рационе продолжалось вплоть до достижения ими среднего возраста. При гистохимических исследованиях ткани предстательных желез у этих самцов обнаружено существенное увеличение количества простатических Ki-67-позитивных эпителиальных клеток – маркеров пролиферации, а также более выраженные явления воспалительной инфильтрации простатического эпителия и стромального фиброза. Кроме того, имевшийся у них дефицит витамина D активировал ядерный фактор NF-κB, мРНК гена интерлейкина 6 и простатический механизм пролиферации STAT3. Интересно, что витамин D-дефицит-индуцированное воспаление ткани предстательной железы и ее гиперплазия частично регрессировали после того, как витамин D-дефицитный рацион был заменен стандартным рационом с нормальным содержанием витамина D. Эти результаты свидетельствуют о том, что у самцов животных дефицит витамина D в молодом возрасте способствует формированию раннего воспаления и гиперплазии предстательной железы в среднем возрасте [7].
Как показало клиническое исследование D.D. Xie и соавт. (2017), уровень в сыворотке 25(OH)D был достоверно ниже у пациентов с раком простаты (n = 60) по сравнению с группой контроля (n = 120). Степень дефицита витамина D достоверно коррелировала с тяжестью заболевания: сывороточный уровень 25(OH)D у пациентов с тяжелой стадией был ниже, чем у пациентов с легкой и умеренной стадией. У всех больных раком предстательной железы уровень в сыворотке таких маркеров воспаления, как C-реактивный белок и интерлейкин 8, был повышен и отрицательно коррелировал с сывороточным уровнем 25(ОН)D. Полученные результаты свидетельствуют о связи не только между раком простаты и дефицитом витамина D, но и дефицитом витамина D и воспалительной передачей сигналов в ткани предстательной железы. При этом хроническое цитокиновое воспаление, опосредованное дефицитом витамина D, может быть важным медиатором прогрессирования заболеваний предстательной железы (в том числе рака) у мужчин с дефицитом витамина D [8].
Физиологические эффекты витамина D в отношении предстательной железы
Противовоспалительный эффект
Противовоспалительный эффект витамина D обусловлен различными механизмами, многие из которых до сих пор активно изучаются. На сегодняшний день установлена важная роль витамина D в регуляции цитокин-опосредованных клеточных и системных реакций в рамках хронического субклинического (асептического) воспаления, а также его иммуномодулирующий эффект в отношении клеточного и гуморального иммунитета. Кроме того, известна роль витамина D в обмене жирных кислот и метаболизме адипоцитов – ключевых продуцентов цитокинов (сигнальных молекул иммунной системы) [9, 10].
В опытах на животных моделях показано, что блокада простатических рецепторов к витамину D приводит к развитию экспериментального аутоиммунного хронического простатита [11, 12]. При этом агонист рецепторов витамина D (элокальцитол) ингибирует активность простатических факторов роста, а также обладает выраженным противовоспалительным эффектом, что было выявлено в экспериментальных исследованиях [13, 14].
Одним из потенциальных механизмов противовоспалительных эффектов витамина D в ткани предстательной железы может рассматриваться его доказанная способность ингибировать систему Rho-киназ (ключевую ферментную систему, способную приводить к развитию локального мышечного спазма не за счет изменения уровня кальция в миоцитах, а путем повышения их чувствительности к кальцию (кальций-независимая мышечная контрактильность)), циклооксигеназу 2, простагландин Е2 и провоспалительный интерлейкин 1 в стромальных клетках предстательной железы [15]. Кроме того, доклинические исследования показали, что гормонально активная форма витамина D (1,25(OH)2D) оказывает антипролиферативное, проапоптотическое, противовоспалительное и иммуномодулирующее действие, а ее тканевые уровни характеризуются активностью специфических гидроксилаз витамина D, экспрессируемых во многих тканях, включая ткань предстательной железы [16].
Стероидогенез-протективный эффект
Многочисленные клинико-экспериментальные исследования выявили способность витамина D регулировать экспрессию генов стероидогенеза, которая в свою очередь регулирует экспрессию генов метаболизма витамина D [17]. По этой причине некоторые авторы полагают, что дефицит тестостерона может гипотетически усиливать неблагоприятные последствия дефицита витамина D, то есть между тестостероном и витамином D существует не односторонняя, а двусторонняя патофизиологическая связь [18].
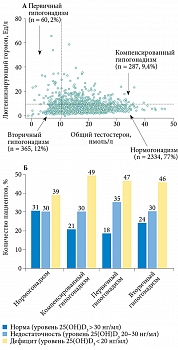
Улучшение функции клеток Лейдига под влиянием витамина D приводит к реализации целого спектра простатопротективных эффектов тестикулярного тестостерона – одного из ключевых андрогенов-предшественников основного простатического андрогена 5-альфа-дигидротестостерона. Он обеспечивает большинство функций предстательной железы, включая иммуномодулирующую, противовоспалительную и бактерицидную, а также функцию болевой рецепции и перцепции. Эта точка зрения подтверждается результатами крупномасштабного популяционного исследования с участием 3369 мужчин. Было показано, что доля мужчин, имевших адекватный статус витамина D, была самой высокой в группе нормогонадных мужчин (31%) и самой низкой среди мужчин с первичным гипогонадизмом (18%). По данным статистического анализа результатов исследования был сделан вывод, что дефицит/недостаточность витамина D (уровень 25(OH)D в крови < 20 нг/мл) ассоциировались со вторичным гипогонадизмом (относительный риск (ОР) 1,2, р = 0,05) и компенсированным гипогонадизмом (ОР 1,5, р = 0,03) у мужчин, а плазменный уровень 25(OH)D был прямо пропорционален плазменному уровню общего и свободного тестостерона и обратно пропорционален плазменному уровню эстрадиола (рис. 1) [3].
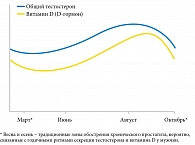
Тесная физиологическая связь витамина D и тестостерона у мужчин проявляется также в практически одинаковом характере сезонных колебаний их уровней в плазме крови в течение года [19]. В настоящее время во многих исследованиях обнаружены сезонные колебания с высоким уровнем витамина (гормона) D в крови летом и осенью и низким уровнем зимой и весной, которые в некотором смысле совпадают с аналогичными годичными циклами колебаний уровня тестостерона у мужчин [19, 20].
Так, E. Wehr и соавт. (2010) провели перекрестное исследование с участием 2299 мужчин, у которых определяли уровни 25(ОН)D, общего тестостерона и глобулина, связывающего половые стероиды, методом иммунного анализа. Кроме того, был рассчитан индекс свободных андрогенов. Согласно полученным данным, мужчины без дефицита/недостаточности витамина D (уровень 25(ОН)D в крови ≥ 30 нг/мл) имели достоверно более высокие уровень общего тестостерона и индекс свободных андрогенов и достоверно более низкий уровень глобулина, связывающего половые стероиды, в крови по сравнению с мужчинами, у кого была недостаточность витамина D (уровень 25(ОН)D в крови 20–29 нг/мл) или его дефицит (уровень 25(ОН)D в крови < 20 нг/мл) (р < 0,05 для всех показателей). При этом уровни 25(OH)D, общего тестостерона и индекс свободных андрогенов демонстрировали сезонные колебания с низшей точкой в марте (12,2 нг/мл, 15,9 нмоль/л и 40,8 соответственно) и пиком в августе (23,4 нг/мл, 18,7 нмоль/л и 49,7 соответственно, р < 0,05 для всех) [19]. На основании полученных данных была выдвинута гипотеза, согласно которой весна и осень представляются наиболее критическими для метаболизма витамина D и тестостерона сезонами в течение года у мужчин. Обмен таких важных стероидных гормонов, как витамин D и тестостерон, во многом влияет на метаболизм предстательной железы, что с учетом известных выраженных простатопротективных эффектов обоих гормонов может в определенной степени объяснить хорошо известные весенне-осенние обострения хронического простатита (рис. 2) [21, 22].
Антибактериальный эффект
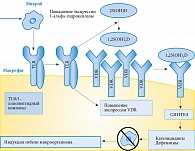
Исследования последних лет демонстрируют выраженные антибактериальные свойства витамина D [23]. Витамин D через транскрипцию генов активирует синтез собственных антимикробных пептидов (дефензина и кателицидина) иммунными клетками и эпителиалиальными клетками различных органов (рис. 3) [24].
Антипролиферативный эффект
В настоящее время активно изучается влияние витамина D на процессы простатической пролиферации [25–27]. Показано, что полиморфизм гена рецепторов витамина D коррелирует с частотой гиперплазии предстательной железы, осложненной гистологическим простатитом [28–31]. Кроме того, в одном из мультивариационных анализов установлено, что уровни 25(OH)D, альбумина, скорректированного по сывороточному кальцию, глобулина, связывающего половые стероиды, и липопротеинов высокой плотности находятся в достоверной обратной корреляции с объемом предстательной железы, что позволяет рассматривать витамин D как естественный (природный) простатический антипролиферант [32].
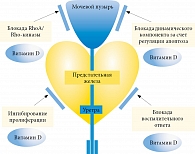
Способность витамина D снижать активность простатической 5-альфа-редуктазы (ключевого фермента запуска и прогрессирования простатической пролиферации) и контрактильной системы Rho-киназ, а также его противовоспалительное (антицитокиновое) действие на предстательную железу и нижние мочевые пути подтверждено в ряде исследований. Это позволяет рассматривать дефицит витамина D в качестве предиктора простатической гиперплазии, которая часто сочетается с явлениями хронического воспаления в ткани предстательной железы (рис. 4) [15, 25, 33–35].
Антипролиферативное влияние витамина D на ткань предстательной железы может быть дополнительно опосредовано его способностью ингибировать избыточный инсулиновый клеточный сигнал (уровень инсулина и инсулиноподобного фактора роста 1), ответственный за активацию механизмов пролиферации клеток, в том числе в предстательной железе. Хорошо известно, что инсулин – мощный митогенный гормон, поэтому длительная гиперинсулинемия (инсулинорезистентность) сопровождается повышением риска развития гиперпластических клеточно-тканевых процессов и рассматривается как один из ключевых современных механизмов канцерогенеза [36]. Устранение дефицита витамина D, по мнению некоторых исследователей, благоприятно воздействует на процессы промоции гена инсулина, стимулируя экспрессию инсулиновых рецепторов и тем самым улучшая инсулин-опосредованный внутриклеточный транспорт глюкозы [37].
Кроме того, активный метаболит 1,25(OH)2D обеспечивает активацию транскрипции гена инсулина человека [38, 39]. Витамин D регулирует внеклеточный и внутриклеточный обмен кальция, который необходим для инсулин-опосредованных внутриклеточных процессов в инсулин-зависимых тканях (скелетных мышцах, жировой ткани), а изменения уровня кальция в клетке могут иметь неблагоприятные последствия для секреции инсулина, процесс синтеза которого в свою очередь опосредован кальцием [37, 40]. Поскольку витамин D оказывает модулирующее действие на иммунную систему, то гиповитаминоз D может вызывать системный субклинический воспалительный ответ, который в свою очередь способен индуцировать инсулинорезистентность [41, 42].
В ходе иммуногистохимических исследований установлено, что в уретре рецепторов витамина D экспрессируется гораздо больше, чем в мочевом пузыре или предстательной железе. Кроме того, позитивное влияние витамина D на все указанные структуры нижних отделов урогенитального тракта может осуществляться за счет общих универсальных механизмов, например способности витамина D ингибировать синтез провоспалительных цитокинов (в частности, интерлейкина 8 и фактора некроза опухоли альфа), а также снижать активность циклооксигеназы 2 и выработку интерферона гамма локальными иммунокомпетентными клетками [43]. Поэтому перспективными фармакотерапевтическими мишенями для применения витамина D или агонистов его рецепторов при лечении хронического простатита может стать не только предстательная железа, но и уретра, а также детрузор мочевого пузыря, которые, как известно, в подавляющем большинстве случаев вовлекаются в содружественный патологический процесс [43, 44].
Нейропротективный и антиболевой эффект
В настоящее время накоплены результаты доказательных научных исследований, позволяющие говорить о выраженных нейропротективных и антиболевых эффектах витамина D.
По данным современных исследований, дефицит витамина D (уровень 25(OH)D в крови < 50 нмоль/л) имел место у 71% пациентов с хронической болью, а еще у 21% выявлена недостаточность витамина D (уровень 25(OH)D в крови < 75 нмоль/л) [45]. После поправки на демографические и клинические переменные среднее увеличение интенсивности боли составило 0,61 ± 0,25 на каждые 25 нмоль/л снижения плазменного уровня 25(OH)D (p = 0,011). Более низкий уровень 25(ОН)D также ассоциировался с большей выраженностью болевых симптомов (r = -0,21, p = 0,008). Полученные результаты свидетельствуют о важной роли низкого уровня витамина D в механизмах повышения центральной чувствительности к боли (гиперсенситизации) [45]. Вместе с тем показано, что заместительная терапия витамином D у пациентов с неспецифической скелетно-мышечной болью позволяет уменьшить выраженность болевого синдрома и депрессивных проявлений, повысить качество жизни, поэтому авторы исследования рекомендуют проводить скрининг на дефицит витамина D среди всех пациентов с этим видом хронической боли [46]. По результатам другого исследования, применение витамина D в дозе 60 000 МЕ/нед в течение восьми недель у пациентов с хронической болью в спине привело к уменьшению интенсивности боли и улучшению функциональных способностей [47].
Сегодня большой практический интерес для врачей различных специальностей, занимающихся проблемами лечения хронических болевых синдромов, представляет хроническая невропатическая боль – один из наиболее плохо диагностируемых и трудно поддающихся стандартной фармакотерапии вариантов хронической неинфекционной боли [48]. В исследовании 2018 г. обнаружено, что невропатическая боль отмечалась у пациентов с дефицитом витамина D (уровень 25(ОН)D в крови < 20 нг/мл) в 5,8 раза чаще, чем у пациентов без дефицита (уровень 25(ОН)D в крови ≥ 30 нг/мл). Это позволило авторам назвать определение уровня витамина D перспективным критерием установления хронической невропатической боли [49]. В другом исследовании выявлена достоверная корреляция между ожирением, дефицитом витамина D и выраженностью невропатической боли по шкале DN4, например при карпальных туннельных синдромах [50]. Суммируя результаты современных метаанализов, необходимо признать, что на текущий момент с учетом уровня имеющихся доказательств выраженный положительный эффект витамина D при всех видах хронической боли маловероятен. Однако он может демонстрировать анальгетическое действие при конкретных хронических болезненных состояниях, что требует проведения дальнейших исследований, в том числе в урологии [51–54].
Для урологической практики этот вопрос имеет важное научно-прикладное значение по целому ряду нерешенных аспектов [55].
Во-первых, наблюдается высокая общая частота дефицита/недостаточности витамина D у больных урологического профиля [56, 57]. Так, M.S. Pitman и соавт. (2011) проанализировали результаты обследования 3763 мужчин из урологических баз медицинских данных. Авторы пришли к выводу, что в настоящее время у 68% урологических пациентов неадекватный уровень витамина D, а у 52% из них – нераспознанные дефицит или недостаточность витамина D [57]. Чаще дефицит витамина D выявляется у лиц моложе 50 лет (44,5%), афроамериканцев (53,2%), представителей испанской национальности (41,6%) (р < 0,001). В мультивариационном анализе раса, возраст, время года или диагноз рака служили независимыми предикторами низкого статуса витамина D [57]. При этом, например, у пациентов с хроническими заболеваниями почек и уровнем 25(ОН)D в крови < 15 нг/мл риск смерти был на 33% выше, чем у больных с уровнем 25(ОН)D > 15 нг/мл [58].
Во-вторых, в настоящее время ни у кого не вызывает сомнений, что в мультифакторный патогенез синдрома хронической тазовой боли (СХТБ)/хронического простатита у мужчин вовлечены механизмы нейропластичности и хронической невропатической боли, часто сочетающиеся с депрессией, что формирует порочный патогенетический круг и существенно утяжеляет клиническое течение указанных нозологий [59–63].
В-третьих, в отечественной литературе недостаточно изучена роль дефицита витамина D в патогенезе невропатического компонента хронической боли при хронических воспалительных заболеваниях предстательной железы. Так, на важность обнаружения и коррекции невропатических механизмов хронической тазовой (простатической) боли указывают М.И. Коган и соавт. (2011). Основываясь на результатах исследований последних пяти – семи лет, они высказали предположение, что если в основе хронической боли при воспалительной форме хронического абактериального простатита лежат тканевые воспалительные факторы, то клинику при невоспалительной форме заболевания, напротив, определяют нейрогенные механизмы [64]. Такие факторы, как невропатия полового нерва с развитием хронического простатита, метаболическая невропатия с поражением нервных сплетений малого таза и предстательной железы по типу тазовых плекситов и нейровегетативные расстройства, могут носить одновременно этиологический и патогенетический характер [65–68].
По данным И.А. Тюзикова и соавт. (2011, 2012), клинические проявления невропатии (независимо от ее этиологии) оказывают негативное влияние практически на все показатели анатомо-функционального состояния предстательной железы и мышц тазового дна [69, 70]. Поэтому эффекты нейропротекции и регуляции болевой рецепции и перцепции, дополнительно опосредованные витамином D, могут оказаться в недалекой перспективе полезной и эффективной фармакотерапевтической опцией при лечении СХТБ/хронического простатита, представляющего, как известно, весьма сложную клиническую междисциплинарную проблему, ухудшающую качество жизни этой группы пациентов [71, 72].
Согласно результатам новейших российских исследований, невропатический компонент СХТБ обнаруживается с помощью валидного опросника для диагностики невропатической боли DN4 практически у каждого третьего больного. Однако адекватная фармакологическая коррекция СХТБ представляет сложную клиническую задачу для врача-уролога [73]. Как установили И.И. Можаев и соавт. (2017), стандартная терапия СХТБ практически не оказывает позитивного влияния на невропатический компонент СХТБ. Более того, в ходе длительной стандартной терапии доля невропатического компонента СХТБ может возрастать. В результате замыкается порочный круг патогенеза хронической боли, что сопровождается усилением явлений вегетативной симпатической гиперактивности, персистенцией хронического болевого синдрома, резистентного к стандартной опиоидной терапии, и существенным ухудшением качества жизни пациентов с хроническим простатитом [73]. При этом роль невропатических механизмов болевого синдрома при хроническом простатите в отечественной рутинной урологической практике явно недооценивается, поэтому невропатический компонент чаще всего остается недиагностированным и, соответственно, некорректированным [74]. Однако с учетом их существенного негативного воздействия на клинические исходы и результаты лечения хронического простатита следует активно искать выход из этой ситуации, поскольку никакие препараты, стандартно применяющиеся для лечения хронического простатита, не способны патогенетически ликвидировать невропатическую боль [75]. В этой связи управление витамин D-статусом мужчин с хроническими воспалительными заболеваниями предстательной железы в условиях высокой частоты дефицита витамина D – полифункционального стероидного гормона у россиян, живущих в зоне географической «витаминной зимы», может быть весьма эффективным дополнением к традиционной фармакотерапии любых клинических вариантов хронического простатита.
В настоящее время на российском фармацевтическом рынке появился Детримакс® Витамин D3 компании ООО «ЮНИФАРМ» – биологически активная добавка для перорального приема со сравнительно высокой для России дозировкой – 25 мкг (1000 МЕ) холекальциферола (витамина D3) в одной таблетке. Детримакс® Витамин D3 хорошо усваивается в желудочно-кишечном тракте за счет образования в среде тонкого кишечника мицеллярных соединений и обладает полноценным спектром всех физиологических эффектов витамина D, необходимых каждому человеку с момента зачатия до глубокой старости. Детримакс® Витамин D3 имеет отличительную особенность – в его составе отсутствуют аллергены, сахароза, ароматизаторы и подсластители, что крайне актуально ввиду высокой распространенности в популяции алиментарной аллергии. Детримакс® Витамин D3 содержит дозу витамина D, равную 1000 МЕ, которая абсолютно безопасна и не требует проведения рутинного лабораторного мониторинга, так как высокая безопасность витамина D в дозировке до 4000 МЕ/сут подтверждена широкомасштабными эпидемиологическими и клиническими международными исследованиями [76, 77]. В декабре 2018 г. был опубликован новый метаанализ, в который было включено 32 клинических рандомизированных исследования [78]. Согласно его результатам, длительный прием высоких доз витамина D (более 2800 МЕ/сут) не увеличивал общее количество нежелательных явлений по сравнению с плацебо у 1731 участника из десяти исследований (ОР 1,05, 95%-ный доверительный интервал (ДИ) 0,88–1,24, р = 0,61), а также камней в почках у 1336 участников из пяти исследований (ОР 1,26, 95% ДИ 0,35–4,58, р = 0,72). Однако отмечалась тенденция к увеличению риска развития гиперкальциемии у 2598 участников в десяти исследованиях (ОР 1,93, 95% ДИ 1,00–3,73, р = 0,05). В то же время его влияние на гиперкальциурию только у 276 участников из трех исследований было недостоверным (ОР 1,93; 95% ДИ 0,83–4,46, р = 0,12) [78]. Эффективность постоянного курсового приема витамина D для лечения и профилактики дефицита/недостаточности витамина D, ассоциированного с целым спектром заболеваний у детей и взрослых, в настоящее время доказана многочисленными международными исследованиями, поэтому витамин D рекомендован к приему ведущими научными сообществами мира и РФ [79, 80].
Заключение
Несмотря на пока явно недостаточное количество доказательных исследований, посвященных патофизиологической роли нарушений статуса витамина D у мужчин с воспалительными заболеваниями предстательной железы, не вызывает сомнения тот факт, что дефицит и недостаточность витамина D сегодня распространенное, но практически не диагностируемое состояние у урологических больных. Современные эпидемиологические исследования однозначно и достоверно свидетельствуют о высокой встречаемости нарушений витамин D-статуса в современной популяции в целом и у мужчин в частности. Однако в отечественной рутинной урологической практике при обследовании и лечении больных хроническим простатитом дефицит или недостаточность витамина D лабораторными методами, как правило, не выявляется и, соответственно, никак не корректируется. Между тем с позиций междисциплинарной и персонифицированной медицины практикующим урологам крайне важно иметь общее представление о биологической роли витамина D в функционировании мужской мочеполовой системы, а также четко представлять патофизиологическую основу и необходимость клинического применения препаратов, содержащих витамин D, для повышения эффективности комплексной фармакотерапии такого распространенного урологического заболевания, как хронический простатит, тем более что в современной России имеются достаточные фармацевтические ресурсы для реализации этих междисциплинарных задач.
I.A. Tyuzikov, PhD, A.V. Smirnov, L.V. Smirnova, I.V. Lesnikova
Medical Center ‘Tandem-Plus’, Yaroslavl
Medical Center ‘Argo-Premium’, Kostroma
Yaroslavl State Medical University
Contact person: Igor Adamovich Tyuzikov, phoenix-67@list.ru
Based on the results of modern evidence-based clinical and experimental studies, the review article discusses the ‘non-classical’ (extraosseous) physiological effects of vitamin D, which ensure the development and maintenance of the normal anatomical and functional state of the prostate gland. Currently, vitamin D is considered as a D-hormone, which has its own receptor apparatus in many cells and tissues (including prostate), and therefore has a range of positive physiological effects on the prostate gland (anti-inflammatory, antibacterial, antiproliferative, neuroprotective, painless effects, protective effect on steroidogenesis), allowing it to resist the cellular mechanisms of formation and progression of multidirectional chronic inflammatory reactions that constitute the essence of the pathogenesis of various forms of chronic prostatitis, including chronic infectious prostatitis and abacterial chronic pelvic pain syndrome. Given the high frequency of vitamin D deficiency in urological patients and the important physiological role of vitamin D in the prostate, it has been suggested that management of the D-status of men with chronic inflammatory diseases of the prostate gland can be considered as an appropriate diagnostic and effective pharmacotherapeutic option for this group of diseases, traditionally characterized by unsatisfactory results of standard complex therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.