количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Влияние курения на плейотропные эффекты симвастатина при лечении больных ИБС с гиперлипидемией
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" №1
- Аннотация
- Статья
- Ссылки
К настоящему времени во многих исследованиях показаны плейотропные эффекты статинов [1–5].
Статины оказывают противовоспалительное действие, о чем свидетельствует их способность снижать накопление провоспалительных соединений в атеросклеротической бляшке [6]; они ингибируют миграцию и пролиферацию гладкомышечных клеток – один из ключевых процессов атерогенеза; угнетают агрегационную активность тромбоцитов, тормозят активацию каскада свертывания и усиливают фибринолиз [7, 8], снижая, тем самым, тромбогенный потенциал сосудистой стенки; уменьшают окислительный стресс, а также улучшают функциональную активность эндотелия, способствуя, в основном, увеличению биодоступности оксида азота (NO) [9, 10].
К настоящему времени во многих исследованиях показаны плейотропные эффекты статинов [1–5].
Статины оказывают противовоспалительное действие, о чем свидетельствует их способность снижать накопление провоспалительных соединений в атеросклеротической бляшке [6]; они ингибируют миграцию и пролиферацию гладкомышечных клеток – один из ключевых процессов атерогенеза; угнетают агрегационную активность тромбоцитов, тормозят активацию каскада свертывания и усиливают фибринолиз [7, 8], снижая, тем самым, тромбогенный потенциал сосудистой стенки; уменьшают окислительный стресс, а также улучшают функциональную активность эндотелия, способствуя, в основном, увеличению биодоступности оксида азота (NO) [9, 10].

Таблица 1. Динамика уровня липидов и ЛП сыворотки крови в зависимости от статуса курения пациентов исходно, через 6 и 12 недель приема симвас
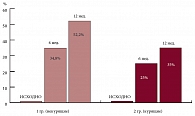
Рис. Доля пациентов, достигших целевого уровня общего ХС на фоне приема симвастатина

Таблица 2. Динамика концентрации фибриногена, активности фактора Виллебранда и фибринолиза исходно и через 12 нед. приема симвастатина (M ± SD

Таблица 3. Показатели физической работоспособности пациентов (M ± SD)
Механизмы плейотропных эффектов статинов обусловлены в основном тем, что, блокируя биосинтез мевалоновой кислоты, эти препараты, в том числе и симвастатин (что было продемонстрировано в экспериментах на животных и клеточных культурах), снижают не только образование холестерина (ХС), но и продукцию изопреноидов, играющих существенную роль в пострансляционной модификации целого ряда низкомолекулярных белков (ГТФ-связывающие, или G-белки) – регуляторов многих внутриклеточных процессов [8, 11].
Курение является самой распространенной вредной привычкой в России у мужчин, среди которых курит 63% [12]. Вклад курения в смертность от сердечно-сосудистых заболеваний (ССЗ) составляет у них 29%. В последние годы отмечается распространенность курения и среди женщин молодого возраста до 25%. Если сегодня вклад курения в смертность женщин от ССЗ составляет 2%, то в будущем можно ожидать значительного увеличения его вклада в смертность от ССЗ. Курение как фактор риска в два раза повышает риск развития ССЗ, ишемической болезни сердца (ИБС), поражений периферических артерий, хронической сердечной недостаточности, мозгового инсульта. Курение усиливает клинические проявления стенокардии и ускоряет развитие атеросклероза [13, 14].
Показано, что сам факт вдыхания табака приводит к острой (немедленной) эндотелиальной дисфункции вследствие подавления продукции NO и простациклина, а также через усиление окислительного стресса [15]. Курение запускает процесс хронического асептического воспаления в сосудистой стенке, что ускоряет развитие системного атеросклероза.
Представляется важным оценить эффективность симвастатина у больных ИБС с наличием нескольких факторов риска этого заболевания, в первую очередь курения и гиперлипидемии (ГЛП) [16]. В связи с этим актуален вопрос, имеются ли особенности гиполипидемического действия симвастатина в зависимости от статуса курения. Не меньший интерес представляет оценка существующих различий в терапии симвастатином у курящих и некурящих в отношении плейотропных эффектов, а именно показателей системы гемостаза и функциональной активности сосудистого эндотелия.
Целью настоящего исследования было сравнительное изучение влияния курения на эффективность симвастатина в отношении показателей системы гемостаза, эндотелиальной функции и липидного профиля у больных ИБС с ГЛП.
Материалы и методы
В работе представлены результаты открытого сравнительного клинического исследования. В исследование были включены 43 пациента (22 мужчин и 21 женщина) в возрасте 41–79 лет (средний возраст 59,4 ± 7,9 лет). У всех пациентов имелась документированная ИБС (инфаркт миокарда в анамнезе, либо ангиографически подтвержденная ИБС, либо положительная проба с физической нагрузкой, ФН) и ГЛП в виде изолированной гиперхолестеринемии (уровень общего ХС ≥ 5,0 ммоль/л и ХС липопротеидов низкой плотности (ЛНП) ≥ 3,0 ммоль/л) или ее сочетания с гипертриглицеридемией (уровень триглицеридов (ТГ) ≥ 1,7 ммоль/л). Критерии исключения были стандартными для проведения подобных исследований.
В зависимости от статуса курения все пациенты были разделены на 2 группы: I группа – никогда не курившие пациенты (n = 23) и II группа – активные курильщики – пациенты, имеющие в анамнезе более 5 лет табакокурения более 1 пачки сигарет в сутки (n = 20). Пациенты обеих групп были сопоставимы по полу, возрасту, антропометрическим показателям, показателям спектра липопротеидов (ЛП) плазмы крови. Все больные с ГЛП в течение 12 нед. принимали симвастатин в дозе 40 мг/сут на фоне гиполипидемической диеты [17].
Физикальное обследование включало: осмотр, измерение уровней артериального давления (АД), частоты сердечных сокращений (ЧСС), определение массы тела (кг), роста (см) и расчет индекса массы тела (ИМТ), а также наблюдение за состоянием и клиническими событиями, связанными с лечением.
Больным проводили пробу с ФН на велоэргометре (ВЭМ-проба) на фоне предварительной 48-часовой отмены препаратов, влияющих на ишемию миокарда (за исключением таблеток нитроглицерина по показаниям) на аппарате Shiller АТ-60 (Швейцария) в положении пациента сидя со скоростью вращения педалей 60 об/мин по методике ступенчатой непрерывно возрастающей нагрузки. При проведении ВЭМ-пробы после 12-недельного курса терапии статином в случае отсутствия критериев ее прекращения ВЭМ-пробу выполняли до достижения такой же ЧСС, как и до начала лечения. Оценивали максимальную мощность ФН, показатели max систолического артериального давления (САД) и диастолического АД (ДАД), max ЧСС, двойного произведения (ДП) [(исходное САД х исходная ЧСС)/100], max ДП [(max САД х max ЧСС)/100], индекс экономичности (ИЭ) (ДП/пороговая мощность), max потребление кислорода, выраженное в метаболических единицах (МЕ) [МЕ = (90 + 3,44 х пороговая мощность) / вес в кг ].
Эндотелий-зависимую вазодилатацию (ЭЗВД) изучали с помощью пробы с реактивной гиперемией с применением ультразвука высокого разрешения, согласно описанной методике [18] и протоколу Международной рабочей группы [19]. За 4–6 ч до начала исследования пациентам рекомендовали не курить, не заниматься спортом, не употреблять кофеин. Непосредственно перед исследованием пациент отдыхал лежа не менее 10 мин. Измерения диаметра правой плечевой артерии проводили с помощью линейного датчика 7 МГц с фазированной решеткой ультразвуковой системы «Acusson 128 Х Р10» (США). Плечевую артерию лоцировали в продольном сечении на 2–15 см выше локтевого сгиба. Результаты оценивали по исходному диаметру плечевой артерии, величине абсолютного прироста ее диаметра и проценту прироста ЭЗВД к исходному размеру.
Забор крови осуществляли из локтевой вены утром натощак у не куривших в этот день больных. Липидный спектр определяли в сыворотке, которую получали путем центрифугирования крови в течение 20 мин при 2500 об/мин и температуре 4° С. Концентрацию общего ХС и ТГ измеряли на автоанализаторе «Sapphire-400» с помощью ферментативных наборов «Human». Содержание ХС липопротеидов высокой плотности (ЛВП) определяли на том же автоанализаторе после осаждения аполипопротеинов (апо) В-содержащих ЛП фосфорновольфраматом Na с 0,5 М раствором MgCl2. Содержание ХС ЛНП рассчитывали по формуле Фридвальда. Уровень ХС не-ЛВП рассчитывали как разность между содержанием общего ХС и ХС ЛВП [20].
Параметры системы гемостаза определяли в цитратной плазме, которую получали из крови, взятой в пробирку с 3,8% раствором лимоннокислого Na. Уровень фибриногена оценивали с помощью метода Клаусса по скорости образования кровяного сгустка после добавления тромбина. Об активности фактора Виллебранда судили по скорости агрегации стандартной взвеси тромбоцитов человека под действием ристомицина в присутствии плазмы обследуемого пациента. Измерения осуществляли на анализаторе агрегации 220LA (НПФ «Биола», Россия) с применением программного обеспечения AGGR. Для построения стандартной кривой использовали не содержащую тромбоциты обедненную донорскую плазму. Фибринолитическую активность оценивали по времени спонтанного лизиса сгустка, образованного эуглобулиновой фракцией (ВЛСЭФ) плазмы крови в ответ на добавление CaCl2.
Стандартизацию и контроль качества анализа биохимических параметров проводили в соответствии с требованиями федеральной системы внешней оценки качества исследований (ФСВОК).
Статистическую обработку результатов проводили с помощью пакетов статистических программ SPSS 14.0 и STATISTICA 6.0. Для каждой из непрерывных величин приведены: среднее (M) и стандартное отклонение (SD) или медиана (Ме) и нижняя (25%) и верхняя (75%) квартили в зависимости от типа распределения. Достоверность отличий между двумя группами проверяли с помощью t-критерия Стьюдента или непараметрического U-критерия Манна–Уитни. При парных сравнениях уровней показателей внутри групп исходно и через 12 недель после лечения применяли парный критерий Bилкоксона. Уровнем статистической значимости считали р < 0,05.
Результаты и обсуждение
Сравнительный анализ гиполипидемического действия симвастатина у курящих и некурящих больных ИБС с ГЛП показал, что влияние препарата более динамично развивается в первые 6 недель терапии. Как видно из таблицы 1, в группе некурящих пациентов через 6 недель приема препарата концентрация общего ХС в сыворотке крови достоверно снизилась на 30,7% от исходного уровня; в то же время у курящих пациентов в первые 6 недель концентрация общего ХС хотя и снизилась достоверно на 22,2%, но снижение оказалось менее выраженным, чем у некурящих (с тенденцией к достоверности между группами р = 0,06). К концу 12 нед. лечения симвастатином уровень общего ХС в группе некурящих пациентов по сравнению с 6 нед. практически не изменялся, тогда как в группе курильщиков наблюдалось достоверное дополнительное снижение этого показателя на 7,9% (р = 0,046).
Результаты, представленные в таблице 1, демонстрируют также достоверное снижение концентрации ТГ в группе некурящих пациентов через 12 нед. с 1,51 до 0,92 ммоль/л (Ме) (р = 0,028); причем в первые 6 нед. имело место более выраженное и достоверное снижение уровня ТГ (р = 0,045) по сравнению с последующими 6 нед. (р = 0,74). В группе курящих пациентов уровень ТГ через 6 нед. приема симвастатина практически не снизился и лишь через 12 нед. изменения достигли статистической значимости: медиана уровня ТГ составила 1,41 ммоль/л по сравнению с исходным значением 1,9 ммоль/л (р = 0,03).
Сравнение зависимости липидснижающей эффективности симвастатина от наличия мощного фактора риска – курения – показало, что целевых значений по уровню общего ХС достигли 34,8% и 52,2% некурящих и 25,0% и 35,0% курящих пациентов через 6 и 12 недель соответственно, с тенденцией к достоверно более выраженному снижению уровня ХС атерогенных ЛП у некурящих (см. рис.).
В первые 6 нед. лечения в группе некурящих пациентов целевых значений ТГ (< 1,7 ммоль/л) достигло 87% пациентов, тогда как в группе курильщиков только 50% (р < 0,05). Через 12 нед. приема генерика симвастатина сохраняется статистически значимое различие по количеству пациентов, достигших целевого уровня по ТГ между группами некурящих и курящих пациентов – 87% и 55% соответственно (p < 0,04).
Таким образом, курение несколько препятствует развитию гиполипидемического эффекта симвастатина; по результатам 6- и 12-недельного приема препарата отмечено более выраженное его положительное действие на липидный профиль некурящих пациентов. Об этом свидетельствует процент снижения содержания липидов и большее число некурящих пациентов, достигших целевого уровня общего ХС, на фоне отсутствия достоверных изменений концентрации ТГ в первые 6 нед. приема препарата в группе курильщиков. Однако разница между значениями общего ХС, ХС ЛНП, ХС не-ЛВП, в группах курящих и некурящих с течением времени сокращается, и курильщики как бы «нагоняют» значениями некурящих пациентов.
Проблема коррекции гиперкоагуляции и снижения фибринолиза у больных ИБС не менее актуальна, чем достижение у них адекватного контроля уровня липидов. В связи с этим одной из основных задач исследования был анализ влияния симвастатина на показатели системы гемостаза в зависимости от статуса курения пациента.
Пациенты обеих групп исходно не различались по показателям параметров системы гемостаза: уровню в плазме крови фибриногена, активности фактора Виллебранда и фибринолитической активности (табл. 2). На фоне 12-недельной терапии симвастатином отмечено достоверное снижение уровня фибриногена как у некурящих пациентов (I группа) на 24,1 ± 24,2% (р = 0,001), так и у курильщиков (II группа) на 39,5 ± 34,5% (р = 0,0003). Хотя у курящих пациентов эти изменения были более выраженными, различия между группами не достигли статистической достоверности.
Литературные данные о влиянии статинов на систему гемостаза носят противоречивый характер. Так, в одних контролируемых клинических исследованиях с использованием статинов показано, что эти препараты практически не влияют на уровень фибриногена [1, 21]. В то же время опубликованы работы, свидетельствующие об эффективности статинов в отношении снижения уровней фибриногена [22]. В настоящем исследовании для симвастатина, принимаемого в дозе 40 мг/сут, показан один из плейотропных эффектов в виде снижения уровня фибриногена, избыток которого сопряжен с гиперкоагуляцией; обнаруженный эффект не зависел от статуса курения.
Увеличение в плазме крови активности фактора Виллебранда, продуцируемого, в основном, клетками эндотелия, служит свидетельством нарушения их функциональной активности, или дисфункции эндотелия. Так, было показало, что у больных ИБС с ГЛП IIа и IIб типов активность фактора Виллебранда достоверно выше, чем у больных ИБС с нормальным уровнем липидов. Кроме того, отмечалась тенденция к повышению в плазме крови активности фактора Виллебранда у курильщиков по сравнению с некурящими [23]. При оценке активности фактора Виллебранда у всей когорты пациентов после 12 нед. приема препарата выявлена достоверная динамика снижения активности на 18,8% (р = 0,005). Однако анализ по группам в зависимости от статуса курения показал, что это снижение обусловлено изменениями активности фактора Виллебранда, в основном, за счет группы некурящих пациентов, где изменения носили достоверный характер, тогда как у курильщиков активность фактора Виллебранда хотя и несколько снижалась, но не достигала статистической значимости (табл. 2).
Возможно, наличие дополнительного фактора риска – курения, негативно влияющего на целостность эндотелиального монослоя сосудистой стенки и способствующего выбросу в кровь избыточных количеств фактора Виллебранда в сочетании с его повышенной активностью, стало препятствием для полноценной положительной динамики этого показателя у курящих пациентов. Вместе с тем, учитывая некоторую его динамику (снижение на 11%), нельзя исключить и более медленное развитие отдельных плейотропных эффектов симвастатина у курящих пациентов, которое, возможно, достигнет достоверности при более длительном лечении. Таким образом, снижение активности фактора Виллебранда у некурящих можно отнести к положительным плейотропным эффектам препарата.
При анализе времени лизиса кровяного сгустка, образованного эуглобулиновой фракцией крови (ВЛСЭФ) как показателя активности фибринолиза в группе некурящих пациентов была обнаружена тенденция в сторону сокращения времени лизиса сгустка, свидетельствующая об активации процесса фибринолиза (табл. 2). В то же время в результате терапии симвастатином изменений фибринолитической активности в группе курящих пациентов не отмечалось. Вероятно, наличие курения как дополнительного фактора риска стало препятствием для реализации плейотропного эффекта симвастатина в отношении фибринолитической активности.
С целью оценки влияния симвастатина на функциональное состояние сердечно-сосудистой системы в данном исследовании пациентам обеих групп проведены манжеточная (ЭЗВД) и ВЭМ-проба. С помощью непараметрического парного критерия Вилкоксона у некурящих пациентов выявлено статистически значимое нарастание диаметра плечевой артерии во время проведения манжеточной пробы как до лечения (на 4,1%, p = 0,006), так и через 12 недель терапии симвастатином (на 4,8%, p = 0,0006). Иными словами, у некурящих больных ИБС с ГЛП в результате лечения имело место умеренное улучшение ЭЗВД. В группе курящих до лечения имелась лишь тенденция к увеличению диаметра плечевой артерии при проведении манжеточной пробы, однако терапия симвастатином сопровождалось выраженным, практически двукратным, увеличением ЭЗВД (на 9,2%, p = 0,001).
Спустя 12 нед. лечения в группе некурящих пациентов зафиксировано достоверное увеличение (на 4%) max ЧСС, достигнутой при ВЭМ-пробе (р < 0,04). В этой же группе отмечена тенденция к увеличению max мощности выполненной ФН и max ДП, что свидетельствует о некотором увеличении физической работоспособности больных (табл. 3).
В группе курящих пациентов достоверно значимых изменений показателей физической работоспособности не выявлено, но отмечена тенденция к увеличению мах. мощности выполненной ФН (на 12%), max САД (на 6%) и max потребления кислорода миокардом (на 9%), основного показателя аэробных возможностей организма, выраженного в МЕ.
Результаты, полученные при проведении пробы с ФН, продемонстрировали увеличение физической работоспособности и возрастание аэробных возможностей организма, о чем свидетельствует увеличение таких показателей, как max мощность, max ЧСС, max САД, величины ДП и показателя max потребления кислорода миокардом (МЕ). Иными словами, вне зависимости от статуса курения пациента лечение его симвастатином сопровождалась повышением толерантности к ФН уже через 12 нед., а в группе курильщиков наметилась положительная тенденция к увеличению максимального потребления кислорода.
Заключение
Таким образом, в результате проведенного исследования у больных ИБС с ГЛП с разным статусом курения выявлена определенная специфика действия симвастатина: независимое от статуса курения снижение уровня фибриногена и улучшение ЭЗВД, замедленный гиполипидемический эффект и неэффективность влияния препарата на активность фактора Виллебранда и фибринолиз у курильщиков. Полученные результаты комплексной оценки гиполипидемического и ряда нелипидных эффектов симвастатина дают основание ожидать несколько отсроченное во времени наступление эффекта препарата у курящих пациентов. Это может служить обоснованием необходимости титрования дозы препарата при не достижении целевого уровня общего ХС и/или ТГ не ранее, чем через 12 нед. терапии.
Симвастатин в дозе 40 мг/сут целесообразно использовать у больных ИБС с ГЛП с целью одновременной коррекции повышенного уровня общего ХС и ТГ крови, нарушений свертывающей системы и фибринолиза, а также улучшения показателей физической работоспособности.
Курение является самой распространенной вредной привычкой в России у мужчин, среди которых курит 63% [12]. Вклад курения в смертность от сердечно-сосудистых заболеваний (ССЗ) составляет у них 29%. В последние годы отмечается распространенность курения и среди женщин молодого возраста до 25%. Если сегодня вклад курения в смертность женщин от ССЗ составляет 2%, то в будущем можно ожидать значительного увеличения его вклада в смертность от ССЗ. Курение как фактор риска в два раза повышает риск развития ССЗ, ишемической болезни сердца (ИБС), поражений периферических артерий, хронической сердечной недостаточности, мозгового инсульта. Курение усиливает клинические проявления стенокардии и ускоряет развитие атеросклероза [13, 14].
Показано, что сам факт вдыхания табака приводит к острой (немедленной) эндотелиальной дисфункции вследствие подавления продукции NO и простациклина, а также через усиление окислительного стресса [15]. Курение запускает процесс хронического асептического воспаления в сосудистой стенке, что ускоряет развитие системного атеросклероза.
Представляется важным оценить эффективность симвастатина у больных ИБС с наличием нескольких факторов риска этого заболевания, в первую очередь курения и гиперлипидемии (ГЛП) [16]. В связи с этим актуален вопрос, имеются ли особенности гиполипидемического действия симвастатина в зависимости от статуса курения. Не меньший интерес представляет оценка существующих различий в терапии симвастатином у курящих и некурящих в отношении плейотропных эффектов, а именно показателей системы гемостаза и функциональной активности сосудистого эндотелия.
Целью настоящего исследования было сравнительное изучение влияния курения на эффективность симвастатина в отношении показателей системы гемостаза, эндотелиальной функции и липидного профиля у больных ИБС с ГЛП.
Материалы и методы
В работе представлены результаты открытого сравнительного клинического исследования. В исследование были включены 43 пациента (22 мужчин и 21 женщина) в возрасте 41–79 лет (средний возраст 59,4 ± 7,9 лет). У всех пациентов имелась документированная ИБС (инфаркт миокарда в анамнезе, либо ангиографически подтвержденная ИБС, либо положительная проба с физической нагрузкой, ФН) и ГЛП в виде изолированной гиперхолестеринемии (уровень общего ХС ≥ 5,0 ммоль/л и ХС липопротеидов низкой плотности (ЛНП) ≥ 3,0 ммоль/л) или ее сочетания с гипертриглицеридемией (уровень триглицеридов (ТГ) ≥ 1,7 ммоль/л). Критерии исключения были стандартными для проведения подобных исследований.
В зависимости от статуса курения все пациенты были разделены на 2 группы: I группа – никогда не курившие пациенты (n = 23) и II группа – активные курильщики – пациенты, имеющие в анамнезе более 5 лет табакокурения более 1 пачки сигарет в сутки (n = 20). Пациенты обеих групп были сопоставимы по полу, возрасту, антропометрическим показателям, показателям спектра липопротеидов (ЛП) плазмы крови. Все больные с ГЛП в течение 12 нед. принимали симвастатин в дозе 40 мг/сут на фоне гиполипидемической диеты [17].
Физикальное обследование включало: осмотр, измерение уровней артериального давления (АД), частоты сердечных сокращений (ЧСС), определение массы тела (кг), роста (см) и расчет индекса массы тела (ИМТ), а также наблюдение за состоянием и клиническими событиями, связанными с лечением.
Больным проводили пробу с ФН на велоэргометре (ВЭМ-проба) на фоне предварительной 48-часовой отмены препаратов, влияющих на ишемию миокарда (за исключением таблеток нитроглицерина по показаниям) на аппарате Shiller АТ-60 (Швейцария) в положении пациента сидя со скоростью вращения педалей 60 об/мин по методике ступенчатой непрерывно возрастающей нагрузки. При проведении ВЭМ-пробы после 12-недельного курса терапии статином в случае отсутствия критериев ее прекращения ВЭМ-пробу выполняли до достижения такой же ЧСС, как и до начала лечения. Оценивали максимальную мощность ФН, показатели max систолического артериального давления (САД) и диастолического АД (ДАД), max ЧСС, двойного произведения (ДП) [(исходное САД х исходная ЧСС)/100], max ДП [(max САД х max ЧСС)/100], индекс экономичности (ИЭ) (ДП/пороговая мощность), max потребление кислорода, выраженное в метаболических единицах (МЕ) [МЕ = (90 + 3,44 х пороговая мощность) / вес в кг ].
Эндотелий-зависимую вазодилатацию (ЭЗВД) изучали с помощью пробы с реактивной гиперемией с применением ультразвука высокого разрешения, согласно описанной методике [18] и протоколу Международной рабочей группы [19]. За 4–6 ч до начала исследования пациентам рекомендовали не курить, не заниматься спортом, не употреблять кофеин. Непосредственно перед исследованием пациент отдыхал лежа не менее 10 мин. Измерения диаметра правой плечевой артерии проводили с помощью линейного датчика 7 МГц с фазированной решеткой ультразвуковой системы «Acusson 128 Х Р10» (США). Плечевую артерию лоцировали в продольном сечении на 2–15 см выше локтевого сгиба. Результаты оценивали по исходному диаметру плечевой артерии, величине абсолютного прироста ее диаметра и проценту прироста ЭЗВД к исходному размеру.
Забор крови осуществляли из локтевой вены утром натощак у не куривших в этот день больных. Липидный спектр определяли в сыворотке, которую получали путем центрифугирования крови в течение 20 мин при 2500 об/мин и температуре 4° С. Концентрацию общего ХС и ТГ измеряли на автоанализаторе «Sapphire-400» с помощью ферментативных наборов «Human». Содержание ХС липопротеидов высокой плотности (ЛВП) определяли на том же автоанализаторе после осаждения аполипопротеинов (апо) В-содержащих ЛП фосфорновольфраматом Na с 0,5 М раствором MgCl2. Содержание ХС ЛНП рассчитывали по формуле Фридвальда. Уровень ХС не-ЛВП рассчитывали как разность между содержанием общего ХС и ХС ЛВП [20].
Параметры системы гемостаза определяли в цитратной плазме, которую получали из крови, взятой в пробирку с 3,8% раствором лимоннокислого Na. Уровень фибриногена оценивали с помощью метода Клаусса по скорости образования кровяного сгустка после добавления тромбина. Об активности фактора Виллебранда судили по скорости агрегации стандартной взвеси тромбоцитов человека под действием ристомицина в присутствии плазмы обследуемого пациента. Измерения осуществляли на анализаторе агрегации 220LA (НПФ «Биола», Россия) с применением программного обеспечения AGGR. Для построения стандартной кривой использовали не содержащую тромбоциты обедненную донорскую плазму. Фибринолитическую активность оценивали по времени спонтанного лизиса сгустка, образованного эуглобулиновой фракцией (ВЛСЭФ) плазмы крови в ответ на добавление CaCl2.
Стандартизацию и контроль качества анализа биохимических параметров проводили в соответствии с требованиями федеральной системы внешней оценки качества исследований (ФСВОК).
Статистическую обработку результатов проводили с помощью пакетов статистических программ SPSS 14.0 и STATISTICA 6.0. Для каждой из непрерывных величин приведены: среднее (M) и стандартное отклонение (SD) или медиана (Ме) и нижняя (25%) и верхняя (75%) квартили в зависимости от типа распределения. Достоверность отличий между двумя группами проверяли с помощью t-критерия Стьюдента или непараметрического U-критерия Манна–Уитни. При парных сравнениях уровней показателей внутри групп исходно и через 12 недель после лечения применяли парный критерий Bилкоксона. Уровнем статистической значимости считали р < 0,05.
Результаты и обсуждение
Сравнительный анализ гиполипидемического действия симвастатина у курящих и некурящих больных ИБС с ГЛП показал, что влияние препарата более динамично развивается в первые 6 недель терапии. Как видно из таблицы 1, в группе некурящих пациентов через 6 недель приема препарата концентрация общего ХС в сыворотке крови достоверно снизилась на 30,7% от исходного уровня; в то же время у курящих пациентов в первые 6 недель концентрация общего ХС хотя и снизилась достоверно на 22,2%, но снижение оказалось менее выраженным, чем у некурящих (с тенденцией к достоверности между группами р = 0,06). К концу 12 нед. лечения симвастатином уровень общего ХС в группе некурящих пациентов по сравнению с 6 нед. практически не изменялся, тогда как в группе курильщиков наблюдалось достоверное дополнительное снижение этого показателя на 7,9% (р = 0,046).
Результаты, представленные в таблице 1, демонстрируют также достоверное снижение концентрации ТГ в группе некурящих пациентов через 12 нед. с 1,51 до 0,92 ммоль/л (Ме) (р = 0,028); причем в первые 6 нед. имело место более выраженное и достоверное снижение уровня ТГ (р = 0,045) по сравнению с последующими 6 нед. (р = 0,74). В группе курящих пациентов уровень ТГ через 6 нед. приема симвастатина практически не снизился и лишь через 12 нед. изменения достигли статистической значимости: медиана уровня ТГ составила 1,41 ммоль/л по сравнению с исходным значением 1,9 ммоль/л (р = 0,03).
Сравнение зависимости липидснижающей эффективности симвастатина от наличия мощного фактора риска – курения – показало, что целевых значений по уровню общего ХС достигли 34,8% и 52,2% некурящих и 25,0% и 35,0% курящих пациентов через 6 и 12 недель соответственно, с тенденцией к достоверно более выраженному снижению уровня ХС атерогенных ЛП у некурящих (см. рис.).
В первые 6 нед. лечения в группе некурящих пациентов целевых значений ТГ (< 1,7 ммоль/л) достигло 87% пациентов, тогда как в группе курильщиков только 50% (р < 0,05). Через 12 нед. приема генерика симвастатина сохраняется статистически значимое различие по количеству пациентов, достигших целевого уровня по ТГ между группами некурящих и курящих пациентов – 87% и 55% соответственно (p < 0,04).
Таким образом, курение несколько препятствует развитию гиполипидемического эффекта симвастатина; по результатам 6- и 12-недельного приема препарата отмечено более выраженное его положительное действие на липидный профиль некурящих пациентов. Об этом свидетельствует процент снижения содержания липидов и большее число некурящих пациентов, достигших целевого уровня общего ХС, на фоне отсутствия достоверных изменений концентрации ТГ в первые 6 нед. приема препарата в группе курильщиков. Однако разница между значениями общего ХС, ХС ЛНП, ХС не-ЛВП, в группах курящих и некурящих с течением времени сокращается, и курильщики как бы «нагоняют» значениями некурящих пациентов.
Проблема коррекции гиперкоагуляции и снижения фибринолиза у больных ИБС не менее актуальна, чем достижение у них адекватного контроля уровня липидов. В связи с этим одной из основных задач исследования был анализ влияния симвастатина на показатели системы гемостаза в зависимости от статуса курения пациента.
Пациенты обеих групп исходно не различались по показателям параметров системы гемостаза: уровню в плазме крови фибриногена, активности фактора Виллебранда и фибринолитической активности (табл. 2). На фоне 12-недельной терапии симвастатином отмечено достоверное снижение уровня фибриногена как у некурящих пациентов (I группа) на 24,1 ± 24,2% (р = 0,001), так и у курильщиков (II группа) на 39,5 ± 34,5% (р = 0,0003). Хотя у курящих пациентов эти изменения были более выраженными, различия между группами не достигли статистической достоверности.
Литературные данные о влиянии статинов на систему гемостаза носят противоречивый характер. Так, в одних контролируемых клинических исследованиях с использованием статинов показано, что эти препараты практически не влияют на уровень фибриногена [1, 21]. В то же время опубликованы работы, свидетельствующие об эффективности статинов в отношении снижения уровней фибриногена [22]. В настоящем исследовании для симвастатина, принимаемого в дозе 40 мг/сут, показан один из плейотропных эффектов в виде снижения уровня фибриногена, избыток которого сопряжен с гиперкоагуляцией; обнаруженный эффект не зависел от статуса курения.
Увеличение в плазме крови активности фактора Виллебранда, продуцируемого, в основном, клетками эндотелия, служит свидетельством нарушения их функциональной активности, или дисфункции эндотелия. Так, было показало, что у больных ИБС с ГЛП IIа и IIб типов активность фактора Виллебранда достоверно выше, чем у больных ИБС с нормальным уровнем липидов. Кроме того, отмечалась тенденция к повышению в плазме крови активности фактора Виллебранда у курильщиков по сравнению с некурящими [23]. При оценке активности фактора Виллебранда у всей когорты пациентов после 12 нед. приема препарата выявлена достоверная динамика снижения активности на 18,8% (р = 0,005). Однако анализ по группам в зависимости от статуса курения показал, что это снижение обусловлено изменениями активности фактора Виллебранда, в основном, за счет группы некурящих пациентов, где изменения носили достоверный характер, тогда как у курильщиков активность фактора Виллебранда хотя и несколько снижалась, но не достигала статистической значимости (табл. 2).
Возможно, наличие дополнительного фактора риска – курения, негативно влияющего на целостность эндотелиального монослоя сосудистой стенки и способствующего выбросу в кровь избыточных количеств фактора Виллебранда в сочетании с его повышенной активностью, стало препятствием для полноценной положительной динамики этого показателя у курящих пациентов. Вместе с тем, учитывая некоторую его динамику (снижение на 11%), нельзя исключить и более медленное развитие отдельных плейотропных эффектов симвастатина у курящих пациентов, которое, возможно, достигнет достоверности при более длительном лечении. Таким образом, снижение активности фактора Виллебранда у некурящих можно отнести к положительным плейотропным эффектам препарата.
При анализе времени лизиса кровяного сгустка, образованного эуглобулиновой фракцией крови (ВЛСЭФ) как показателя активности фибринолиза в группе некурящих пациентов была обнаружена тенденция в сторону сокращения времени лизиса сгустка, свидетельствующая об активации процесса фибринолиза (табл. 2). В то же время в результате терапии симвастатином изменений фибринолитической активности в группе курящих пациентов не отмечалось. Вероятно, наличие курения как дополнительного фактора риска стало препятствием для реализации плейотропного эффекта симвастатина в отношении фибринолитической активности.
С целью оценки влияния симвастатина на функциональное состояние сердечно-сосудистой системы в данном исследовании пациентам обеих групп проведены манжеточная (ЭЗВД) и ВЭМ-проба. С помощью непараметрического парного критерия Вилкоксона у некурящих пациентов выявлено статистически значимое нарастание диаметра плечевой артерии во время проведения манжеточной пробы как до лечения (на 4,1%, p = 0,006), так и через 12 недель терапии симвастатином (на 4,8%, p = 0,0006). Иными словами, у некурящих больных ИБС с ГЛП в результате лечения имело место умеренное улучшение ЭЗВД. В группе курящих до лечения имелась лишь тенденция к увеличению диаметра плечевой артерии при проведении манжеточной пробы, однако терапия симвастатином сопровождалось выраженным, практически двукратным, увеличением ЭЗВД (на 9,2%, p = 0,001).
Спустя 12 нед. лечения в группе некурящих пациентов зафиксировано достоверное увеличение (на 4%) max ЧСС, достигнутой при ВЭМ-пробе (р < 0,04). В этой же группе отмечена тенденция к увеличению max мощности выполненной ФН и max ДП, что свидетельствует о некотором увеличении физической работоспособности больных (табл. 3).
В группе курящих пациентов достоверно значимых изменений показателей физической работоспособности не выявлено, но отмечена тенденция к увеличению мах. мощности выполненной ФН (на 12%), max САД (на 6%) и max потребления кислорода миокардом (на 9%), основного показателя аэробных возможностей организма, выраженного в МЕ.
Результаты, полученные при проведении пробы с ФН, продемонстрировали увеличение физической работоспособности и возрастание аэробных возможностей организма, о чем свидетельствует увеличение таких показателей, как max мощность, max ЧСС, max САД, величины ДП и показателя max потребления кислорода миокардом (МЕ). Иными словами, вне зависимости от статуса курения пациента лечение его симвастатином сопровождалась повышением толерантности к ФН уже через 12 нед., а в группе курильщиков наметилась положительная тенденция к увеличению максимального потребления кислорода.
Заключение
Таким образом, в результате проведенного исследования у больных ИБС с ГЛП с разным статусом курения выявлена определенная специфика действия симвастатина: независимое от статуса курения снижение уровня фибриногена и улучшение ЭЗВД, замедленный гиполипидемический эффект и неэффективность влияния препарата на активность фактора Виллебранда и фибринолиз у курильщиков. Полученные результаты комплексной оценки гиполипидемического и ряда нелипидных эффектов симвастатина дают основание ожидать несколько отсроченное во времени наступление эффекта препарата у курящих пациентов. Это может служить обоснованием необходимости титрования дозы препарата при не достижении целевого уровня общего ХС и/или ТГ не ранее, чем через 12 нед. терапии.
Симвастатин в дозе 40 мг/сут целесообразно использовать у больных ИБС с ГЛП с целью одновременной коррекции повышенного уровня общего ХС и ТГ крови, нарушений свертывающей системы и фибринолиза, а также улучшения показателей физической работоспособности.
1. Сусеков А.В. Эффект статинов на нелипидные маркеры ишемической болезни сердца: С-реактивный белок и фибриноген. Атмосфера-Кардиология. 2003; 4: 21–24.
2. Задионченко В.С., Шехян Г.Г., Ялымов А.А. Место статинов в терапии больных ишемической болезнью сердца. Русский медицинский журнал. 2004; 12 (9): 513–518.
3. Halcox J.P., Deanfield J.E. Beyond the laboratory: clinical implications for statin pleiotropy. Circulation. 2004; 109: 1142–1148.
4. Liao J.K. Clinical implications for statin pleiotropy. Curr Opin Lipidol. 2005; 16: 624–629.
5. Sorrentino S., Landmesser U. Nonlipid-lowering effects of statins. Curr Treat Options Cardiovasc Med. 2005; 7 (6): 459–466.
6. Albert M.A., Danielson E., Rifai N., Ridker P.M. Effect of statin therapy on C-reactive protein levels: the pravastatin inflammation/CRP evaluation (PRINCE): a randomized trial and cohort study. JAMA. 2001; 286: 64–70.
7. Folsom A.R. Hemostatic risk factors for atherothrombotic disease: An epidemiologic view. Thromb Haemost. 2001; 86: 366–373.
8. Sadowitz B., Maier K.G., Gahtan V. Basic science review: statin therapy-Part I: The pleiotropic effects of statins in cardiovascular disease. Vasc Endovascular Surg. 2010; 44 (4): 241–251.
9. Mason R.P., Walter M.F., Day C.A., Jacob R.F. Intermolecular differences of 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors contribute to distinct pharmacologic and pleiotropic actions. Am J Cardiol. 2005; 96 (Suppl): 11–23.
10. Tousoulis D., Antoniades C., Koumallos N. et al. Novel therapies targeting vascular endothelium. Endothelium. 2006; 13(6): 411–21.
11. Liao J.K., Seto M., Noma K. Rho kinase (ROCK) inhibitors. J Cardiovasc Pharmacol. 2007; 50(1): 17–24.
12. Шальнова С.А., Деев А.Д., Оганов Р.Г. Распространенность курения в России. Результаты обследования представительной национальной выборки населения. Профил. забол. и укреп. здор. 1998; 3: 9–12.
13. Celermajer D.S., Sorensen K.E., Georgakopoulos D. et al. Cigarette smoking is associated with dose-related and potentially reversible impairment of endothelium-dependent arterial dilation in in healthy young adults. Circulation 1993; 88: 2149–2155.
14. Linhtlen P.R., Nikutta P., Jost S. et al. Anatomical progression of coronary artery disease in humans as by prospective, repeated, quantitated coronary angiography: Relation to clinical events and risk factors. Circulation. 1992; 86: 828–838.
15. Celermajer D.S., Adams M.S., Clarkson P. et al. Passive smoking and impaired endothelium-dependent arterial dilation in healthy young adults. N Engl Med. 1996; 334: 150–154.
16. Nakamura K., Barzi F., Huxley R. Does cigarette smoking exacerbate the effect of total cholesterol and high-density lipoprotein cholesterol on the risk of cardiovascular diseases? Heart. 2009; 95: 909–916.
17. American Heart Association. AHA dietary guidelines: revision 2000. Circulation. 2000, 102: 2284–2299.
18. Celermajer D.S., Sorensen K.E., Gooch V.M. et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet. 1992; 340: 1111–1115.
19. Corretti M.C., Andersen T.J., Benjamin E.J. et al. Guidelines for the ultrasound assessment of endothelial-dependent flow-mediated vasodilatation of the brachial artery. A report of the international brachial artery reactivity task force. J Am Coll Cardiol. 2002; 39 (2): 257–265.
20. Pischon T., Girman C., Sacks F.M. et al. Non-high-density lipoprotein cholesterol and apolipoprptein B in the prediction of coronary heart disease in men. Circulation. 2005; 112: 3375–3379.
21. Rosenson R.S., Tangney C.C., Schaefer E.J. Comparative study of HMG-CoA reductase inhibitors on fibrinogen. Atherosclerosis. 2001; 155: 463–466.
22. White C.M. Pharmacological effects of HMG CoA reductase inhibitors other than lipoprotein modulation. J Clin Pharmacol. 1999; 39: 111–118.
23. Лутай М.И., Голикова И.П., Деяк С.И. и др. Взаимосвязь фактора Виллебранда с сосудодвигательной функцией эндотелия у больных с разной степенью выраженности атеросклероза венечных артерий. Укр. кардиолог. журнал. 2003; 6: 13–17.
Новости на тему
13.02.2025
14.05.2024
05.02.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
К настоящему времени во многих исследованиях показаны плейотропные эффекты статинов [1–5].
Статины оказывают противовоспалительное действие, о чем свидетельствует их способность снижать накопление провоспалительных соединений в атеросклеротической бляшке [6]; они ингибируют миграцию и пролиферацию гладкомышечных клеток – один из ключевых процессов атерогенеза; угнетают агрегационную активность тромбоцитов, тормозят активацию каскада свертывания и усиливают фибринолиз [7, 8], снижая, тем самым, тромбогенный потенциал сосудистой стенки; уменьшают окислительный стресс, а также улучшают функциональную активность эндотелия, способствуя, в основном, увеличению биодоступности
оксида азота (NO) [9, 10].
оксида азота (NO) [9, 10].
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
