Диагностика и лечение инфекции Helicobacter pylori в России: результаты проспективной наблюдательной программы «КАЙДЗЕН»
- Аннотация
- Статья
- Ссылки
- English
Цель – проанализировать региональные особенности практического применения рекомендаций по диагностике и лечению заболеваний, ассоциированных с инфекцией H. pylori, подготовить медицинскую информацию о пациентах (диагноз, факторы риска развития рака желудка и др.), получающих четырехкомпонентную схему эрадикации, включающую висмута трикалия дицитрат (Де-Нол), джозамицин (Вильпрафен Солютаб), амоксициллин (Флемоксин Солютаб) и ингибитор протонной помпы (ИПП), а также оценить эффективность эрадикации инфекции H. pylori и частоту возникновения нежелательных явлений при использовании четырехкомпонентной антихеликобактерной терапии.
Материал и методы. В программу были включены пациенты с H. pylori-ассоциированными заболеваниями, которым врач назначил четырехкомпонентную схему антихеликобактерной терапии. План обследования, инструментальные и лабораторные методы диагностики и контроля эффективности лечения определялись лечащим врачом в рамках повседневной практики. Интервалы визитов были нефиксированными. При описании полученных данных использовали методы дискриптивной статистики.
Результаты. Проанализированы индивидуальные регистрационные карты 2661 пациента. 98,4% пациентов, которым проводили эрадикацию, имели язвенную болезнь или хронический гастрит. У 55% пациентов помимо инфекции H. pylori зафиксирован один или несколько факторов риска развития рака желудка. Наиболее распространенными методами диагностики H. pylori в нашей стране являются быстрый уреазный тест, гистологическое исследование биоптатов и определение антител к H. pylori. Все более широкое распространение получает анализ кала на антиген H. pylori. В 74,5% случаев для первичной диагностики инфекции H. pylori использовались инвазивные методы, для контроля эффективности эрадикационной терапии – неинвазивные, в частности анализ кала на антиген H. pylori. В половине случаев врачи допускали отступления от существующих рекомендаций по контролю эффективности эрадикационной терапии. Эрадикация H. pylori при использовании схемы в составе ИПП, висмута трикалия дицитрата, амоксициллина, джозамицина была достигнута у 91,9% пациентов. Переносимость принимаемых по данной схеме препаратов была оценена как хорошая у 78,9%. Нежелательные явления отмечались у 4,9% больных.
Цель – проанализировать региональные особенности практического применения рекомендаций по диагностике и лечению заболеваний, ассоциированных с инфекцией H. pylori, подготовить медицинскую информацию о пациентах (диагноз, факторы риска развития рака желудка и др.), получающих четырехкомпонентную схему эрадикации, включающую висмута трикалия дицитрат (Де-Нол), джозамицин (Вильпрафен Солютаб), амоксициллин (Флемоксин Солютаб) и ингибитор протонной помпы (ИПП), а также оценить эффективность эрадикации инфекции H. pylori и частоту возникновения нежелательных явлений при использовании четырехкомпонентной антихеликобактерной терапии.
Материал и методы. В программу были включены пациенты с H. pylori-ассоциированными заболеваниями, которым врач назначил четырехкомпонентную схему антихеликобактерной терапии. План обследования, инструментальные и лабораторные методы диагностики и контроля эффективности лечения определялись лечащим врачом в рамках повседневной практики. Интервалы визитов были нефиксированными. При описании полученных данных использовали методы дискриптивной статистики.
Результаты. Проанализированы индивидуальные регистрационные карты 2661 пациента. 98,4% пациентов, которым проводили эрадикацию, имели язвенную болезнь или хронический гастрит. У 55% пациентов помимо инфекции H. pylori зафиксирован один или несколько факторов риска развития рака желудка. Наиболее распространенными методами диагностики H. pylori в нашей стране являются быстрый уреазный тест, гистологическое исследование биоптатов и определение антител к H. pylori. Все более широкое распространение получает анализ кала на антиген H. pylori. В 74,5% случаев для первичной диагностики инфекции H. pylori использовались инвазивные методы, для контроля эффективности эрадикационной терапии – неинвазивные, в частности анализ кала на антиген H. pylori. В половине случаев врачи допускали отступления от существующих рекомендаций по контролю эффективности эрадикационной терапии. Эрадикация H. pylori при использовании схемы в составе ИПП, висмута трикалия дицитрата, амоксициллина, джозамицина была достигнута у 91,9% пациентов. Переносимость принимаемых по данной схеме препаратов была оценена как хорошая у 78,9%. Нежелательные явления отмечались у 4,9% больных.








Введение
После открытия нобелевскими лауреатами R. Warren и B. Marshall в 1983 г. Helicobacter pylori было получено множество весомых доказательств роли этого микроорганизма в этиопатогенезе гастрита, язвенной болезни желудка и двенадцатиперстной кишки и рака желудка. Всемирная организация здравоохранения признала H. pylori канцерогеном первого типа и считает его основным фактором риска рака желудка [1–4].
Эрадикация H. pylori – необходимое и неотъемлемое условие успешного лечения хронического гастрита и язвенной болезни [1, 3, 5, 6].
Метаанализ семи многоцентровых исследований (6695 пациентов) показал, что после эрадикационной терапии относительный риск развития рака желудка снижается на 35% [7]. Вместе с тем многие исследователи отмечают, что в азиатских странах риск рака желудка и заболеваемость им всегда считались высокими. Исследования, ставящие своей целью подтвердить значимость эрадикационной терапии как основного метода профилактики рака желудка, продолжаются [5, 8].
Положения IV Маастрихтского консенсуса рекомендуют антихеликобактерную терапию как меру канцерпревенции при наличии следующих факторов, увеличивающих риск неоплазии:
- атрофический гастрит;
- рак желудка у близких родственников;
- проведенная ранее эндоскопическая или субтотальная резекция желудка по поводу злокачественного новообразования;
- длительный прием ингибиторов протонной помпы (ИПП) (гастроэзофагеальная рефлюксная болезнь (ГЭРБ), профилактика гастропатий, ассоциированных с приемом нестероидных противовоспалительных препаратов, и т.п.);
- воздействие неблагоприятных факторов внешней среды (в том числе табакокурение).
В то же время допускается положение, согласно которому потенциальный профилактический эффект эрадикационной терапии в отношении рака желудка является приоритетным для врача, сомневающегося в необходимости ее проведения в любой клинической ситуации [1, 9].
Данные о распространенности ряда факторов риска развития рака желудка в России хорошо известны. Хеликобактериоз выявляется у 70,8% взрослого населения, у 58,1% из них – CagA+ и у 41,9% – CagA- [10]. Табакокурение зарегистировано у 65% мужчин и 40% женщин [11]. Потребление алкоголя на душу населения в год составляет 15,7 л (четвертое место в мире) [12]. Объем продаж 32 зарегистрированных по торговым наименованиям ИПП в 2011 г. составил 16,3 млн упаковок [13]. Показатели заболеваемости раком желудка в 2013 г. достигли 25,99 на 100 000 и смертности 21,93 на 100 000 населения. В нашей стране рак желудка занимает четвертое место в общей структуре онкологической заболеваемости и второе в структуре онкологической смертности, что обусловлено его поздней диагностикой. В 2013 г. первичный диагноз рака желудка у 66,5% больных был установлен на III–IV стадии заболевания, а годичная летальность с момента установления диагноза составила 49,2% [14, 15].
Основной проблемой антихеликобактерной терапии является возрастающая во всем мире антибиотикорезистентность [1, 16, 17].
Одним из наиболее доступных методов оптимизации антихеликобактерной терапии считается включение в состав схем первой линии терапии висмута трикалия дицитрата. К нему не формируется резистентность H. pylori. Кроме того, висмута трикалия дицитрат способствует преодолению резистентности H. pylori к антибиотикам и обеспечивает дополнительный прирост эффективности эрадикационной терапии на 15–20% [17–22].
Включение в схему эрадикационной терапии 16-членного макролида джозамицина является национальным российским приоритетом. Сложная пространственная структура джозамицина, состоящая из 16-членного лактонного кольца и длинной боковой цепи, резко ослабляет эффлюксные механизмы развития к нему резистентности. Джозамицин имеет меньшую аффинность к изоферменту CYP3A4 печени, вследствие чего риск взаимодействия с другими лекарственными препаратами невысок.
Положительный клинический опыт применения джозамицина в схемах стандартной тройной терапии, квадротерапии и модифицированной последовательной терапии позволяет рассматривать его как альтернативу кларитромицину [17, 23–26].
В соответствии с Пятыми Московскими соглашениями рекомендуется квадротерапия, включающая ИПП, висмута трикалия дицитрат, макролиды кларитромицин или джозамицин и амоксициллин [26].
В современных отечественных и зарубежных клинических рекомендациях по диагностике и лечению инфекции Helicobacter pylori у взрослых достаточно подробно изложены тактика и стратегия диагностики и лечения инфекции H. pylori (Маастрихт-IV, Пятые Московские соглашения, рекомендации Российской гастроэнтерологической ассоциации) [1, 27, 28].
Что касается дисциплины практикующих врачей по исполнению рекомендованных схем, проведенное недавно нашим сотрудником П.В. Гуляевым исследование показало, что административно утвержденные в Москве Пятые Московские соглашения наиболее эффективно работают только у организованного контингента пациентов – в группе длительно и часто болеющих. Именно у этой группы больных готовность соблюдать рекомендации врача составила 93,3%, эффективность эрадикационной терапии – 92,4%. Активность воспалительного процесса слизистой оболочки желудка (по визуально-аналоговой шкале Хьюстонской модификации Сиднейской системы) до лечения составляла 2,94 балла, через год после лечения – 1,62 балла, через три года – 0,49 балла.
Среди пациентов контрольной группы (не состоявших на учете в амбулаторно-поликлиническом учреждении и обратившихся к врачу после ухудшения самочувствия) только 16,8% были готовы соблюдать назначения врача. Соответственно эффективным лечение оказалось только у 68,8% пациентов.
Адекватное лечение при условии регулярного контроля экономически более выгодно [29].
Наблюдательные программы или регистры предназначены для анализа эффектов внедрения рекомендуемых технологий диагностики и лечения в повседневную клиническую практику, поскольку предоставляют возможность получения дополнительных сведений о течении заболеваний, применении различных методик диагностики и лечения, наличии нежелательных лекарственных воздействий [30].
В настоящее время в 30 странах Европы по инициативе Европейской группы по изучению H. pylori и микробиоты (European Helicobacter and Microbiota Study Group – EHMSG) проводится наблюдательное исследование Европейский регистр ведения инфекции Helicobacter pylori – протокол Hp-EuReg – European Registry on the management of Helicobacter pylori infection, Protocol Code ῾Hp-EuReg’ [31]. Его промежуточные результаты демонстрируют субоптимальную эффективность стандартной семидневной тройной схемы (73%) [32].
Результаты наблюдательной программы «ПАРАД», проведенной в России в 2011–2014 гг., подтвердили необходимость дальнейшего мониторинга клинической практики ведения пациентов с H. pylori-инфекцией и более глубокого изучения вопросов профилактики рака желудка [33].
Логичным продолжением программы «ПАРАД» стала проведенная в 2013–2014 гг. программа «КАЙДЗЕН» («Проспективная наблюдательная программа (регистр) взрослых пациентов с H. pylori-ассоциированными заболеваниями, получающих антихеликобактерную терапию, включающую висмута трикалия дицитрат (Де-Нол), джозамицин (Вильпрафен Солютаб), амоксициллин (Флемоксин Солютаб) и ингибитор протонной помпы в условиях рутинной клинической практики»). Полученные результаты позволили ответить на ряд вопросов, касающихся антихеликобактерной терапии.
Цели программы
Первичной целью наблюдательной программы «КАЙДЗЕН» стала оценка уровня эрадикации H. pylori у взрослых пациентов, получавших четырехкомпонентную антихеликобактерную терапию – висмута трикалия дицитрат (Де-Нол), джозамицин (Вильпрафен Солютаб), амоксициллин (Флемоксин Солютаб) и ИПП в условиях реальной клинической практики.
Вторичные цели программы предусматривали:
- анализ динамики и частоты купирования симптомов H. pylori-ассоциированных заболеваний на фоне проведения четырехкомпонентной антихеликобактерной терапии;
- оценку в наблюдаемой популяции частоты развития нежелательных реакций, зарегистрированных на протяжении всего периода проведения программы, а также доли пациентов c хорошей/удовлетворительной/неудовлетворительной переносимостью назначенной терапии;
- анализ клинических диагнозов и эндоскопических заключений у пациентов, получавших четырехкомпонентную антихеликобактерную терапию в условиях реальной клинической практики;
- определение методов диагностики, используемых в реальной клинической практике для первичного выявления инфекции H. pylori и контроля эффективности эрадикации, а также сроков их проведения в разных регионах России;
- уточнение доступности методов диагностики инфекции H. pylori в реальной клинической практике в регионах России;
- оценку частоты факторов риска рака желудка у пациентов, получавших антихеликобактерную терапию в разных регионах России.
Критерии включения и исключения
Критериями включения в проспективную неинтервенционную программу (регистр) по наблюдению пациентов с H. pylori-ассоциированными заболеваниями, получавшими антихеликобактерную терапию, были:
- информированное согласие на участие в программе, датированное и подписанное пациентом;
- лица обоего пола в возрасте 18 лет и старше;
- наличие H. pylori-ассоциированного заболевания;
- предшествующее включению в программу решение врача о назначении четырехкомпонентной схемы эрадикационной терапии – висмута трикалия дицитрата (Де-Нол), джозамицина (Вильпрафен Солютаб), амоксициллина (Флемоксин Солютаб) в комбинации с ИПП;
- H. pylori-положительный статус на момент начала терапии.
Критерием исключения стало наличие хронической диареи или других состояний желудочно-кишечного тракта (ЖКТ), способных повлиять на абсорбцию препаратов из ЖКТ.
Схема программы
Программа была одобрена Независимым междисциплинарным комитетом по этической экспертизе клинических исследований (г. Москва) 27 сентября 2013 г., протокол заседания № 15.
Предполагалось участие 400 пра-ктикующих врачей-гастроэнтерологов из всех федеральных округов России, оказывающих амбулаторную медицинскую помощь пациентам с заболеваниями органов пищеварения.
Каждый врач должен был в течение пяти месяцев собрать информацию о десяти пациентах.
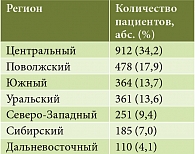
В рамках программы были выделены семь регионов, которые в принципе совпадают с административным разделением Российской Федерации на федеративные округа: Центральный, Северо-Западный, Южный, Поволжский, Уральский, Сибирский, Дальневосточный.
Включение конкретного пациента в программу проводилось только после назначения ему врачом четырехкомпонентной эрадикационной терапии в составе ИПП, висмута трикалия дицитрата, джозамицина и амоксициллина.
План лечения и использования инструментальных и лабораторных методов исследования определял лечащий врач в рамках повседневной клинической практики. Антихеликобактерная терапия выполнялась в соответствии с одобренной инструкцией по медицинскому применению используемых препаратов и принятой клинической практикой.
В рамках программы для каждого пациента были предусмотрены три визита (рис. 1), но интервалы между ними не были четко зафиксированы и устанавливались исходя из повседневной практики врача.
При первом визите врач должен был собрать и занести в индивидуальную регистрационную карту информацию о демографических данных пациента, жалобах, клиническом диагнозе, эндоскопическом заключении, факторах риска развития рака желудка, методах и результатах диагностики инфекции H. pylori, а также разовой дозе, кратности и длительности приема назначенных препаратов. Второй визит проводился после завершения курса четырехкомпонентной терапии инфекции H. pylori. Врач фиксировал жалобы пациента, данные о переносимости лечения и наличии нежелательных явлений. Во время последнего, третьего визита собиралась информация о жалобах пациента, нежелательных явлениях, методах контроля эрадикации и ее эффективности.
Для оценки доступности методов диагностики инфекции H. pylori в начале программы врач отдельно заполнял специальный опросник.
Статистика
Использованы методы дескриптивной статистики. Количественные данные представлены средними значениями и стандартным отклонением, качественные данные – с помощью доли (% с 95%-ным доверительным интервалом (ДИ)). В статистическом анализе использованы только имеющиеся данные. Отсутствующие значения не восстанавливались.
Результаты
В программе «КАЙДЗЕН» приняли участие 283 гастроэнтеролога из 400 запланированных к привлечению.
Каждый врач в течение шести месяцев включил в исследование в среднем десять пациентов.
По завершении протокола была собрана информация о 2900 пациентах. 2661 пациент признан соответствующим утвержденным критериям включения/исключения.
58,4% пациентов, в отношении которых собиралась информация, составили женщины, 41,6% – мужчины. Средний возраст – 45,8 ± 14,1 года.
Количество отобранных пациентов по регионам представлено в табл. 1.
В индивидуальных регистрационных картах 2609 (98%) пациентов содержалась информация по всем трем визитам, у 20 (0,8%) отсутствовали данные по второму и третьему визиту, у 32 (1,2%) – по третьему визиту.
Анализ данных проводился per protocol (PP).
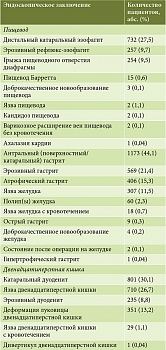
В таблице 2 перечислены основные заболевания, при которых проводилась антихеликобактерная терапия. В общей сложности у 45% пациентов имели место неосложненная или осложненная язвенная болезнь желудка и двенадцатиперстной кишки, острая язва желудка и двенадцатиперстной кишки, хронический поверхностный (30,4%) и хронический атрофический гастрит (9,7%), а также хронический гастрит неуточненный (13,3%).
Реже эрадикация инфекции H. pylori проводилась при остром гастрите, синдроме диспепсии, полипах желудка и синдроме оперированного желудка.
Эрадикационная терапия при необходимости длительной терапии ИПП при ГЭРБ выполнялась у 3% больных.
Только у восьми (0,3%) пациентов антихеликобактерная терапия была назначена при дивертикуле двенадцатиперстной кишки, дискинезии желчного пузыря, хроническом вирусном гепатите B или С, хроническом панкреатите и хронической крапивнице.
Результаты предшествующих включению в программу «КАЙДЗЕН» эндоскопических заключений пациентов приведены в табл. 3.
Наиболее часто регистрировались эндоскопические признаки гастрита и дуоденита. Неосложненная и осложненная кровотечением язва двенадцатиперстной кишки диагностирована в 27,8% случаев, тогда как язва желудка – в 12,2% случаев. Полипы желудка обнаружены у 2,3% обследованных.
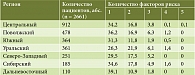
У 55,1% пациентов помимо хеликобактериоза отмечалось наличие одного или нескольких факторов риска: у 32,9% пациентов – один фактор, у 16,7% – два фактора, у 4,4% – три, у 0,6% – четыре, у 0,04% – пять.
Процент пациентов с одним или несколькими факторами риска рака желудка в разных регионах России был сопоставим (табл. 4).
Атрофический гастрит отмечался у 17,5% пациентов, причем у 60,9% из них атрофия слизистой оболочки подтверждена гистологически, у 3,9% – с помощью исследования уровня пепсиногена в крови.
Члена семьи первой степени родства с диагностированным раком желудка имели 13,9% пациентов.
22,9% больных информировали врача о длительном приеме антисекреторных препаратов. 21,3% из них принимали эти средства более шести месяцев, 21,0% – более года.
16 (0,6%) пациентов ранее перенесли резекцию желудка по поводу рака.
Факт табакокурения зарегистрирован у 27,4% пациентов, средний индекс курения «пачка/лет» составил 13,1 ± 11,0. Однако у 53,6% пациентов он превысил 10,0.
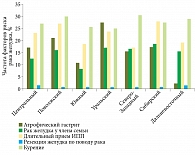
Анализ региональных особенностей показал равномерное распределение факторов риска рака желудка (рис. 2).
Обращает на себя внимание высокий процент выявления атрофического гастрита в Уральском регионе и низкий – в Южном.
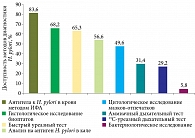
Опросник доступности тестов для диагностики инфекции H. pylori в клинической практике заполнили 274 врача. Наиболее доступными методами (выше 60%) стали определение антител к H. pylori в крови, быстрый уреазный тест и гистологическое исследование биоптатов. Более половины гастроэнтерологов смогли провести анализ кала на антиген Н. pylori (рис. 3).
Во всех регионах наиболее доступными были инвазивные методы диагностики H. pylori. Из неинвазивных тестов повсеместно отмечалась высокая доступность анализа кала на антиген H. pylori. Уреазный дыхательный тест использовался реже (рис. 4).
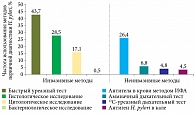
Для нашей страны характерно широкое использование эзофагогастродуоденоскопии (ЭГДС), в том числе для первичной диагностики хеликобактериоза. В данном исследовании таковых насчитывалось 74,5% больных. Гистологическое исследование биоптатов слизистой оболочки желудка проведено 28,5% пациентов, цитологическое исследование мазков-отпечатков – 17,1%, быстрый уреазный тест – 43,7%.
Неинвазивные методы применялись у 38,7% больных: 13С-уреазный дыхательный тест – у 4,8%, аммиачный дыхательный тест – у 6,8%, определение антител к H. pylori с помощью иммуноферментного анализа (ИФА) – у 26,4%, выявление в кале антигена H. pylori методом ИФА – у 4,5%, бактериологическое исследование – у 0,5% (рис. 5).
Чаще использовались быстрый уреазный тест и гистологическое исследование биоптатов слизистой оболочки желудка.
Из неинвазивных тестов для первичной диагностики инфекции H. pylori, как правило, использовали тест на определение антител к этой бактерии в крови (рис. 6).
Изучаемая схема эрадикационной терапии, включавшая ИПП, висмута трикалия дицитрат, амоксициллин и джозамицин, стала терапией первой линии у 87,7%, второй линии – у 8,8%, третьей линии – у 1,1% больных.
Не удалось получить соответствующую информацию у 2,5% больных.
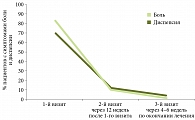
Динамика исчезновения жалоб на фоне антихеликобактерной терапии представлена на рис. 7.
На момент включения в исследование жалобы различного характера предъявляли 95,1% пациентов. В целом характер жалоб был идентичен. Так, боли и дискомфорт в эпигастральной области отмечали 83,3% пациентов, диспепсию (тяжесть после приема пищи, быстрое насыщение и др.) – 69,6% больных.
Во время второго визита боли и дискомфорт сохранялись у 10,7%, диспепсия – у 12,5% больных.
К моменту третьего визита боль и дискомфорт в эпигастрии зафиксированы у 2,1%, диспепсия – у 4,1% пациентов.
Среднее время полного исчезновения жалоб составило 7,36 ± 5,3 дня с момента начала лечения (рис. 7).
К моменту третьего визита контроль эффективности антихеликобактерной терапии был проведен у 2452 (94%) пациентов из 2661 пациента, соответствовавшего критериям включения/исключения (рис. 8).
Неинвазивные методы использовались у 69,7% больных. Чаще применяли анализ кала на антиген H. pylori.
Инвазивные методы применялись у 42,6% пациентов, наиболее часто быстрый уреазный тест и гистологическое исследование биоптатов.
Во всех регионах России используется тест на антиген H. pylori в кале (рис. 9). Приходится констатировать, что, несмотря на действующие рекомендации, в качестве контроля антихеликобактерного эффекта продолжает использоваться определение антител к H. pylori в крови (12,3% пациентов), что требует интенсификации образовательной деятельности среди врачебного состава.
Однако анализ сроков и методов проведения контроля эрадикации инфекции H. pylori показал, что при его назначении был допущен ряд отступлений от отечественных и международных рекомендаций. В целом одна или две ошибки были выявлены в 50,7% индивидуальных рабочих карт:
контроль эрадикации проведен менее чем через четыре недели после окончания терапии – 43,8% пациентов;
в качестве контрольного метода применен тест на определение антител к H. pylori в крови – 12,3% пациентов.
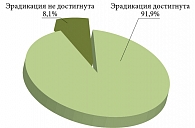
В связи с этим отдельно была проведена оценка эффективности эрадикации H. pylori с исключением из анализа индивидуальных рабочих карт этих пациентов. В итоге в анализ эффективности были включены 1209 (49,3%) из 2452 пациентов. Эрадикация инфекции H. pylori была достигнута у 91,9% (95%-ный доверительный интервал 90,5–93,6) пациентов (рис. 10).
Согласно результатам настоящего исследования, наиболее эффективным оказался десятидневный курс: эрадикация была достигнута в 94,1% случаев (табл. 5).
Врачи оценили переносимость эрадикационной терапии как хорошую у 78,9%, удовлетворительную у 20,7% и неудовлетворительную у 0,4% пациентов.
Суммарно во время лечения зарегистрировано 130 (4,9%) случаев нежелательных явлений (табл. 6), семь (0,3%) из них признаны серьезными (табл. 7). Причинами преждевременного прекращения лечения у троих больных стали тошнота, диарея и гиперчувствительность.
Обсуждение
Результаты наблюдательной программы «КАЙДЗЕН» показали, что во всех регионах России 99,7% гастроэнтерологов определяют показания для проведения антихеликобактерной терапии в соответствии с имеющимися рекомендациями.
Более чем в половине случаев показанием к проведению эрадикационной терапии стал подтвержденный хронический хеликобактерный гастрит. 45% пациентов имели язвенную болезнь желудка или двенадцатиперстной кишки.
Диагноз «функциональная диспепсия» в нашей стране практически не используется.
ЭГДС, предшествующая проведению терапии, была выполнена 98,2% больных. Предлагаемая зарубежными коллегами стратегия «test and treat» практически не используется как противоречащая культивируемой в России онкологической настороженности.
Помимо хеликобактериоза у 55,1% пациентов отмечалось наличие до пяти факторов риска рака желудка. Их частота во всех регионах оказалась сопоставимой. Эти данные соотносятся с достаточно равномерными показателями заболеваемости раком желудка по стране [14].
Так, атрофический гастрит зарегистрирован у 17,5% пациентов, что в целом соответствует отечественным данным [34]. Гистологическое подтверждение атрофии проведено 60,9% больных, исследование уровня пепсиногена крови – 3,9%. В остальных случаях врачи ограничивались описательной картиной без морфологической верификации.
У 13,9% больных имела место наследственная отягощенность по раку желудка, 0,6% ранее были подвергнуты резекции желудка по поводу рака.
Длительный прием антисекреторных препаратов выявлен у 610 пациентов, 21,3% принимали их свыше шести месяцев, 21% – свыше двенадцати, остальные более месяца.
Как известно, на фоне интенсивного подавления секреции соляной кислоты при наличии H. pylori атрофический гастрит может сформироваться в течение года, а признаки воспаления в слизистой оболочке тела желудка возникают в течение месяца [35–37]. Следует также иметь в виду снижение чувствительности большинства тестов на инфекцию H. pylori на фоне терапии ИПП [31].
Количество курильщиков составило 27,4%, у 53,6% из них индекс курения «пачка/лет» превысил 10,0. Табакокурение также включено в перечень риска рака желудка [1, 38].
Обращает на себя внимание несоответствие количества выявленных курильщиков высоким цифрам официальных источников (до 65%!) [11].
Согласно результатам проводимого в течение ряда лет скрининга населения г. Москвы, в 2004 г. доля курильщиков составляла 26,5%, а в 2008 г. – 24,9% [39].
Таким образом, результаты программы «КАЙДЗЕН» подтверждают, что в России постоянно курит около четверти взрослого населения.
ЭГДС традиционно в нашей стране относится к методам исследования первой линии. В большинстве случаев при обследовании пациентов с заболеваниями верхних отделов ЖКТ она проводится уже на начальных этапах диагностического поиска до назначения лечения (98,2% в рамках программы «КАЙДЗЕН»).
Неудивительно, что наиболее востребованными и доступными в рутинной практике остаются инвазивные методы первичной диагностики инфекции H. pylori: гистологическое и цитологическое исследование, быстрый уреазный тест. Широкая доступность и низкая стоимость обусловливают частое применение теста на антитела к H. pylori в крови. К преимуществам метода относится возможность его использования у больных, принимающих ИПП. В то же время существенным недостатком считается низкая диагностическая ценность для контроля эрадикации.
Важный момент: при контроле эффективности лечения преимущественно используются неинвазивные методы. В трети случаев применяется анализ на антиген H. pylori в кале. Этот тест появился в России сравнительно недавно, однако его применяют уже более половины опрошенных гастроэнтерологов. 13С-уреазный дыхательный тест используется значительно реже, вероятно, вследствие меньшей доступности.
Наибольшее количество отклонений от существующих отечественных и международных рекомендаций отмечалось при контроле эффективности эрадикации. Примерно в половине случаев не соблюдались рекомендованные сроки его проведения. Нередко назначался тест на определение антител к H. pylori в крови, который для контроля эрадикации использоваться не должен. Следствием подобных ошибок является высокая вероятность получения ложноотрицательных и ложноположительных результатов, что может предопределить неверный выбор тактики дальнейшего ведения пациента и, как следствие, ухудшение отдаленного прогноза заболевания. Отсутствие должного контроля эффективности терапии в рутинной практике врача не позволяет избежать использования неэффективных схем терапии.
Причин таких ошибок несколько. Как правило, в ходе образовательных мероприятий, научных конференций и конгрессов особое внимание уделяют вопросам лечения H. pylori. Диагностике же отводится значительно меньше времени. Не последнюю роль играет и недостаточная доступность основных неинвазивных методов контроля эффективности, которая отчасти может быть преодолена за счет широкого внедрения теста на антиген H. pylori в кале и 13С-уреазного дыхательного теста. Кроме того, не стоит сбрасывать со счетов низкую приверженность пациентов лечению и невозможность по разным причинам в условиях повседневной практики и большого потока больных выдержать необходимый временной промежуток перед проведением контроля.
Результаты отечественных и зарубежных исследований продемонстрировали, что низкий комплаенс пациентов остается одной из основных причин неудач эрадикационной терапии. В исследовании М.Ф. Осипенко и соавт. в группе пациентов с высоким комплаенсом уровень успешной эрадикации составил 86%, тогда как при недостаточной приверженности лечению антихеликобактерная терапия была успешной только в 74,9% случаев (р < 0,02) [40].
Эффективность квадротерапии в составе ИПП, висмута трикалия дицитрата, джозамицина и амоксициллина составила 91,9%, что позволяет использовать ее в лечении инфекции H. pylori. Эти результаты подтверждают данные о существенном повышении эффективности тройной терапии первой линии при добавлении к ней висмута трикалия дицитрата.
Выводы
Итоговые результаты наблюдательной программы «КАЙДЗЕН» позволяют сделать следующие выводы.
Квадротерапия в составе ИПП, висмута трикалия дицитрата, амоксициллина и джозамицина обеспечивает эрадикацию H. pylori в 91,9% случаев.
К моменту начала лечения боль/дискомфорт и симптомы диспепсии отмечались у 83,3 и 69,6% пациентов. При проведении четырехкомпонентной эрадикационной терапии через одну-две недели после начала лечения они сохранялись у 10,7 и 12,5% пациентов, а к окончанию лечения (через четыре – шесть недель) – у 2,1 и 4,1% пациентов соответственно.
Переносимость исследуемой терапии врачи-гастроэнтерологи оценили как хорошую в 78,9% случаев. Нежелательные явления зарегистрированы у 4,9% пациентов, 0,3% являлись серьезными.
Гастроэнтерологам хорошо известны показания к назначению антихеликобактерной терапии. В повседневной практике она наиболее часто назначается при язвенной болезни желудка и двенадцатиперстной кишки, а также при хроническом гастрите.
Первичная диагностика хеликобактериоза чаще проводится инвазивными методами (74,5%). Неинвазивные тесты проведены 38,7% больных (чаще определение антител к H. pylori в крови).
Для контроля эффективности эрадикации H. pylori обычно используются неинвазивные тесты, во всех регионах широко применяется метод определения антигена H. pylori в кале.
Отступления от клинических рекомендаций наиболее часто отмечались у 50,8% пациентов.
Несоблюдение сроков проведения контрольного исследования выявлено в 43,8% случаев.
Наиболее доступными остаются быстрый уреазный тест, гистологическое исследование биоптатов и серологическое определение антител к H. pylori. При этом отмечается повсеместное внедрение теста на выявление антигена H. pylori в кале.
Более половины больных с хеликобактериозом имели один или несколько дополнительных факторов риска рака желудка: атрофический гастрит – 17,5% пациентов, отягощенный наследственный анамнез по раку желудка – 13,9%, длительный прием антисекреторных препаратов – 22,9%, резекция желудка по поводу рака – 0,6%, курение – 27,4%. При этом один дополнительный фактор риска зафиксирован у 32,9% пациентов, два – у 16,7%, три – у 4,4%, четыре – у 0,6%, пять – у 0,4% обследованных. Наблюдалось сходное регионарное распространение факторов риска рака желудка.
Полученные результаты подтверждают актуальность и необходимость продолжения комплексного мониторирования повседневной клинической практики ведения пациентов с H. pylori-ассоциированными заболеваниями.
L.B. Lazebnik, D.S. Bordin
Moscow State University of Medicine and Dentistry named after A.I. Evdokimov, Russian Scientific Gastroenterology Society
Moscow Clinical Scientific Center Department of Moscow Healthcare
Contact person: Leonid Borisovich Lazebnik, leonid.borisl@gmail.com
The data from ῾Prospective observational program (registry) for adult patients with H. pylori-associated diseases treated with anti-helicobacter therapy including tri-potassium bismuth dicitrate (De-Nol), josamicyn (Wilprafen Soljutab), amoxicillin (Flemoxin Soljutab) and proton pump inhibitor in routine clinical practice’ are presented in the paper.
Objective – to analyze regional specific features for practical use of Recommendations on diagnostics and treatment of diseases associated with H. pylori, prepare medical information on patients (diagnosis,
risk factors of stomach cancer etc.) obtaining a four-component H. pylori eradication protocol consisting of tri-potassium bismuth dicitrate (De-Nol), josamicyn (Wilprafen Soljutab), amoxicillin (Flemoxin Soljutab) and proton pump inhibitor as well as assess efficacy of H. pylori eradication protocol and rate of adverse events developing during a four-component anti-Helicobacter pylori therapy.
Materials and Methods. Patients with H. pylori-associated diseases administered with a four-component anti-H. pylori protocol were enrolled to the study. Examination plan, diagnostics tools and control for therapeutic efficacy were determined by a ward physician during an every-day clinical practice, with non-fixed visiting intervals. The data obtained were assessed by using descriptive statistical methods.
Results. Individual record sheets from 2661 patients were analyzed during the study. It was found that 98.4% patients undergoing eradication protocol suffered from peptic ulcer disease or chronic gastritis. Apart from that, 55% patients had one or more risk factors of developing stomach cancer. In Russia, a rapid urease assay, histologic biopsy test and detection of anti-H. pylori antibodies are among the most common methods for diagnosing H. pylori. A coprological assay for detecting H. pylori antigens has becoming increasingly used. Invasive assays were used in 74.5% cases during primary diagnostics of H. pylori infection, whereas non-invasive methods including coprological assay for H. pylori antigen were used to assess efficacy of eradication therapy. In 50% cases, deviations from the current recommendations on controlling efficacy of eradication therapy were allowed by physician. It was found that H. pylori eradication was achieved in 91.9% of patieents treated with a therapeutic protocol consisting of proton pump inhibitor, tri-potassium bismuth dicitrate (De-Nol), amoxicillin, and josamicyn. In 78.9% patients was considered to have a good tolerability reaching. Adverse events were recorded in 4.9% patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.