количество статей
7206
Загрузка...
Пожалуйста, авторизуйтесь:
Практика
Влияние сердечно-сосудистых рисков на оптимизацию терапии у пациентов с СД 2 типа
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №5 (48)
- Аннотация
- Статья
- Ссылки
- English
Авторы обсуждают целесообразность применения терапевтической стратегии поддержания невысокой хронической гипергликемии во избежание риска гипогликемии на фоне терапии препаратами сульфонилмочевины. На примере гликлазида МВ показано, что лечение современными препаратами сульфонилмочевины не оказывает отрицательного влияния на развитие сердечно-сосудистых осложнений сахарного диабета и не повышает риск смерти от них. Однако при выборе терапии следует учитывать индивидуальные особенности пациента: сохранность чувствительности к гипогликемии, наличие выраженных сосудистых осложнений, состояние функции бета-клеток, сопутствующую терапию и др.
![Рис. 1. Влияние интенсивного контроля гликемии на смертность от сердечно-сосудистых заболеваний (адаптировано по [11])](/upload/resize_cache/iblock/5e5/195_350_1/5e5a5353db9d55e37d0b5e2ad524f57f.jpg)
Рис. 1. Влияние интенсивного контроля гликемии на смертность от сердечно-сосудистых заболеваний (адаптировано по [11])
![Рис. 2. Частота развития гипогликемии в исследованиях VADT, ACCORD и ADVANCE [11]](/upload/resize_cache/iblock/1c4/195_350_1/1c48b6076dcfb05924b97fa6d353bfc1.jpg)
Рис. 2. Частота развития гипогликемии в исследованиях VADT, ACCORD и ADVANCE [11]
![Рис. 3. Изменение концентрации инсулина после стандартного завтрака через 4 недели терапии гликлазидом [41]](/upload/resize_cache/iblock/7a6/195_350_1/7a658be4d261fd6eac2c43991d0a4520.jpg)
Рис. 3. Изменение концентрации инсулина после стандартного завтрака через 4 недели терапии гликлазидом [41]
![Рис. 4. Изменение ранней фазы секреции инсулина через 4 недели терапии гликлазидом [41]](/upload/resize_cache/iblock/604/195_350_1/604faf4629ac1b9b6bc422f988dca3b1.jpg)
Рис. 4. Изменение ранней фазы секреции инсулина через 4 недели терапии гликлазидом [41]
![Рис. 5. Влияние гликлазида МВ на восстановление раннего пика секреции инсулина [42]](/upload/resize_cache/iblock/77b/195_350_1/77b4a8fafbe84dbe3ff160781a2d911d.jpg)
Рис. 5. Влияние гликлазида МВ на восстановление раннего пика секреции инсулина [42]
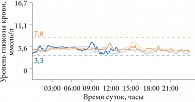
Рис. 6. Данные суточного мониторирования глюкозы у пациентки Т.
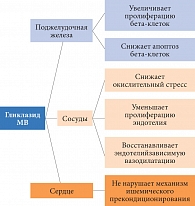
Рис. 7. Комплексное действие гликлазида МВ
Введение
Сердечно-сосудистые заболевания нередко сопутствуют сахарному диабету (СД). Они являются основной причиной смерти больных СД и вывели это заболевание на 3-е место в структуре смертности.
Тактика гликемического контроля, гипогликемия и сердечно-сосудистые события
Увеличение сердечно-сосудистой смертности на фоне СД можно объяснить несколькими причинами: гипергликемией, гипогликемией, нарушением функционирования автономной нервной системы со снижением парасимпатической защиты. Для выяснения, может ли контроль гликемии уменьшить частоту сердечно-сосудистых событий, было проведено несколько исследований, которые не подтвердили положительного влияния интенсивного гликемического контроля на смертность пациентов от сосудистых осложнений: UKDP (1978), UKPDS (United Kingdom Prospective Diabetes Study – Британское проспективное исследование СД 2 типа, 1998), Service (1983), VA CSDM (1995), Kumamoto Study (2000), W. Bagg (2001), IDA (Insulin-dependent Diabetes in young Adults – Инсулинзависимый сахарный диабет у молодых пациентов) (2009) [1], VADT (Veterans Affairs Diabetes Trial – Исследование сахарного диабета Министерства по делам ветеранов США) (2009), РЭМБО-СД ХСН (Рациональная эффективная многокомпонентная терапия в борьбе с сахарным диабетом у больных с хронической сердечной недостаточностью) (2008) [2], ACCORD (Action to Control Cardiovascular Risk in Diabetes Trial – Действия по снижению сердечно-сосудистого риска в исследовании сахарного диабета, 2008), DCCT (Diabetes Control and Complications Trial – Исследование контроля и осложнений сахарного диабета), EDIC (Epidemiology of Diabetes Interventions and Complications Study – Исследование эпидемиологии лечения и осложнений сахарного диабета), ADVANCE (Action in Diabetes and Vascular disease: preterAx and diamicroN-MR Controlled Evaluation trial – Контролируемое исследование эффективности интенсивной терапии с помощью Нолипрела А и Диабетона МВ) [3–9]. Особую настороженность вызвали результаты исследования ACCORD [10], согласно которым смертность в группе интенсивного контроля была выше, чем в группе стандартного контроля, что, предположительно, было связано с гипогликемией. Единственное исследование, в котором была установлена тенденция к снижению частоты макрососудистых событий, – это ADVANCE (рис. 1). Для получения статистически достоверных данных, как считают исследователи, не хватило времени, поэтому наблюдение за пациентами продолжается (исследование ADVANCE ON).
Предполагается, что существует несколько механизмов, приводящих к увеличению смертности по причине гипогликемии:
- изменение реологии (повышение коагуляции крови за счет активизации VIII фактора свертываемости и фактора Виллебранда, увеличение количества эритроцитов приводит к повышению вязкости крови);
- повышение концентрации эндотелина и С-реактивного белка;
- активизация симпатико-адреналовой системы, в результате чего увеличивается частота сердечных сокращений, артериальное давление (АД), развивается катехоламининдуцированная гипокалиемия, что провоцирует развитие аритмий;
- усиление вазоконстрикции и уменьшение вазодилатации [12], что приводит к нарушению кровоснабжения миокарда и гипоксии, увеличивая риск аритмии;
- в условиях недостатка глюкозы происходит снижение продукции аденозинтрифосфата (АТФ), следовательно, усиливаются энергетический голод и гипоксия, удлиняется интервал QT, снижается вариабельность ритма сердца, что может провоцировать развитие аритмий [13, 14];
- перенесенная гипогликемия снижает адаптивные возможности организма к стрессовым ситуациям.
Следует отметить, что на сегодняшний день отрицательное влияние гипогликемии на сердце не доказано. Нельзя исключать, что увеличение дозы препаратов на фоне активного образа жизни повышало риск побочных эффектов у пациентов. Кроме того, гипогликемия может служить суррогатным маркером тяжести СД: к тяжелым гипогликемиям более предрасположены пациенты с продолжительным СД, выраженными осложнениями, что подтверждают данные исследования ACCORD, в ходе которого не выявлено увеличения смертности на фоне повторных эпизодов гипогликемии [15]. Необходимо также учитывать возраст больных, так как пациенты старше 75 лет в большей степени предрасположены к тяжелой гипогликемии. Это связано с наличием сопутствующих заболеваний, возрастным снижением уровней контринсулярных гормонов (глюкагона, соматотропного гормона), снижением бета-адренергической, а также почечной функции и активности ферментов печени, что может изменять метаболизм препаратов (сульфонилмочевины и инсулина). Кроме этого, необходимо оценивать и чувствительность пациентов к гипогликемии. Известно, что частые эпизоды гипогликемии в анамнезе могут приводить к развитию автономной недостаточности (hypoglycemia-associated autonomic failure, HAAF) в ответ на гипогликемию, что утяжеляет состояние пациента и даже может привести к смерти. Однако в настоящее время принято считать, что развитие HAAF является приспособительной реакцией на повторяющиеся эпизоды гипогликемии, о чем свидетельствуют эксперименты на животных: смертность на фоне тяжелой гипогликемии была ниже в группе с эпизодами гипогликемии в анамнезе, чем в группе без гипогликемии в анамнезе.
На вопрос о влиянии гипогликемии на снижение умственных способностей также до настоящего времени нет единого ответа: наблюдательное исследование длительностью более 20 лет (1980–2002 гг.) показало увеличение риска развития деменции в 2 раза у пациентов, которые обращались за медицинской помощью из-за гипогликемии. Однако следует отметить, что до начала исследования пациенты не проходили когнитивные тесты. Результаты исследования ACCORD MIND [16] не показали отрицательного влияния гипогликемии на когнитивную функцию.
Итак, в настоящее время нет убедительных доказательств опасности эпизодов легкой гипогликемии, но во избежание их возникновения врачи и пациенты вынуждены поддерживать уровень гликемии выше рекомендуемых целевых значений (37% пациентов не достигают компенсации углеводного обмена из-за опасений развития гипогликемии), что неминуемо увеличивает риск осложнений СД. При определении целей сахароснижающей терапии, для предотвращения отрицательных последствий интенсификации терапии необходимо предотвращение эпизодов тяжелой гипогликемии, угрожающих жизни пациента. Для этого очень важно исключить у пациента нарушение чувствительности к гипогликемии.
Подчеркнем: страх гипогликемии приводит к необоснованному снижению доз сахароснижающих препаратов с доказанной эффективностью – инсулина и препаратов сульфонилмочевины.
Препараты сульфонилмочевины и риск гипогликемии
Среди всех средств пероральной терапии СД лучше всего изучены препараты сульфонилмочевины, применяющиеся в клинической практике уже более 50 лет. За это время они доказали свою эффективность и безопасность. И в нашей стране, и в мире широкое применение нашли гликлазид и глибенкламид. Последний, согласно новейшим рекомендациям, не показан для стартовой терапии по причине высокого риска развития гипогликемии.
Преимуществом гликлазида является высокая селективность по отношению к рецепторам сульфонилмочевины бета-клеток, что обусловлено особенностями его химической структуры. Гликлазид модифицированного высвобождения (МВ) связывается только с рецепторами на бета-клетке и неактивен по отношению к кардиомиоциту и гладкомышечным клеткам сосудов, это и определяет безопасность его применения у пациентов с сердечно-сосудистыми заболеваниями. Особенностью гликлазида является также обратимое взаимодействие с бета-клетками, что объясняет низкий риск гипогликемии на фоне его приема.
Результаты многоцентрового исследования ADVANCE [17] показали, что интенсивный контроль гликемии при помощи гликлазида МВ позволил снизить число микрососудистых осложнений на 14%. Это очень важно, поскольку микрососудистые изменения являются предиктором развития макрососудистых осложнений СД [18, 19]. Более того, прогрессирование микрососудистых осложнений усугубляет течение макрососудистых осложнений [20].
Отличие результатов исследования ADVANCE от данных, полученных в исследованиях ACCORD и VADT, можно объяснить более плавным снижением уровня гликированного гемоглобина (НbА1с), отсутствием увеличения массы тела и низкой частотой гипогликемии (рис. 2). В исследовании ADVANCE эффекты терапии гликлазидом МВ в виде замедления развития нефропатии были обнаружены у пациентов как с высоким, так и с низким уровнем систолического АД. В группе интенсивного контроля на фоне применения гликлазида МВ впервые было продемонстрировано снижение показателей альбуминурии и даже их нормализация.
Исследование ADVANCE в первую очередь подтвердило, что интенсивный контроль гликемии играет важную роль в предотвращении микрососудистых осложнений СД 2 типа. Необходимо отметить, что применение гликлазида МВ позволило безопасно достичь целевого уровня HbA1c у большинства пациентов, независимо от различных факторов, таких как возраст, длительность заболевания, предшествующая сахароснижающая терапия, исходный уровень HbA1c и индекс массы тела.
Более низкий риск развития гипогликемии на фоне терапии гликлазидом по сравнению с глимепиридом был подтвержден и в исследовании GUIDE (3,9% против 8,9%) [21]. Это можно объяснить обратимым взаимодействием гликлазида с бета-клетками.
Сердечно-сосудистая безопасность гликлазида
Положительное влияние гликлазида на сосудистые осложнения СД в первую очередь объясняется его антиоксидантными свойствами: в исследованиях на животных моделях и у людей было продемонстрировано, что терапия гликлазидом снижает уровень малонового альдегида (маркера перекисного окисления липидов) [22, 23]. Причем эти свойства гликлазида МВ [22, 24] обусловлены не только его сахароснижающей эффективностью. Так, при переходе с терапии глибенкламидом на гликлазид через 10 недель у больных отмечалось увеличение уровня супероксиддисмутазы и снижение перекисного окисления липидов при неизменном уровне гликемического контроля [25–28]. Уменьшение окислительного стресса приводит к снижению накопления окисленных липопротеинов низкой плотности (ЛПНП), которые являются субстратом прогрессирования атеросклероза [29, 30].
Положительное влияние гликлазида МВ на микрососудистые изменения можно также объяснить таким механизмом его действия, как cнижение экспрессии LOX-1 (рецепторы к окисленным ЛПНП) и матричных металлопротеаз, экспрессия которых повышена при СД. В свою очередь, увеличение их количества приводит к снижению экспрессии NO-синтазы [31], а следовательно, нарушается эндотелийзависимая вазодилатация. Кроме того, в исследованиях in vitro было доказано обусловленное гликлазидом снижение активации протеинкиназы С, митогенактивируемых протеинкиназ (mitogen-activated protein kinase, MAPK), ядерного фактора каппа В (NF-каппа-B), усиливающих пролиферацию эндотелиальных клеток [25, 32, 33]. В результате отмечается положительное влияние препарата на липидный профиль – снижение уровня ЛПНП и триглицеридов на 14% через 13 недель. Показано также, что на фоне терапии гликлазидом достоверно повышается уровень адипонектина (с 6,4 ± 3,3 до 7,6 ± 4,4 мкг/мл, p < 0,05) [18]. Этим можно объяснить снижение индекса инсулинорезистентности (Homeostasis Model Assessment of Insulin Resistance – гомеостатическая модель оценки резистентности к инсулину, HOMA-IR) у пациентов, получавших гликлазид (снижение не достигло уровня статистической значимости, что, возможно, связано с коротким периодом исследования – 12 недель). На настоящий момент доказано: чем ниже уровень адипонектина, тем выше инсулинорезистентность. Адипонектин, предположительно, воздействует на сосуды, замедляя развитие атеросклероза, за счет снижения адгезии моноцитов, замедления пролиферации и миграции гладкомышечных клеток [34], торможения трансформации макрофагов в пенистые клетки. Механизмом положительного влияния адипонектина на сердечно-сосудистую систему, возможно, служит его обратная корреляция с уровнем С-реактивного белка – независимым фактором прогрессирования атеросклероза. Так, в исследовании с участием 71 пациента с подтвержденными поражениями коронарных артерий и 30 пациентов в контрольной группе было установлено, что высокий уровень С-реактивного белка ассоциируется с низким содержанием адипонектина. Кроме того, была установлена обратная связь между уровнем экспрессии С-реактивного белка и адипонектина в подкожно-жировой клетчатке [35]. Также на фоне терапии гликлазидом было выявлено снижение уровня интерлейкина-6 (ИЛ-6) с 2,5 ± 1,8 до 1,8 ± 1,2 пг/мл (p < 0,05) и фактора некроза опухоли (ФНО) альфа (статистически недостоверное), которое способствует прогрессированию инсулинорезистентности за счет снижения активности инозитол-3-киназы, повышения уровня свободных жирных кислот, уменьшения экспрессии генов GLUT-4 в бета-клетках, в результате чего снижается их секреторная функция. Снижением уровня воспалительных цитокинов можно объяснить и уменьшение концентрации молекул адгезии (intercellular adhesion molecule-1, ICAM-1) на фоне терапии гликлазидом: c 623,12 ± 61,17 до 370,14 ± 49,92 нг/мл [19]. ICAM-1 экспрессируются на сосудистом эндотелии и моноцитах. Основной функцией ICAM-1 является обеспечение адгезии нейтрофилов, моноцитов и лимфоцитов к активированному сосудистому эндотелию с последующей их экстравазацией и миграцией в очаг воспаления.
В настоящий момент известно, что препараты сульфонилмочевины различаются в отношении сердечно-сосудистых рисков, и это можно объяснить их селективностью в отношении КАТФ-зависимых каналов [27], которые делятся на два подтипа: SUR1 и SUR2. Известно, что в кардиомиоцитах и гладкомышечных клетках представлены рецепторы SUR 2A и SUR 2B. Во время ишемии за счет открытия КАТФ-зависимых каналов происходит расслабление гладкомышечной мускулатуры, а следовательно, дилатация сосудов, что уменьшает ишемическое повреждение. На фоне неселективных препаратов сульфонилмочевины эти каналы закрываются, что приводит к нарушению реперфузии миокарда во время ишемии [33, 36, 37]. Гликлазид МВ обладает избирательной чувствительностью к подтипу SUR1, за счет чего не нарушает механизм ишемического прекондиционирования. В исследовании у пациентов с СД 2 типа и стабильной стенокардией перенесенная ишемия на фоне физической нагрузки приводила к увеличению времени, необходимого для возникновения депрессии сегмента ST при повторном тесте на фоне терапии гликлазидом МВ (с 486 до 537 с; p < 0,001), чего не происходило на фоне терапии глибенкламидом [28]. По данным Национального французского регистра пациентов с острым инфарктом миокарда, больные, получавшие до инфаркта миокарда гликлазид, имели более низкую госпитальную летальность (2,9%), чем пациенты, получавшие глибенкламид (7,5%) или инсулинотерапию (9,4%).
В дополнение к эффективному сахароснижающему действию гликлазид (единственный из препаратов сульфонилмочевины), скорее всего за счет антиоксидантной активности, снижает апоптоз бета-клеток [15, 38, 39]. Кроме того, было показано, что гликлазид восстанавливает бета-клетки: при исследовании in vitro выявлено увеличение экспрессии гена PDX-1, который участвует в дифференцировке бета-клеток и маркера пролиферации Кi67 [31]. Этим можно объяснить более позднее начало инсулинотерапии у пациентов, получающих гликлазид. На фоне терапии гликлазидом в течение 4 недель отмечается увеличение концентрации инсулина на прием пищи (рис. 3–5) [40–42].
Приведем клинический пример, иллюстрирующий высокий профиль безопасности сахароснижающей терапии препаратами сульфонилмочевины.
Клинический случай
Пациентка Т., 66 лет, с диагнозом «СД 2 типа» длительно наблюдается на кафедре эндокринологии и диабетологии Российской медицинской академии последипломного образования. Длительность СД – 7 лет, первые 2 из которых женщина контролировала гликемию с помощью диетотерапии, затем была переведена на метформин в дозе 2000 мг/сут. Год назад в связи с неудовлетворительной компенсацией СД к терапии был добавлен гликлазид 30 мг/сут. На фоне терапии гликлазидом уровень НbА1с снизился до 6,4%. По данным суточного мониторирования глюкозы (рис. 6), на фоне хорошей компенсации углеводного обмена, эпизодов гликемии у пациентки не зарегистрировано.
Заключение
В настоящий момент поддержание хронической гипергликемии во избежание гипогликемии представляется необоснованной терапевтической стратегией. Достижение целевых уровней гликемии позволяет снизить риск сердечно-сосудистых осложнений, что было показано во многих крупных исследованиях, в том числе DIGAMI, ADvance и UKPDS. Нет четких доказательств опасности эпизодов легкой гипогликемии при условии сохранной чувствительности к ним, в отсутствие выраженных сосудистых осложнений и при умении правильно купировать первые симптомы гипогликемии. Что касается сердечно-сосудистой безопасности препаратов сульфонилмочевины, отметим: ни одно крупномасштабное исследование не доказало увеличения смертности пациентов на фоне терапии современными препаратами сульфонилмочевины, в том числе после инфаркта миокарда [20, 43, 44] (за исключением исследования UGDP, но в нем использовался препарат первого поколения толбутамид, не применяемый в настоящее время). Более того, имеется большая доказательная база плейотропного эффекта гликлазида при осложнениях СД (рис. 7), эффективности его сахароснижающего действия, нейтральности в отношении массы тела и безопасности.
При назначении препаратов сульфонилмочевины следует учитывать такой аспект, как реакция пациентов на данный вид терапии. Исследование ADOPT показало, что у 34% больных монотерапия препаратами сульфонилмочевины не позволяет достичь гликемического контроля [45]. Это можно объяснить выраженным снижением функции бета-клеток, инсулинорезистентностью, генетическими особенностями, такими как полиморфизм гена CYP2C9*3 (Ile359Leu, ответственного за синтез фермента, участвующего в метаболизме препаратов сульфонилмочевины), KCNJ11 E23K (повышенная активность КАТФ-зависимых каналов), ABCC8(Thr759Thr) (сниженная секреция инсулина), TCF7L2 rs12255372, IRS1 Gly972Arg, NOS1APrs10494366. Максимальный сахароснижающий эффект данной группы препаратов реализуется уже на половине максимальной дозы, и дальнейшего увеличения дозы следует избегать. Кроме того, необходимо учитывать сопутствующую терапию, так как некоторые препараты могут усиливать гликемический эффект сульфонилмочевины, в частности статины – за счет ингибирования ферментов CYP 450 3A4 и CYP 450 29C, которые участвуют в метаболизме препаратов сульфонилмочевины [40].
1. Kyvik K.O., Nystrom L., Gorus F. et al. The epidemiology of type 1 diabetes mellitus is not the same in young adults as in children // Diabetologia. 2004. Vol. 47. № 3. P. 377–384.
2. http://medic.ossn.ru/activity/research/complete/3729/
3. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). UK Prospective Diabetes Study (UKPDS) Group // Lancet. 1998. Vol. 352. № 9131. P. 854–865.
4. Nathan D.M., Cleary P.A., Backlund J.Y. et al. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes // N. Engl. J. Med. 2005. Vol. 353. № 25. P. 2643–2653.
5. Patel A., MacMahon S., Chalmers J. et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes // N. Engl. J. Med. 2008. Vol. 358. № 24. P. 2560–2572.
6. Ohkubo Y., Kishikawa H., Araki E. et al. Intensive insulin therapy prevents the progression of diabetic microvascular complications in Japanese patients with non-insulin-dependent diabetes mellitus: a randomized prospective 6-year study // Diabetes Res. Clin. Pract. 1995. Vol. 28. № 2. P. 103–117.
7. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group // Lancet. 1998. Vol. 352. № 9131. P. 837–853.
8. Bagg W. Cardiac and endothelial function is unaffected by short-term intensive glycaemic control in patients with type-2 diabetes mellitus // Int. Med. J. 2001. Vol. 31. № 4. P. A1. Abstr.
9. Abraira C., Colwell J.A., Nuttall F.Q. et al. Veterans Affairs Cooperative Study on glycemic control and complications in type II diabetes (VA CSDM): results of the feasibility trial // Diabetes Care. 1995. Vol. 18. № 8. P. 1113–1123.
10. Zoungas S., Patel A., Chalmers J. et al. Severe hypoglycemia and risks of vascular events and death // N. Engl. J. Med. 2010. Vol. 363. № 15. P. 1410–1418.
11. Turnbull F.M., Abraira С., Anderson R.J. et al. Intensive glucose control and macrovascular outcomes in type 2 diabetes // Diabetologia. 2009. Vol. 52. № 11. P. 2288–2298.
12. Szabo T., Geller L., Merkely B. et al. Investigating the dual nature of endothelin-1: ischemia or direct arrhythmogenic effect? // Life Sci. 2000. Vol. 66. № 26. P. 2527–2541.
13. Bell D.S. Ded in bed syndrome – a hypothesis // Diabetes Obes. Metab. 2006. Vol. 8. № 3. P. 261–263.
14. Lee S.P., Yeoh L., Harris N.D. et al. Influence of autonomic neuropathy on QTc interval lengthening during hypoglycemia in type 1 diabetes // Diabetes. 2004. Vol. 53. № 6. P. 1535–1542.
15. Maedler K., Carr R.D., Bosco D. et al. Sulfonylurea induced beta-cell apoptosis in cultured human islets // J. Clin. Endocrinol. Metab. 2005. Vol. 90. № 1. P. 501–506.
16. Strachan M.W., Deary I.J., Ewing F.M., Frier B.M. Recovery of cognitive function and mood after severe hypoglycemia in adults with insulin-treated diabetes // Diabetes Care. 2000. Vol. 23. № 3. P. 305–312.
17. Woodward M., Patel A., Zoungas S. et al. Does glycemic control offer similar benefits among patients with diabetes in different regions of the world? Results from the ADVANCE trial // Diabetes Care. 2011. Vol. 34. № 12. P. 2491–2495.
18. Drzewoski J., Zurawska-Klis M. Effect of gliclazide modified release on adiponectin, interleukin-6, and tumor necrosis factor-alpha plasma levels in individuals with type 2 diabetes mellitus // Curr. Med. Res. Opin. 2006. Vol. 22. № 10. P. 1921–1926.
19. Papanas N., Tziakas D., Chalikias G. et al. Gliclazide treatment lowers serum ICAM-1 levels in poorly controlled type 2 diabetic patients // Diabetes. Metab. 2006. Vol. 32. № 4. P. 671–674.
20. Patel A., MacMahon S., Chalmers J. et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes // N. Engl. J. Med. 2008. Vol. 358. № 24. P. 2560–2572.
21. Schernthaner G., Grimaldi A., Di Mario U. et al. GUIDE study: double-blind comparison of once-daily gliclazide MR and glimepiride in type 2 diabetic patients // Eur. J. Clin. Invest. 2004. Vol. 34. № 8. P. 535–542.
22. O’Brien R.C., Luo M., Balazs N., Mercuri J. In vitro and in vivo antioxidant properties of gliclazide // J. Diabetes Complications. 2000. Vol. 14. № 4. P. 201–206.
23. Sliwinska A., Blasiak J., Kasznicki J., Drzewoski J. In vitro effect of gliclazide on DNA damage and repair in patients with type 2 diabetes mellitus (T2DM) // Chem. Biol. Interact. 2008. Vol. 173. № 3. P. 159–165.
24. Jennings P.E., Belch J.J. Free radical scavenging activity of sulfonylureas: a clinical assessment of the effect of gliclazide // Metabolism. 2000. Vol. 49. № 2. Suppl. 1. P. 23–26.
25. Chen L.L., Yu F., Zeng T.S. et al. Effects of gliclazide on endothelial function in patients with newly diagnosed type 2 diabetes // Eur. J. Pharmacol. 2011. Vol. 659. № 2–3. P. 296–301.
26. Renier G., Mamputu J.C., Serri O. Benefits of gliclazide in the atherosclerotic process: decrease in monocyte adhesion to endothelial cells // Metabolism. 2003. Vol. 52. № 8. Suppl. P. 13–18.
27. Schramm T.K., Gislason G.H., Vaag A. et al. Mortality and cardiovascular risk associated with different insulin secretagogues compared with metformin in type 2 diabetes, with or without a previous myocardial infarction: a nationwide study // Eur. Heart. J. 2011. Vol. 32. № 15. P. 1900–1908.
28. Bilinska M., Potocka J., Korzeniowska-Kubacka I., Piotrowicz R.‘Warm-up’ phenomenon in diabetic patients with stable angina treated with diet or sulfonylureas // Coron. Artery Dis. 2007. Vol. 18. № 6. P. 455–462.
29. Keaney J.F. Jr., Guo Y., Cunningham D. et al. Vascular incorporation of alpha-tocopherol prevents endothelial dysfunction due to oxidized LDL by inhibiting protein kinase C stimulation // J. Clin. Invest. 1996. Vol. 98. № 2. P. 386–394.
30. Mehta A., Yang B., Khan S. et al. Oxidized low-density lipoproteins facilitate leukocyte adhesion to aortic intima without affecting endothelium-dependent relaxation. Role of P-selectin // Arterioscler. Thromb. Vasc. Biol. 1995. Vol. 15. № 11. P. 2076–2083.
31. Del Guerra S., Grupillo M., Masini M. et al. Gliclazide protects human islet beta-cells from apoptosis induced by intermittent high glucose // Diabetes. Metab. Res. Rev. 2007. Vol. 23. № 3. P. 234–238.
32. Mamputu J.C., Renier G. Signalling pathways involved in retinal endothelial cell proliferation induced by advanced glycation end products: inhibitory effect of gliclazide // Diabetes Obes. Metab. 2004. Vol. 6. № 2. P. 95–103.
33. Scognamiglio R., Negut C., De Kreutzenberg S.V. et al. Postprandial myocardial perfusion in healthy subjects and in type 2 diabetic patients // Circulation. 2005. Vol. 112. № 2. P. 179–184.
34. Сhandran M., Phillips S.A., Ciaraldi T., Henry R.R. Adiponectin; more than just another fat cell hormone? // Diabetes Care. 2003. P. 2442–2450.
35. Ouchi N., Kihara S., Funahashi T. et. al. Reciprocal association of C-reactive protein with adiponectin in blood stream and adipose tissue // Circulation. 2003. Vol. 107. № 5. P. 671–674.
36. Kristiansen S.B., Lofgren B., Nielsen J.M. et al. Comparison of two sulfonylureas with high and low myocardial K(ATP) channel affinity on myocardial infarct size and metabolism in a rat model of type 2 diabetes // Diabetologia. 2011. Vol. 54. № 2. P. 451–458.
37. Loubani M., Fowler A., Standen N.B., Galinanes M. The effect of gliclazide and glibenclamide on preconditioning of the human myocardium // Eur. J. Pharmacol. 2005. Vol. 515. № 1–3. P. 142–149.
38. Saravanan G., Ponmurugan P. Beneficial effect of S-allylcysteine (SAC) on blood glucose and pancreatic antioxidant system in streptozotocin diabetic rats // Plant. Foods Hum. Nutr. 2010. Vol. 65. № 4. P. 374–378.
39. Satoh J., Takahashi K., Takizawa Y. et al. Secondary sulfonylurea failure: comparison of period until insulin treatment between diabetic patients treated with gliclazide and glibenclamide // Diabetes Res. Clin. Pract. 2005. Vol. 70. № 3. P. 291–297.
40. Sultanpur C., Satyanarayana S., Reddy N. et al. Drug-drug interaction between pravastatin and gemfibrozil (antihyperlipidemic) with gliclazide (antidiabetic) in rats // J. Young Pharm. 2010. Vol. 2. № 2. P. 152–155.
41. Zhang H., Bu P., Xie Y.H. et al. Effect of repaglinide and gliclazide on glycaemic control, early-phase insulin secretion and lipid profiles in // Chin. Med. J. (Engl.). 2011. Vol. 124. № 2. P. 172–176.
42. Gregorio F., Ambrosi F., Cristallini S. et al. Therapeutical concentrations of tolbutamide, glibenclamide, gliclazide and gliquidone at different glucose levels: in vitro effects on pancreatic A- and B-cell function // Diabetes Res. Clin. Pract. 1992. Vol. 18. № 3. P. 197–206.
43. Brady P.A., Al-Suwaidi J., Kopecky S.L., Terzic A. Sulfonylureas and mortality in diabetic patients after myocardial infarction // Circulation. 1998. Vol. 97. № 7. P. 709–710.
44. Mellbin L.G., Malmberg K., Norhammar A. et al. The impact of glucose lowering treatment on long-term prognosis in patients with type 2 diabetes and myocardial infarction: a report from the DIGAMI 2 trial // Eur. Heart. J. 2008. Vol. 29. № 2. P. 166–176.
45. Kahn S.E., Haffner S.M., Heise M.A. et al. Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy // N. Engl. J. Med. 2006. Vol. 355. № 23. P. 2427–2443.
Cardiovascular risk and optimization of type 2 diabetes therapy
A.S. Ametov, N.A. Chernikova, Ye.A. Yermakova
State Budgetary Educational Institution for Continuing Professional Education ‘Russian Medical Academy of Postgraduate Education’, Endocrinology and Diabetology Department
Contact person: Nataliya Albertovna Chernikova, nachendoc@yandex.ru
The authors discuss suitability of therapeutic strategy of maintaining chronic low hyperglycemia to avoid hypoglycemic episodes during the treatment with sulfonylureas. Using the example of modified release gliclazide the authors have demonstrated that therapy with modern sulfonylureas was not associated with increased risk of adverse cardiovascular outcomes and death. Nevertheless, during therapy choice individual characteristics of the patient should be considered including preserved awareness of hypoglycaemia, presence of significant vascular complications, function of beta-cells, concomitant therapy, etc.
Новости на тему
02.02.2024
01.02.2023
23.08.2022 01:00:00
01.07.2022 11:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.