Восстановление фертильности у пациенток с нормогонадотропной овуляторной дисфункцией и ожирением
- Аннотация
- Статья
- Ссылки
- English
Цель наблюдательного исследования – оценить эффективность двухэтапной программы восстановления фертильности у женщин с ожирением, включающей снижение массы тела и стимуляцию яичников.
Материал и методы. В исследование были включены 64 женщины с бесплодием, обусловленным олигоменореей/ановуляцией, и ожирением. Всем женщинам выполнено комплексное обследование с оценкой клинических характеристик, параметров жирового и углеводного обменов и гормонального профиля крови. На первом этапе исследования терапевтическая модификация образа жизни сопровождалась приемом метформина. На втором этапе проводилась стимуляция яичников с последовательным использованием селективного модулятора эстрогеновых рецепторов, ингибитора ароматазы и гонадотропинов на фоне применения метформина.
Результаты. Редукция массы тела на 9,8% в течение шести месяцев первого этапа исследования сопровождалась достоверным улучшением показателей жирового и углеводного обменов, а также снижением выраженности гиперандрогенемии. В результате регулярный менструальный ритм восстановился у 32,8%, спонтанная беременность наступила у 28,1% женщин. Стимуляция яичников кломифена цитратом способствовала восстановлению овуляции у 71,7% и наступлению беременности у 54,3% пациенток. Применение летрозола ассоциировалось с наступлением беременности у 53,8% женщин, гонадотропинов – у 62,5% кломифен-резистентных пациенток.
Заключение. Редукция массы тела на этапе прегравидарной подготовки способствует наступлению спонтанной беременности и улучшает исходы стимуляции яичников у женщин с ожирением.
Цель наблюдательного исследования – оценить эффективность двухэтапной программы восстановления фертильности у женщин с ожирением, включающей снижение массы тела и стимуляцию яичников.
Материал и методы. В исследование были включены 64 женщины с бесплодием, обусловленным олигоменореей/ановуляцией, и ожирением. Всем женщинам выполнено комплексное обследование с оценкой клинических характеристик, параметров жирового и углеводного обменов и гормонального профиля крови. На первом этапе исследования терапевтическая модификация образа жизни сопровождалась приемом метформина. На втором этапе проводилась стимуляция яичников с последовательным использованием селективного модулятора эстрогеновых рецепторов, ингибитора ароматазы и гонадотропинов на фоне применения метформина.
Результаты. Редукция массы тела на 9,8% в течение шести месяцев первого этапа исследования сопровождалась достоверным улучшением показателей жирового и углеводного обменов, а также снижением выраженности гиперандрогенемии. В результате регулярный менструальный ритм восстановился у 32,8%, спонтанная беременность наступила у 28,1% женщин. Стимуляция яичников кломифена цитратом способствовала восстановлению овуляции у 71,7% и наступлению беременности у 54,3% пациенток. Применение летрозола ассоциировалось с наступлением беременности у 53,8% женщин, гонадотропинов – у 62,5% кломифен-резистентных пациенток.
Заключение. Редукция массы тела на этапе прегравидарной подготовки способствует наступлению спонтанной беременности и улучшает исходы стимуляции яичников у женщин с ожирением.
Ожирение широко распространено в популяции и связано с многочисленными нарушениями в организме, среди которых особое место занимает репродуктивная дисфункция [1]. Ожирение рассматривается как хроническое заболевание и характеризуется комплексом метаболических расстройств, которые могут стать основной причиной нарушения функций репродуктивной системы. Примерно у 40% лиц ожирение не сопровождается альтерациями углеводного и жирового обменов [2], тем не менее влечет за собой нарушения в репродуктивной системе, что указывает на роль избытка жировой ткани в развитии эндокринных нарушений репродуктивной оси. Ключевыми факторами подобных нарушений считаются гиперандрогенемия, ановуляция и формирование поликистозных яичников [3–5].
Высокая распространенность олиго-/ановуляции среди пациенток с ожирением определяет актуальность проблемы восстановления у них фертильности, обычно разрешаемой в два этапа. На первом этапе выполняется редукция массы тела, далее проводится стимуляция яичников [6]. В лечении ожирения первостепенное значение имеет модификация образа жизни. Но, к сожалению, добиться необходимого для нормализации метаболических параметров снижения веса только с помощью диеты и физических упражнений удается далеко не всегда. Поэтому на этапе прегравидарной подготовки к лечению рекомендуют подключать средства, направленные на коррекцию нарушенного углеводного и жирового обменов, с доказанным потенциалом в отношении восстановления овуляторного менструального цикла.
Лекарственные препараты, улучшающие чувствительность тканей к инсулину, считаются одним из базовых методов лечения синдрома поликистозных яичников (СПКЯ), часто сочетающегося с избытком массы тела [7]. С помощью таких препаратов можно также добиться восстановления овуляции и повысить шансы на наступление беременности [8]. Именно для стимуляции яичников инсулиносенситайзеры чаще используются вместе с кломифена цитратом, хотя каждый из методов имеет самостоятельную ценность в осуществлении программы восстановления фертильности. Помимо указанных средств стимуляция яичников при нормогонадотропной ановуляции предполагает использование ингибиторов ароматазы и гонадотропинов [9]. Однако эффективность перечисленных методов обычно обсуждается в контексте терапии ановуляторного бесплодия у больных СПКЯ, реже в отношении пациенток с ожирением.
Цель настоящего исследования – оценить эффективность двухэтапной программы восстановления фертильности у женщин с ожирением, включающей снижение массы тела и стимуляцию яичников.
Материал и методы
В исследовании участвовали 64 женщины в возрасте 20–35 лет (средний возраст – 27,6 ± 3,2 года), обратившиеся к гинекологу по поводу бесплодия. Критерии включения:
- отсутствие беременности при регулярной половой жизни в отсутствие контрацептивных средств в течение года и более;
- олиго-/ановуляция (менее девяти менструаций в течение года или отсутствие овуляции в течение двух последовательных менструальных циклов, подтвержденной уровнем прогестерона и/или результатами ультразвукового мониторинга);
- индекс массы тела (ИМТ) ≥ 30 кг/м2;
- нормальные показатели спермограммы супруга.
Из исследования исключались пациентки с некомпенсированными нарушениями функции щитовидной железы, гиперпролактинемией, неклассическими формами врожденной гиперплазии коры надпочечников и другими эндокринными заболеваниями, кроме СПКЯ.
Клинические характеристики менструального цикла оценивали за шестимесячный период до включения в исследование и через шесть месяцев после его окончания по следующим параметрам:
- длительность межменструальных промежутков (применительно к пациенткам с олигоменореей);
- число дней кровотечения/кровомазанья (применительно к пациенткам с аномальными кровотечениями).
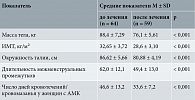
Обследование пациенток проводили в течение месяца на этапе скрининга и на шестом месяце исследования. Клинико-анамнестический метод помимо рутинного сбора анамнеза и осмотра включал определение антропометрических показателей с подсчетом ИМТ и характера ожирения. Об ожирении говорили при ИМТ ≥ 30 кг/м2 (1-я степень – 30–34,9 кг/м2, 2-я – 35–39,9 кг/м2, 3-я – 40 кг/м2 и выше). Висцеральное ожирение имело место при величине окружности талии более 80 см. Гирсутизм оценивали по модифицированной шкале Ферримана – Голлвея и устанавливали при значении гирсутного числа более 8 баллов.
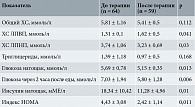
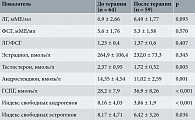
Лабораторное исследование включало оценку параметров углеводного и жирового обменов – концентрации в плазме крови инсулина, глюкозы натощак и через два часа после стандартной нагрузки, общего холестерина (ХС), ХС липопротеинов высокой плотности (ЛПВП), ХС липопротеинов низкой плотности (ЛПНП), триглицеридов; гормональное исследование – концентрации лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов, общего тестостерона, андростендиона, эстрадиола, глобулина, связывающего половые гормоны (ГСПГ), в крови на 3–4-й день спонтанного или индуцированного прогестероном менструального кровотечения. При интерпретации полученных данных подсчитывали индекс НОМА, косвенно отражающий инсулинорезистентность (глюкоза × инсулин : 22,5), индексы свободных андрогенов (тестостерон × 100 : ГСПГ) и эстрогенов (эстрадиол : ГСПГ). Ультразвуковое исследование (УЗИ) органов малого таза проводили методом трансвагинального ультразвукового сканирования на аппарате Aloka SSD-2000 с использованием датчика с частотой 7,5 мГц.
На первом этапе в течение шести месяцев всем пациенткам было проведено лечение, направленное на нормализацию массы тела и метаболических показателей с помощью модификации образа жизни и приема метформина в суточной дозе 2000 мг. На втором этапе при продолжении приема метформина выполняли стимуляцию яичников кломифена цитратом в дозе 50/100/150 мг. Препарат первоначально назначали в дозе 50 мг в течение пяти дней с 3–5-го дня цикла. При отсутствии овуляторного ответа дозу увеличивали на 50 мг в каждом последующем цикле до максимальной дозы 150 мг. Длительность приема кломифена не превышала шести циклов. Пациенткам, не ответившим на терапию кломифеном, проводили стимуляцию яичников летрозолом или рекомбинантным ФСГ.
Статистическую обработку данных осуществляли по общепринятым методикам с использованием компьютерных программ Microsoft Exel, Biostat, STATISTICA 6.0 for Windows. Определяли средний показатель (М), стандартное отклонение (SD). Для проверки на нормальность распределения использовали критерий Шапиро – Уилка. Сравнительный анализ средних тенденций в выборках с нормальным распределением выполняли с помощью t-критерия Стьюдента, при ненормальном распределении применяли непараметрический метод Манна – Уитни. Различия считались достоверными при уровне значимости 0,05.
Результаты
Ожирение 1-й степени зафиксировано у 49 (76,6%) женщин, 2-й степени – у 17 (23,4%). Случаев морбидного ожирения не зарегистрировано. Висцеральный тип распределения жира наблюдался у 46 (71,2%) пациенток.
Длительность бесплодия составила в среднем 3,2 ± 1,4 года. Нарушения ритма менструаций до проведения лечения отмечались у всех пациенток, в 47 (73,4%) случаях они носили характер олигоменореи, в 17 (26,6%) – аномальных маточных кровотечений (АМК). Гирсутизм диагностирован у 16 (25%) обследованных пациенток. Предварительная оценка гормонального профиля крови выявила гиперандрогенемию у 56 (87,5%) пациенток: 16/56 (28,6%) женщин имели повышенный уровень ОХ (3,8 ± 2,3 нмоль/л), 40/56 (71,4%) – сниженный уровень ГСПГ (19,4 ± 13,9 нмоль/л) при нормальном/высоком уровне тестостерона.
Исходя из критериев диагностики СПКЯ, предположительно этот диагноз имел место у 93,75% пациенток. Но поскольку ожирение является одним из состояний, требующих дифференциальной диагностики с СПКЯ, окончательное заключение о наличии первичного эндокринного нарушения репродуктивной оси не выносили.
На фоне соблюдения диеты и приема метформина за шесть месяцев масса тела в среднем снизилась на 9,8 ± 6,5%. Антропометрические параметры до и после первого этапа лечения представлены в табл. 1. К завершению первого этапа исследования отмечалось существенное улучшение параметров менструального цикла: сокращение продолжительности межменструальных промежутков у больных олигоменореей, уменьшение числа дней кровотечений у пациенток с АМК (табл. 1). При выполнении УЗИ органов малого таза после окончания комплекса прегравидарной подготовки зафиксировано уменьшение среднего объема яичников от 11,85 ± 5,74 до 7,93 ± 2,06 см3 (p < 0,001). В результате проведенных мероприятий по снижению веса и коррекции метаболических параметров у 21 (32,8%) пациентки восстановился регулярный овуляторный менструальный цикл (овуляция зарегистрирована в двух последовательных циклах), у 5/21 (23,8%) наступила спонтанная беременность. Повторные лабораторные исследования параметров метаболизма и гормонального статуса у забеременевших пациенток не проводились.
Улучшение клинических показателей сопровождала положительная динамика параметров жирового и углеводного обменов (табл. 2), которая заключалась в достоверной редукции уровней ХС ЛПНП (р = 0,03) с одновременным увеличением содержания ХС ЛПВП (р = 0,041), а также снижении уровней глюкозы (р = 0,013), инсулина (р = 0,01) и индекса НОМА (р = 0,011). Позитивные изменения гормонального профиля (табл. 3) характеризовались достоверным снижением концентраций андростендиона (р = 0,001) и тестостерона (р = 0,005) в крови и существенным ростом концентрации ГСПГ (p < 0,001), что создало условия для редукции индексов свободных андрогенов (p < 0,001) и эстрогенов (р = 0,034).
На следующем этапе на фоне применения метформина и витаминно-минерального комплекса 16 пациенткам с восстановившейся спонтанной овуляцией был рекомендован прием препаратов прогестерона (200 мг вагинально) во второй фазе менструального цикла – со 2-го дня после положительного теста на овуляцию и вплоть до наступления менструации или при задержке менструации, в случае отрицательного теста на беременность. При положительном тесте на беременность через 14–16 дней после предполагаемой овуляции применение вагинального прогестерона следовало продолжить. Наблюдение за пациентками осуществлялось в течение шести месяцев. За этот период спонтанная беременность наступила у 13/59 (22,03%) пациенток. Три женщины, у которых овуляция возникала нерегулярно, через шесть месяцев были включены в группу стимуляции яичников.
Стимуляция яичников выполнялась с помощью комбинации метформина и кломифена цитрата. В результате лечения овуляция была достигнута у 33/46 (71,7%) пациенток, беременность наступила у 25/33 (75,8%) женщин, ответивших на стимуляцию. Возможной причиной отсутствия беременности при хорошем ответе яичников на стимуляцию у восьми пациенток был недостаточный рост эндометрия, несмотря на добавление эстрогенов с 9-го дня менструального цикла.
Резистентность к кломифену установлена у 13/46 (28,3%) больных. Клинико-лабораторные особенности этой группы пациенток заключались в достоверном (р < 0,05) увеличении объема яичников (11,4 ± 1,7 см³) по сравнению с кломифен-чувствительными больными (9,64 ± 0,7 см³). У всех пациенток, не ответивших на кломифен, диагностирован СПКЯ. Уровни ЛГ (15,3 ± 4,2 МЕ/л) и тестостерона (3,1 ± 1,6 нмоль/л) у них были достоверно выше, чем у тех, у кого применение кломифена вызвало овуляцию (р < 0,05).
21 пациентке с неудачей стимуляции яичников кломифена цитратом при продолжении приема метформина назначали летрозол (13 женщин с резистентностью к кломифену) и рекомбинантный ФСГ (восемь женщин с недостаточным ростом эндометрия). Овуляция достигнута у 8/13 (61,5%) пациенток, принимавших летрозол, беременность наступила у 7/13 (53,8%). У женщин, получавших гонадотропин, овуляция наступила у 8/8 (100%), беременность – у 5/8 (62,5%). Девять женщин с неудачей стимуляции яичников направлены на программы вспомогательных репродуктивных технологий.
Обсуждение
Отрицательное влияние ожирения на репродуктивную функцию хорошо известно [10]. Избыток жировой ткани связан с инсулинорезистентностью, нарушением стероидогенеза и циклической продукции гонадотропинов, что приводит к овуляторной дисфункции и снижению фертильности [11]. Ожирение может быть независимым фактором нарушений менструального цикла и бесплодия, но избыточная масса тела и ожирение также часто сопровождают СПКЯ, усугубляя его течение [5, 12]. Следует отметить, что ожирение является одним из заболеваний, которые необходимо исключить как причину гиперандрогенизма и ановуляторной дисфункции, прежде чем устанавливать диагноз СПКЯ. Однако независимо от того, является ли избыточный вес прямой причиной нарушений функций репродуктивной системы или рассматривается как коморбидность по отношению к СПКЯ [13], он значительно ухудшает прогноз лечения СПКЯ [3]. В частности, результаты стимуляции яичников у больных СПКЯ с ожирением хуже, чем у пациенток с нормальной массой тела. Больным СПКЯ с ожирением чаще требуются большие дозы препаратов, а благополучные исходы беременности у них наблюдаются реже [14].
Снижение массы тела и коррекцию показателей метаболизма принято считать первым этапом лечения пациенток с олиго-/ановуляцией и субфертильностью, страдающих ожирением [15]. В редукции веса первостепенное значение имеет модификация образа жизни, в том числе физические упражнения и диета. Фармакотерапия присоединятся в случае недостаточной эффективности модификации образа жизни (уменьшение веса менее чем на 5% от исходного уровня за три месяца), неоднократных безуспешных попыток редукции веса, коморбидности или наследственной предрасположенности к сахарному диабету 2-го типа, сердечно-сосудистых заболеваний (ССЗ), а также при совокупности факторов высокого риска ССЗ.
Рациональное питание у больных с олиго-/ановуляцией на фоне ожирения, особенно при СКПЯ, предусматривает ограничение потребления легкоусвояемых углеводов, что позволяет снизить уровень инсулинорезистентности [16]. Применение метформина имеет дополнительное позитивное действие, повышая чувствительность тканей к инсулину, осуществляя антиандрогенный эффект и улучшая условия для фолликулогенеза и овуляции.
Снижение массы тела на прегравидарном этапе позволяет добиться клинически значимого эффекта по восстановлению менструального цикла [5]. Исходя из полученных данных, можно предположить, что эндокринной основой сокращения межменструальных промежутков является снижение уровней и биоактивности андрогенов, а устранения АМК – редукция индекса свободных эстрогенов благодаря росту концентрации ГСПГ (табл. 1 и 3).
Независимо от сопутствующей эндокринной патологии уменьшение массы тела сопровождается достоверным повышением шансов на наступление беременности и рождение ребенка [17].
Метформин давно включается в схемы подготовки к беременности и стимуляции овуляции у больных СПКЯ, особенно при наличии инсулинорезистентности и гиперинсулинемии [6, 7, 14]. Эту модель лечения с полным основанием можно интегрировать в схему терапии эндокринного бесплодия, ассоциированного с ожирением, поскольку избыток висцерального жира связан с теми же метаболическими альтерациями, приводящими к вторичной поликистозной трансформации яичников и гиперандрогенемии.
Эффективность стимуляции яичников во многом определяется верным выбором метода. Как известно, ряд женщин с СПКЯ проявляет резистентность к кломифена цитрату, что требует более тщательного отбора кандидатов на использование определенного средства стимуляции яичников первой линии. Повышенный уровень ЛГ, тестостерона, низкий уровень ГСПГ, увеличение объема яичников рассматриваются как прогностически неблагоприятные факторы, отражающие снижение чувствительности к кломифена цитрату при СПКЯ [18]. Результаты данного исследования также демонстрируют зависимость ответа репродуктивной системы на стимуляцию яичников от перечисленных показателей. Согласно полученным данным, при сохранении после подготовительного этапа повышенного уровня ЛГ и гиперандрогенемии в совокупности с большим объемом яичников использование летрозола в первой линии терапии может быть предпочтительным.
Заключение
Успех восстановления фертильности у женщин с ожирением определяется множеством факторов. Первоочередной задачей представляется снижение веса перед планированием зачатия. Препараты, предназначенные для коррекции метаболических расстройств, улучшают прогноз в отношении наступления беременности как у женщин с нарушениями менструального цикла, ассоциированными с ожирением, так и у больных СПКЯ с избыточной массой тела.
Для пациенток с ожирением терапевтическая модификация образа жизни одновременно с приемом метформина может быть достаточной для спонтанного восстановления фертильности. У женщин с СПКЯ программа снижения веса и улучшения метаболических параметров должна предварять стимуляцию яичников.
Несмотря на то что кломифена цитрат сохраняет позиции терапии первой линии стимуляции яичников, накопившиеся к настоящему времени данные позволяют говорить о преимуществах летрозола в отношении частоты наступления беременности и живорождения. Однако отсутствие у ингибиторов ароматазы заявленного показания для терапии бесплодия ограничивает применение летрозола и предполагает его назначение только в случае резистентности к кломифену. Данная позиция требует пересмотра.
Дальнейшие исследования в области восстановления фертильности у женщин с ожирением призваны помочь определить наиболее эффективные мероприятия по достижению клинически значимого исхода – рождения здорового ребенка.
I.V. Kuznetsova, PhD, Prof., D.O. Fernandes, PhD, Ye.A. Gavrilova, E.R. Vedzizheva, PhD
Academician V.I. Kulakov National Medical Research Center of Obstetrics, Gynecology and Perinatology
Rehabilitation center ‘Preodoleniye’, Moscow
N.V. Sklifosovsky Institute of Clinical Medicine of I.M. Sechenov First Moscow State Medical University
D.D. Pletnev City Clinical Hospital № 57, Moscow
Contact person: Elina R. Vedzizheva, elina_vedzizheva@mail.ru
Obesity has the significant negative impact on a woman's reproductive system, often being an independent cause of menstrual disorders and decreased fertility or aggravating the course of endocrine gynecological diseases.
The aim of the observational study was to evaluate the effectiveness of a two-stage fertility recovery program in obese women, including weight loss and ovarian stimulation.
Material and methods. The study included 64 women with infertility due to oligo-/anovulation and obesity. All women underwent a comprehensive examination with an assessment of clinical characteristics, parameters of fat and carbohydrate metabolism and hormonal blood profile. At the first stage of the study, therapeutic lifestyle modification was accompanied by metformin. At the second stage, ovarian stimulation was performed with the sequential use of a selective estrogen receptor modulator, an aromatase inhibitor and gonadotropins against the background of metformin.
Results. The reduction of body weight by 9.8% during the six months of the first stage of the study was accompanied by a significant improvement in the indicators of fat and carbohydrate metabolism, as well as a decrease in the severity of hyperandrogenemia. As a result, the regular menstrual rhythm was restored in 32.8%, spontaneous pregnancy occurred in 28.1% of women. Stimulation of the ovaries with clomiphene citrate contributed to the restoration of ovulation in 71.7% and the onset of pregnancy in 54.3% of patients. The use of letrozole was associated with the onset of pregnancy in 53.8% of women, gonadotropins - in 62.5% of clomiphene-resistant patients.
Conclusion. Reduction of body weight at the stage of pre-pregnancy preparation contributes to the onset of spontaneous pregnancy and improves the outcomes of ovarian stimulation in obese women.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.