Возможна ли профилактика атеросклероза препаратами кальция и витамина D3?
- Аннотация
- Статья
- Ссылки


Вопрос, вынесенный в заголовок данной статьи, может показаться нелепым. Общеизвестно, что «кальций откладывается на стенках сосудов». При упрощенном взгляде из этой аксиомы вытекают абсурдные выводы: «кальций опасен для артерий», «кальций вызывает кальцификацию плаценты» и т.п. Другое, не менее «логическое» умозаключение: «витамин D3 – синергист кальция, кальций опасен, следовательно, витамин D3 тоже опасен!». Дальнейшее развитие этого «рассуждения» приводит к еще более «блестящим» выводам: «все витамины опасны», «препараты витамина D3 приводят к зарастанию родничков», «беременным не надо витаминов», «магний и кальций – какая разница?!» и др. К сожалению, такого рода «дикарская логика» встречается достаточно часто не только в публичных выступлениях некоторых деятелей от медицины, но даже и в научных статьях. Совершенно ясно, что реальная ситуация намного сложнее, чем это кажется при таком тривиальном подходе.
Вот уже более века прошло с тех пор, как врачи заметили, что у пациентов с остеопорозом чаще встречаются сосудистые заболевания, в том числе атеросклероз и кальцификация артерий. Ежедневная клиническая практика показывает: пациенты, госпитализированные с переломами вследствие остеопороза, гораздо чаще, чем пациенты без остеопороза, страдают от сосудистых заболеваний (инфаркт миокарда, инсульт [1]). Остеопороз связан с потерями кальция костной тканью, гиподинамией, возрастным снижением уровней стероидных гормонов, нарушениями всасывания кальция вследствие дисбиозов и процессов старения слизистой ЖКТ, нарушений функции печени и т.д. Клинические исследования демонстрируют: остеопороз успешно профилактируется и лечится сочетанным приемом кальция и витамина D3, которые значительно уменьшают риск переломов бедра [2]. В то же время атеросклероз характеризуется нарушениями липидного обмена и накоплением нерастворимого осадка кристаллического фосфата кальция на атеросклеротических бляшках даже на ранних стадиях атеросклеротических поражений [3–5].
Следует отметить, что у лиц пожилого возраста по мере развития остеопороза отмечается параллельное усиление проявлений атеросклероза [6, 7]. Часто принято рассматривать остеопороз и атеросклероз у одного и того же пациента как независимые друг от друга процессы. При этом упускается из виду, что на уровне тканей оба процесса стартуют практически одновременно и всегда включают значительные нарушения обмена и кальция, и витамина D3. Крупномасштабные клинические исследования [8–10], в том числе результаты 25-летних наблюдений за Фрамингемской когортой [10], указывают на неоспоримую связь между кальцификацией артерий и остеопорозом как у женщин, так и мужчин. Например, крупномасштабное исследование толщины стенки интимы и плотности люмбарных костей у 2000 человек показало, что толщина стенки интимы (показатель прогрессии атеросклероза) обратно пропорциональна плотности костей (отражающей состояние кальциевого депо организма, p < 0,02) [9].
В данной статье вопрос о взаимосвязи кальция, витамина D3, остеопороза и атеросклероза рассматривается на основе фундаментальных исследований в области молекулярной биологии и биохимии с использованием данных эпидемиологии, клинической и экспериментальной фармакологии и доказательной медицины.
Кальций и атеросклероз
Как любой микронутриент, кальций необходим организму в строго определенном количестве, в физиологических дозах. Изменение физиологически необходимого количества потребления кальция и его синергиста витамина D3 – как снижение, так и увеличение – приводит к патологии. Именно поэтому с точки зрения риска развития атеросклероза кальций, несомненно, играет двойственную роль.
С одной стороны, повышенные уровни фосфата и кальция в плазме крови увеличивают риск ИБС, инсульта и смертности. Исследование ARIC (Atherosclerosis Risk in Communities), проводившееся в течение более 10 лет и включившее наблюдения за когортой из 15 700 человек, подтвердило, что повышенные уровни кальция (ОШ 1,16; 95% ДИ 1,07–1,26, p = 0,0005) и фосфата (ОШ 1,11; 95% ДИ 1,02–1,21; p = 0,02) в плазме являются факторами риска этих заболеваний [11]. Как правило, в эпидемиологических исследованиях степень коронарной кальцификации определяется при многослойной томографии как сумма баллов по шкале CAC (coronary artery calcium). Результаты эпидемиологических исследований показывают, что более высокие значения этого параметра соответствуют повышенному риску ИБС [12, 13].
С другой стороны, те же крупномасштабные исследования свидетельствуют: избыток кальция – не единственный фактор риска атеросклероза [14, 15]. Исследование MESA (Multi-Ethnic Study of Atherosclerosis) [14] включило наблюдения за когортой из 5880 участников 45–84 лет, каждый из которых прошел компьютерную томографию аорты. Факторами риска кальцификации аорты являлись индекс массы тела, курение, использование антилипидных и антигипертонических препаратов. Действительно, степень накопления кальция на стенках аорты коррелировала со степенью тяжести стеноза (p < 0,001). Однако у 13–18% пациентов были тяжелые формы стеноза (более 75%) и крайне низкая степень кальцификации аорты [15]. Таким образом, связь между тяжестью стеноза и накоплением кальция в атеросклеротических бляшках далеко не очевидна.
Здесь представляется уместным напомнить историю применения антикальциевых препаратов при атеросклерозе. До 2003 г. в западной литературе было модно говорить о перспективах применения антикальциевых препаратов как потенциально антиатеросклеротических. В самом деле, результаты больших исследований REGRESS (Regression Growth Evaluation Statin Study), VHAS (Verapamil in Hypertension and Atherosclerosis Study) и др. указали на возможность того, что антагонисты кальция обладают потенциальным антиатеросклеротическим эффектом [16]. Тем не менее уже с 2004 г. дискуссии об антикальциевых препаратах и атеросклерозе неожиданно прекратились. Возможным объяснением этого является осознание давно известного в фармакологии факта: антикальциевые препараты являются аналогами статинов. Статины ингибируют HMG-CoA редуктазу (3-гидрокси-3-метил-глютарил-кофермент А редуктазу) – фермент синтеза эндогенного холестерина, необходимого для синтеза стероидных гормонов и витамина D [17]. Поскольку взаимодействия антикальциевых препаратов с HMG-CoA редуктазой неспецифичны, блокаторы кальциевых каналов заведомо являются гораздо более слабыми антиатеросклеротическими препаратами, чем статины. Таким образом, антиатеросклеротическое действие антикальциевых препаратов не имеет ничего общего с гомеостазом кальция.
Не следует также забывать о том, что кальций – эссенциальный элемент. Кальций не только участвует в метаболизме костей, сокращении мышц, свертывании крови. Кальций также обязательный компонент (так называемый «вторичный мессенджер») многочисленных внутриклеточных сигнальных каскадов, посредством которых эндотелиальные клетки реагируют на внешние стимулы. Кальций является важным медиатором сигнальных путей как митогенеза, так и апоптоза [18]. Эти сигнальные пути достаточно сложны, вовлекают множество белков-посредников и действуют через систему Ca2+-зависимого белка кальмодулина. Исследования показали, что риск сосудистых заболеваний увеличивается и при повышенных, и при низких уровнях эндотелиального кальция [19].
Витамин D и атеросклероз
Витамин D – один из главных посредников кальциевого метаболизма. Жирорастворимые витамины группы D сначала преобразуются в активную форму посредством биотрансформаций, а затем взаимодействуют со специфическими рецепторами. Основные процессы биотрансформации витамина D происходят в коже, печени и почках. В коже под действием ультрафиолетового облучения образуется витамин D3. В печени витамин D3 путем гидроксилирования превращается в 25-оксихолекальциферол (25-ОН-D3) при посредстве 25-гидроксилазы. В почках, при их нормальном функционировании, 25-ОН-D3 трансформируется в 1,25-диоксихолекальциферол (1,25-(ОН)D3), наиболее активную форму витамина, которая переносится в кровяном русле витамин-D-связывающим белком (VDBP). Биологическое действие активной формы витамина реализуется путем связывания с рецептором витамина D (VDR). Рецептор витамина D, подобно эстроген-рецепторам, является фактором транскрипции, который регулирует синтез белков, вовлеченных в гомеостаз кальция и фосфора [20, 21].
Экспериментальные данные показывают, что физиологические эффекты витамина D включают торможение секреции провоспалительных цитокинов, молекул адгезии и пролиферацию сосудистых гладкомышечных клеток – процессов, которые имеют важное значение для кальцификации артерий [22].
Данные эпидемиологических исследований когорт пациентов и здоровых доноров свидетельствуют: дефицит витамина D ассоциируется с повышенным артериальным давлением, атеросклерозом, сахарным диабетом и активацией процессов воспаления [23]. Например, при исследовании 654 пациентов 55–96 лет (средний возраст 75,5 лет) без ИБС и инсульта в анамнезе установлено, что толщина интимы сонной артерии снижалась с увеличением в плазме уровня 25-(OH)-D3 – одного из основных метаболитов витамина (р = 0,02) [24]. В крупномасштабном исследовании когорты из 16 600 человек старше 18 лет было установлено, что сниженные уровни 25-(OH)-D3 соответствовали повышению риска сердечно-сосудистых заболеваний (ОШ 1,2; 95% ДИ 1,01–1,36; р = 0,03) [25]. Данное исследование отличается от других тщательным анализом данных и достоверным установлением эффектов витамина D вне зависимости от возраста, пола, этнической принадлежности, сезона, физической активности, индекса массы тела, курения, гипертонии, диабета, повышенных уровней триглицеридов, холестерина и липопротеидов низкой плотности, хронических заболеваний почек и др.
Эпидемиологические данные указывают на достаточно узкий физиологический диапазон потребления витамина D. Выход за рамки этого диапазона (дефицит либо гипервитаминоз D) увеличивает риск сердечно-сосудистых заболеваний [26]. Следует различать физиологические (так называемые рекомендованные суточные) дозы витамина и терапевтическое применение витамина D3. Каждодневный и длительный прием витамина D3 в физиологических дозах является нормой питания и абсолютно необходим для долговременной профилактики сосудистой патологии и остеопороза.
В то же время при терапевтическом приеме кратковременными курсами дозировка может значительно превышать рекомендованные уровни в 200–600 МЕ/сут [27]. Например, после трехмесячного приема в дозе 3000 МЕ/сут с целью компенсации гиповитаминоза D у пациентов наблюдались уменьшение стеноза артерий и увеличение уровней лептина (гормона, регулирующего метаболизм жировой ткани) [28]. В целом вопрос дозировки витамина D для профилактики/терапии сосудистых заболеваний остается открытым. Индивидуально пациентам, вероятно, могут назначаться несколько повышенные дозы витамина D3. Физиологические дозы витамина D3, особенно в период низкой инсоляции, необходимы практически каждому пациенту.
Физиология атеросклероза и кальцификации артерий
К общим факторам патогенеза остеопороза и сосудистых заболеваний относятся хроническое воспаление (например, при ревматоидном артрите), окисление липидов и образование активных форм кислорода, курение, сахарный диабет, дефицит эстрогенов, гиповитаминозы C, D, K и почечная недостаточность. Исследования с использованием комплексных неинвазивных методов, таких как мультидетекторная компьютерная томография, показали, что кальцификация сосудов может возникнуть в результате двух патологических процессов: атеросклероза и васкулярной оссификации. Атеросклероз (происходящий, как правило, в интиме сосуда) соответствует пассивной кальцификации и включает отложения кальция вследствие некротических и апоптотических поражений на поздних стадиях формирования атеросклеротических бляшек. Оссификация сосудов (как правило, медиальная область) рассматривается как активная кальцификация в результате процессов, имеющих некоторое сходство с остеогенезом [1].
Пассивная кальцификация предполагает, что кальций и неорганический фосфат-анион образуют нерастворимый осадок фосфатов кальция в области дегенерации тканей, обусловленной воспалением и последующим некрозом. Этот процесс усиливается макрофагами. Существует несколько потенциальных ингибиторов кальцификации, которые могут действовать локально или системно. К ним относятся матриксный Gla-белок (ген MGP), витамин-K-зависимый ингибитор кальцификации, действующий в области атеросклеротических бляшек, и фетуин-А, усиливающий фагоцитоз минеральных осадков [29].
Активная кальцификация (оссификация) подтверждается гистологическими образованиями, напоминающими костную ткань; наличием в зоне кальцификации остеобласт-подобных и остеокласт-подобных клеток; повышенными уровнями секреции белков-маркеров кости в зоне артериальной кальцификации. Вероятно, васкулярная оссификация протекает по аналогии с процессом формирования костей и включает дифференциацию мультипотентных мезенхимальных стволовых клеток в остеобласт-подобные клетки, которые минерализуют внеклеточный матрикс [30]. Активной кальцификации препятствуют факторы, подавляющие остеогенную дифференцировку стволовых клеток. Отметим, что активная кальцификация артерий является более тяжелой стадией кальцификации, обусловленной как генетическим фоном пациента, так и степенью прогрессии атеросклероза. Витамин D «направляет» кальций в ткани костей, поэтому в случае активной кальцификации у данного пациента следует с осторожностью относиться к дозировке препаратов кальция и витамина D.
Витамин D и молекулярные механизмы кальцификации артерий
Управляя гомеостазом кальция, витамин D может способствовать прекращению и пассивной, и активной кальцификации. Особое внимание следует обратить на экспериментальные и биохимические исследования влияния витамина D на экспрессию генов и результаты исследований трансгенных животных с делециями определенных генов, вовлеченных в метаболизм костной ткани.
Как было отмечено выше, витамин D обладает гормоноподобным эффектом и через взаимодействие с одноименным рецептором участвует в регуляции транскрипции сотен генов. Исследования влияния витамина D на экспрессию генов [31, 32] позволило установить список генов, на основе которых синтезируются белки, обеспечивающие характерные биологические эффекты витамина (табл. 1). Гены и соответствующие белки, имеющие наиболее вероятное отношение к атеросклерозу, липидному метаболизму и кальцификации артерий, рассмотрены ниже более подробно.
Основными витамин-D-зависимыми регуляторами гомеостаза кальция являются ионный канал TRPV6, кальбиндин, остеокальцин и остеопонтин. TRPV6 отвечает за адсорбцию кальция в ворсинчатом эпителии кишечника [33]; кальбиндин транспортирует кальций через энтероциты к базолатеральной стороне энтероцита, где кальций секретируется в кровяное русло посредством кальциевых насосов. Остеокальцин и остеопонтин способствуют закреплению остеоцитов на поверхности кости и необходимы для направления потоков кальция в кальциевое депо костной ткани. Уровни остеокальцина, как известно, отражают минеральную плотность кости [34]. Кроме того, остеопонтин вовлечен в синтез и секрецию γ-интерферона и интерлейкинов IL-10 и IL-12 [35].
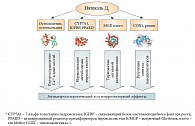
Другие гены, активируемые рецептором витамина D (табл. 1), оказывают положительное воздействие на липидный метаболизм и вазодилатацию, тем самым способствуя уменьшению риска атеросклероза и связанной с ним кальцификации артерий. Витамин D3 стимулирует синтез противовоспалительного простациклина в сосудистых гладкомышечных клетках через активацию транскрипции циклооксигеназы без изменения активности фосфолипазы А2 [36]. Активация рецептора витамина D тормозит избыточный синтез 7-альфа-холестерин-гидроксилазы (ген CYP7A1), что приводит к нормализации синтеза желчных кислот в гепатоцитах человека [37]. Витамин D способствует снижению активности транскрипции ренина – основного медиатора ренин-ангиотензиновой системы регуляции артериального давления [38] (рис. 1). Нормальная обеспеченность витамином D – признанный фактор нормализации артериального давления.
Инсулиноподобный фактор роста (IGF) является одним из важнейших факторов, поддерживающих баланс между жировой и мышечной тканью. При дефиците IGF или снижении его активности жировая ткань начинает преобладать над мышечной. В результате ускоряются процессы атеросклероза и старения. Витамин D стимулирует синтез IGF-связывающих белков (IGFBP), которые продлевают период полураспада IGF, тем самым усиливая его антиатеросклеротические эффекты (рис. 2). Исследования показали, что витамин D усиливает транскрипцию генов IGFBP1, IGFBP3 и IGFBP5. Сывороточные уровни IGF-1 и IGFBP-3 были измерены у 96 пациентов с периферической болезнью артерий и у 89 добровольцев. У больных были найдены более низкие уровни белка IGFBP-3 (p < 0,01), так что IGFBP-3 действительно связан с торможением процесса атеросклероза [39].
Не менее важно отметить, что витамин D активирует синтез белка PPAR-δ (активированный рецептор пролифераторов пероксисом, тип дельта), способствующего выведению избытка холестерина [40]. Белок PPAR-δ (рис. 3) активирует процессы бета-окисления жирных кислот, то есть активация синтеза PPAR-δ витамином D3 приводит к снижению интенсивности атеросклеротических процессов. Исследование примерно 2000 пациентов с ИБС (в сравнении со здоровыми индивидуумами) [41] показали, что полиморфизм гена PPAR-δ определяет плазменные уровни липидов и тяжесть коронарного атеросклероза. Таким образом, витамин D3 способствует активации синтеза нескольких важнейших антиатеросклеротических и вазодилатирующих факторов.
Естественно, что перечисленные в таблице 1 гены – далеко не полный список генов, транскрипция которых модулируется рецептором витамина D. Дополнительным источником информации являются исследования экспериментальных моделей кальцификации сосудов у животных с делециями определенных генов.
Результаты исследований трансгенных животных с делециями генов, вовлеченных в регуляцию гомеостаза кальция в костях, выявили важные детали молекулярных механизмов, посредством которых может осуществляться кальцификация артерий по активному и пассивному механизму (см. выше) [1]. Результаты суммированы в таблице 2, в которой также проводится сравнение с известными на сегодняшний день редкими моногенными заболеваниями человека, связанными с нарушениями кальциевого обмена. Рассмотрим детальнее белки, участвующие в защите от кальцификации артерий, и их взаимосвязь с витамином D.
Матричный Gla-белок (ген MGP) содержит остатки гамма-карбокси-глутаминовой аминокислоты (GLA), благодаря которым обладает высоким сродством к гидроксиапатиту костей [29]. Решающую роль MGP для костного и хрящевого метаболизма подчеркивают результаты исследований мышей с делецией гена, у которых наблюдалась повсеместная оссификация хряща и артериальная кальцификация. Важно отметить, что экспрессия гена MGP регулируется рядом факторов, в том числе производными витамина А, витамином D и внеклеточным кальцием [42].
Остеопонтин – неколлагеновый белок внеклеточной матрицы костей, который связывается с интегринами и имеет решающее значение для миграции остеокластов к сайтам резорбции костей [43]. Остеопонтин улучшает связывание остеокластов и тормозит апоптоз эндотелиальных клеток. Делеции гена в эксперименте были связаны с усилением кальцификации артерий; полиморфизм гена ассоциируется с артериальной кальцификацией у пациентов с прогрессирующим атеросклерозом [44]. Витамин D модулирует экспрессию гена остеопонтина [45].
Фетуин-А циркулирует в сыворотке крови и служит в качестве ингибитора осаждения кальция и неорганического фосфата на стенках сосудов [46]. Фетуин-А также стимулирует фагоцитоз, способствуя, таким образом, удалению уже образовавшихся нерастворимых остатков кальция. Экспериментальные модели с делецией гена фетуина-А показали хроническую почечную недостаточность на фоне повсеместной сосудистой кальцификации [47]. Низкие уровни фетуина-А в сыворотке могут предрасполагать пациентов с хронической почечной недостаточностью к кальцификации артерий [48]. Низкие уровни фетуина-А также обусловливают прогрессирование атеросклеротических поражений сердечно-сосудистой системы [49]. Пока не имеется данных о влиянии витамина D на экспрессию фетуина-А.
Клотό – белковый гормон (рис. 4), общий биологический эффект которого может быть условно описан как «подавление старения» [50]. Известны две формы белка клото – мембранная и секретируемая. Мембранная форма образует комплекс с факторами роста фибробластов, что усиливает выделение фосфата в моче. Секретируемая форма белка регулирует многочисленные гликопротеины на поверхности клеток, включая рецепторы факторов роста, в том числе факторов роста инсулина (IGF) [51].
Мыши с целевыми делециями гена klotho обладали более короткой продолжительностью жизни и, что характерно, демонстрировали многие особенности преждевременного старения, в том числе бесплодие, атрофию вилочковой железы, старение кожи, уменьшение количества клеток Пуркинье, физическую инертность, эмфизему легких, тяжелый остеопороз и прогрессирующий атеросклероз с медиальной кальцификацией. Сосудистые нарушения у трансгенных животных полностью исчезали при генной терапии посредством внедрения в организм животного гена klotho [52]. Генетический полиморфизм в промоторной области гена klotho (G395A) был ассоциирован с минеральной плотностью костей у женщин в постменопаузе, он также влияет на риск развития ИБС [53]. Рецептор витамина D связывает 1,25-дигидроксивитамин-D3 и регулирует транскрипцию гена klotho [54], тем самым замедляя кальцификацию артерий.
Таким образом, результаты проведенного анализа указывают на конкретные механизмы, осуществляющие комплексное воздействие витамина D на процессы атеросклероза и кальцификации (рис. 5). Во-первых, витамин D «направляет» потоки кальция в депо костей (остеокальцин, остеопонтин), таким образом способствуя удалению избытка кальция из плазмы и, одновременно, профилактике атеросклероза. Во-вторых, витамин D активирует гены, кодирующие белки (7-альфа-холестерин-гидроксилаза, связывающие белки инсулиноподобного фактора роста, активированный рецептор дельта пролифераторов пероксисом), которые способствуют нормализации метаболизма жирных кислот. В-третьих, витамин D модулирует транскрипцию генов вовлеченных в активную кальцификацию белков (матричный Gla-белок, остеопонтин, клото), замедляя патофизиологические процессы, ведущие к кальцификации артерий. В-четвертых, витамин D регулирует синтез вазодилататоров (увеличение простациклина, уменьшение ренина). Все эти эффекты способствуют профилактике атеросклероза, кальцификации артерий и тромбозов.
Препараты кальция и витамина D3, терапия и профилактика атеросклероза
Для профилактики кальциевого дефицита хорошо подходят комплексные кальциевые препараты с невысокой дозировкой кальция и дополненные потенциаторами его обмена и усвоения. Для терапии дефицита кальция, остеопороза и, возможно, атеросклероза более эффективно использование специальных препаратов с повышенными дозами кальция и витамина D3 – Натекаль Д3 (1500 мг карбоната кальция, что эквивалентно 600 мг Са2+ и 400 МЕ холекальциферола), Витрум кальций (карбонат кальция – 1250 мг, витамин D3 – 200 МЕ) и Идеос (карбонат кальция – 1250 мг, витамин D3 – 400 МЕ). Установленная в РФ потребность в кальции и витамине D3 у лиц старше 60 лет составляет 1200 Са2+ мг/сут и 600–800 МЕ/сут соответственно.
В пожилом возрасте очень важно выбрать приемлемую форму препарата кальция. Дело в том, что многие таблетированные формы препаратов кальция отличаются твердостью, и это делает их употребление затруднительным у лиц пожилого возраста. Кроме того, при разжевывании таблетки проявляют абразивные свойства, что способствует повреждению эмали зубов. Именно поэтому для пожилых людей и пациентов со слабой эмалью зубов предпочтительно использовать препараты кальция и витамина D3 в форме таблеток для рассасывания (Натекаль Д3).
Натекаль Д3, препарат кальция и витамина D в форме таблеток для рассасывания, не только не проявляет абразивные свойства, но и создает высокие концентрации кальция и его синергиста витамина D в слюне. Отметим: о том, что низкое содержание кальция в слюне является риском развития кариеса, известно по меньшей мере 80 лет [55]. Поддержание достаточной концентрации кальция в слюне является важным профилактическим мероприятием, защищающим от развития кариеса и пародонтоза, повышающим срок службы постоянных зубных протезов. Например, использование жевательных резинок с повышенным содержанием кальция способствует реминерализации повреждений эмали [56]. Может показаться парадоксальным, но поддержание достаточных концентраций кальция в слюне также способствует терапии атеросклероза по физиологическому механизму, независимому от рассмотренных выше молекулярных механизмов биологического действия кальция и витамина D.
Дело в том, что кариес зубов неразрывно связан с минеральным обменом – обеспеченностью кальцием, магнием, пиридоксином, цинком, фтором. Этот патологический процесс проявляется деминерализацией и последующим разрушением твердых тканей зуба с образованием дефекта в виде полости. Эмаль зуба повреждается при действии молочной и пировиноградной кислот, образующихся вследствие ферментации моно- и дисахаридов микроорганизмами зубного налета. По мере развития кариеса бактерии все глубже и глубже проникают в ткани зуба, разрушают дентин и попадают в кровяное русло. Адсорбируясь на эндотелии сосудов, эти бактерии способствуют росту атеросклеротических бляшек. Таким образом, поддержание достаточных уровней кальция в слюне способствует профилактике кариеса и уменьшению количества бактерий. Поскольку кариес связан с повышенным риском атеросклероза и ИБС [57], поддержание достаточных уровней кальция в слюне способствует и снижению риска образования новых атеросклеротических бляшек.
Заключение
При современном образе жизни (гиподинамия, недостаточная инсоляция, нерациональное питание: потребление продуктов с высоким содержанием фосфора, таких как сосиски, колбасы; недостаток в рационе свежей зелени, кальция, витамина D и т.д.) риск остеопороза и кальцификации артерий резко возрастает. Нобходимость терапии и профилактики остеопороза препаратами кальция и его основного синергиста витамина D общепризнана. В то же время применение этих препаратов для терапии и профилактики атеросклероза все еще считается своего рода табу среди некоторых врачей. В настоящей работе была проанализирована взаимосвязь между кальцификацией, остеопорозом и биологическими эффектами витамина D. Анализ позволил установить молекулярные механизмы, посредством которых осуществляется защитное действие витамина D, тормозящее процессы атеросклероза и кальцификации артерий. В целом результаты проведенного анализа указывают на то, что на риск развития остеопороза и атеросклероза влияет не уровень кальция, а его дисбаланс в организме, особенно при дефиците витамина D3. Следует еще раз подчеркнуть, что антиатеросклеротический и остеопротекторный эффект оказывает сочетанный прием кальция и витамина D. Прием препаратов кальция без витамина D и магния не будет способствовать физиологическому распределению кальция в организме и может приводить к усилению кальцификации атеросклеротических бляшек. Очевидно и другое: прием витамина D на фоне дефицита кальция также не будет эффективно восстанавливать кальциевый гомеостаз. Сочетанный прием кальция и витамина D (Натекаль Д3 и др.) будет способствовать как накоплению кальция в депо костей, так и уменьшению риска кальцификации артерий. В последующем планируется детально разработать диагностические критерии обеспеченности кальцием и витамином D3 для более персонализированного подхода к выбору профилактических и лечебных доз кальция и витамина D3.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.