Возможности применения интерферона в лечении беременных с изменениями шейки матки вирусного генеза
- Аннотация
- Статья
- Ссылки
Сложность ведения беременных с вирусными заболеваниями заключается в значительном ограничении этиотропного лечения в связи с тем, что большинство противовирусных препаратов и иммунорегуляторов противопоказаны во время беременности. Однако в настоящее время появились возможности оптимизировать течение беременности и предотвратить повреждение плода, влияя на патогенетические механизмы действия вирусов [8, 12].
Вирус папилломы человека (ВПЧ) является одним из наиболее распространенных возбудителей инфекций, передающихся половым путем (ИППП). В частности, ВПЧ служит причиной развития остроконечных кондилом, рака шейки матки и других опухолей половых органов, что обусловливает чрезвычайную важность поиска эффективных методов лечения инфекции ВПЧ [1, 3, 6].
ВПЧ поражает исключительно эпителиальные клетки. Цикл развития ВПЧ зависит от времени и степени дифференцировки клеток. Репликация вируса происходит в базальном слое эпидермиса. Экспрессия белков и сборка вирусов осуществляется в дифференцирующихся клетках шиповатого и зернистого слоев эпидермиса [7, 9].
Еще одна особенность ВПЧ – возможность латентной инфекции. При этом вирус может находиться внутриклеточно в неактивном состоянии до или после активной инфекции. Мощный клеточный иммунитет вызывает разрешение высыпаний и, возможно, переводит инфекцию в латентную фазу, тогда как иммунодефицит увеличивает риск новообразований. В таких случаях оптимальным вариантом была бы противовирусная терапия, эффективная в отношении ВПЧ. Требования к противовирусной терапии включают не только разрешение высыпаний, но и отсутствие рецидивов минимум 6–12 месяцев [12].
Дисплазия шейки матки ассоциируется с ВПЧ высокого риска. Она характеризуется хромосомной анеуплоидией, генетической нестабильностью и склонностью к озлокачествлению [5, 13].
Современное лечение инфекции ВПЧ направлено не на сам вирус, а лишь на устранение симптомов инфекции. Одной из наиболее важных целей лечения дисплазии шейки матки является предупреждение озлокачествления [4, 12].
Деструкция, цитотоксические препараты и фотодинамическая терапия, используемые в рамках стандартного лечения диспластических процессов в шейке матки, противопоказаны во время беременности [4, 12].
В настоящее время широкое применение при вирусных инфекциях нашли препараты интерферона, которые, как факторы защиты и средства поддержания иммунитета, обладают широким спектром профилактического и лечебного действия, в том числе и в отношении вирусов [10].
Интерферон активен в отношении ВПЧ. Местное применение, введение в очаг поражения и системное применение интерферонов приводят к полной или частичной ремиссии [11].
Частота доброкачественных заболеваний шейки матки у беременных составляет 78,6%. В их структуре преобладают цервикальные интраэпителиальные неоплазии (33,6%), эктопии (24,0%), полиповидные образования цервикального канала (9,3%) [8].
Частота децидуоза составляет у беременных с неизмененной шейкой матки 17,0%, с эктопией – 46,1%, эктропионом – 33,9%, с лейкоплакией – 12,0%, с цервикальными интраэпителиальными неоплазиями – 35,5%, после применения инвазивных методов лечения предрака шейки матки – 38,0% [8].
Полиповидные образования цервикального канала у беременных бывают двух типов: истинные полипы с децидуализацией (62,1%) и децидуальные псевдополипы (37,9%), которые имеют отличительные кольпоскопические, ультразвуковые, морфологические и иммуногистохимические особенности [8].
Доброкачественные заболевания шейки матки сопровождаются высокой частотой урогенитальных инфекций, среди которых преобладает папилломавирусная инфекция (ПВИ): у пациенток с эктопией она диагностируется в 32,4% случаев; с лейкоплакией – 56,0%; с цервикальными интраэпителиальными неоплазиями – 95,5%; после хирургического лечения предрака шейки матки – 42,0%; при полипах – 38,8%. У беременных с неизмененной шейкой матки частота ПВИ составляет 34,0% [8].
Течение беременности у женщин с доброкачественными заболеваниями шейки матки характеризуется высокой частотой невынашивания и ФПН: при наличии полиповидных образований цервикального канала – у 72,2% и 16,6%, после инвазивных методов лечения предрака шейки матки – у 74,0% и 22,0%, при эктопии и эктропионе – у 26,8 % и 15,7%, при лейкоплакии – у 16,0% и 12,0%, при цервикальной интраэпителиальной неоплазии – у 17,7% и 15,5% пациенток соответственно [8].
Частота репродуктивных потерь у беременных с доброкачественными заболеваниями шейки матки максимальна после хирургического лечения цервикальных интраэпителиальных неоплазий в прегравидарный период (8,0%) и при полиповидных образованиях цервикального канала (5,6%); при эктопии и CIN она составила 2,7% и 2,2% соответственно [8].
Нами было проведено исследование, целью которого явилась оценка эффективности применения препарата интерферона у беременных с патологией шейки матки, ассоциированной с ВПЧ.
Благодаря своему фармакокинетическому профилю использование препаратов интерферона в суппозиториях не требует специальных мер предосторожности, и они наиболее безопасны во время беременности [2, 11, 12].
Материал и методы исследования
В исследование были отобраны 30 беременных с эктопией, ассоциированной с ВПЧ, что подтверждено данными цитологического исследования с оценкой по Папаниколау, ПЦР и кольпоскопией во II триместре беременности (15–19 недель).
Критерии отбора пациенток включали: наличие патологии шейки матки, существовавшей ранее до беременности и не леченной до настоящей беременности; данные цитологического исследования, ПЦР-диагностики и кольпоскопии. В исследовании приняли участие беременные, начиная со II триместра (с 15 до 19 недель) беременности, способные выполнять требования протокола и предоставившие письменное информированное согласие.
Критериями исключения являлись: I триместр беременности; тяжелые нарушения функции сердца, легких, печени и почек в стадии декомпенсации; гиперчувствительность к интерферону или другим компонентам препарата, которая устанавливалась по данным анамнеза или в момент первого введения препарата; прием противовирусных или иммуномодулирующих препаратов в течение 3 предшествующих месяцев; наличие более тяжелой патологии шейки матки; подтвержденная ВИЧ-инфекция; наличие психоневрологических заболеваний; несоблюдение протокола исследования.
При анализе клинико-демографических данных статистически значимых различий по основным характеристикам между участницами исследования выявлено не было. Возраст обследованных женщин колебался в пределах от 19 до 32 лет и составил, в среднем, 25,16 ± 4,43 лет.
Для проведения ПЦР-диагностики использовали сертифицированные тест-системы. Взятие соскоба клеток с поверхности шейки матки и экзоцервикса для проведения исследования осуществляли в одно и то же время суток (утром) с помощью щеток-эндобрашей в одноразовую пробирку типа «Эппендорф» с транспортной средой.
Цитологическое исследование шейки матки с оценкой по Папаниколау выполняли всем женщинам (n = 30) трижды: в начале исследования, через 10 дней и через 28 дней от начала исследования.
Материал был представлен соскобом клеток с экзоцервикса и эндоцервикса, взятых с помощью щетки-эндобраша, который наносили на предметное стекло и фиксировали в 96% растворе этилового спирта в течение 5 минут. Обработанный и высушенный мазок хранили при 4°С в плотно закрытой упаковке. Оценку цитограммы проводили в соответствии с описательной системой ВОЗ (1968).
Кольпоскопию осуществляли при помощи кольпоскопа Sensitec-2000 (Голландия) с применением методов расширенной кольпоскопии, цветофильтров и увеличением до 36 раз.
Всем пациенткам назначали интерферон альфа-2b 250000 МЕ и таурин 0,005 г (Генферон® Лайт) по схеме: 1 суппозиторий интравагинально 1 раз в день на ночь в течение 10 дней, затем перерыв 7 дней и далее по 1 суппозиторию 1 раз в день в течение 10 дней.
Клинический мониторинг беременных осуществляли через 10 дней от начала лечения (ближайшее наблюдение) и через 28 дней (28 ± 1 день) от начала исследования (отдаленное наблюдение). Все лабораторные исследования проводили перед началом лечения, через 10 дней от начала лечения и через 4 недели от начала исследования.
Таким образом, результаты первого исследования служили базовым значением, результаты второго исследования характеризовали клиническую эффективность применявшегося препарата, а результаты третьего – восстановление микробиоценоза гениталий.
Статистическую обработку полученных результатов проводили с использованием методов параметрической и непараметрической статистики в программах Excel для Windows XP, SPSS и Statistica. Для оценки достоверности различий до и после лечения применяли t-критерий Стьюдента.
Критериями эффективности применения препарата являлись:
- регресс ВПЧ-ассоциированных изменений шейки матки по данным цитологического исследования с оценкой по Папаниколау и кольпоскопии;
- достижение отрицательного результата ПЦР-диагностики на ВПЧ.
Результаты исследования и обсуждение
Кольпоскопическая картина поражений шейки матки характеризовалась наличием эктопии и признаков воспаления. При скрининге эктопия с признаками воспаления была выявлена у 30 (100%) обследуемых беременных.
Через 10 дней применения препарата интерферона в суппозиториях (Генферон® Лайт) у 9 (30%) пациенток наблюдалось уменьшение границ эктопированной зоны за счет исчезновения признаков воспаления, а через 28 дней от начала лечения у 27 (90%) беременных отмечена минимальная зона эктопии с выраженным йоднегативным участком и нормальной зоной трансформации.
Кольпоскопическая картина носила характер низкой атипии или нормы, то есть процесс был локализован внутри цервикального канала.
При цитологическом исследовании выявлялись койлоциты у 26 больных (86,7%), дискариоциты – у 9 (30%), дистрофически измененные клетки – у 9 (30%), нейтрофильные лейкоциты – у 12 (40%), лимфоциты – у 7 (23,3%), плазматические клетки – у 7 (23,3%), базальные/парабазальные клетки – у 5 (16,7%), двух- и многоядерные клетки у 8 (26,7%), цитолиз – у 4 (13,3%) беременных.
Основным цитологическим признаком ВПЧ считается наличие клеток с койлоцитозом [9], которые были обнаружены у 26 из 30 женщин. Клетки с дискариозом обнаружены у 9 из 30 женщин, многоядерные клетки – у 8 из 30.
В зависимости от места взятия материала мазка и наличия эктопии с зоной трансформации при исследовании обнаруживали неизмененные клетки многослойного плоского эпителия, метапластические клетки, базальные/парабазальные клетки и клетки цилиндрического эпителия, клетки, свидетельствующие о хроническом воспалении.
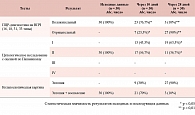
Результаты цитологического исследования через 10 дней от момента начала лечения показали регресс ВПЧ-ассоциированных изменений шейки матки у 13 (43,3%) и через 28 дней у 19 (63,3%) беременных.
Полученные результаты представлены в виде 4 групп согласно классификации по Папаниколау (табл. № 1).
Результаты ПЦР-диагностики, свидетельствующие о наличии ВПЧ 16, 18, 31, 33 типов, в начале исследования были положительными у всех 30 беременных.
Через 10 дней от начала лечения препаратом Генферон® Лайт у 7 (23,3%) пациенток, а через 28 дней у 27 (90%) беременных было отмечено отсутствие ВПЧ-инфекции по данным ПЦР-диагностики.
По результатам исследования мазков у всех пациенток, получавших препарат Генферон® Лайт, отмечались признаки стабилизации микрофлоры по результатам исследования мазков.
Ни одна пациентка не была исключена из исследования из-за непереносимости или побочных эффектов лечения препаратом Генферон® Лайт.
Таким образом, вагинальное применение препарата Генферон® Лайт в дозе 250000 МЕ по указанной выше схеме следует считать безопасным.
Эффективность лечения по двум основным критериям (регресс ВПЧ-ассоциированных изменений шейки матки и отсутствие ВПЧ-инфекции при ПЦР-диагностике) была достоверно выше, чем в начале исследования.
К сожалению, специфических лекарственных средств, полностью элиминирующих ВПЧ, на сегодняшний день не создано.
Препараты интерферона для местного применения в лечении патологии шейки матки являются более эффективными, так как они способны обеспечить более высокие концентрации действующего вещества непосредственно в очаге поражения при отсутствии побочных эффектов, свойственных парентеральному введению. Особый интерес представляют лекарственные формы интерферона в виде суппозиториев, показавшие эффективность для лечения целого ряда урогенитальных инфекций.
В результате проведенного нами исследования выявлено, что интравагинальное использование суппозиториев, содержащих интерферон (Генферон® Лайт), во время беременности кратковременными курсами позволяет добиться уменьшения клинических и лабораторных проявлений ВПЧ-инфекции (при ПЦР-диагностике на ВПЧ в 90% случаев, в 63,3% случаев по данным цитологического исследования с оценкой по Папаниколау), и в 90% случаях улучшить картину при кольпоскопическом исследовании.
Особое значение имеет потенциал экзогенных интерферонов, которые снижают интенсивность размножения вируса и избавляют пациентку от ненужного деструктивного лечения и лишних тревог.
Выводы
Препарат Генферон® Лайт безопасен и хорошо переносится беременными в дозировке 250000 МЕ при кратковременном лечении по схеме: по 1 суппозиторию интравагинально 1 раз в день на ночь в течение 10 дней, затем перерыв 7 дней и далее по 1 суппозиторию 1 раз в день в течение 10 дней.
При такой дозировке не наблюдается побочных эффектов и остается высокая активность препарата в отношении ВПЧ 16, 18, 31, 33 типов.
Интравагинальное использование суппозиториев Генферон® Лайт кратковременными курсами позволяет добиться отсутствия ВПЧ-инфекции при ПЦР-диагностике в 90% случаев, в 63,3% случаев по данным цитологического исследования с оценкой по Папаниколау и в 90% случаях улучшить картину при кольпоскопическом исследовании.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.