количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Все ли бета-адреноблокаторы одинаково эффективны? Место карведилола в лечении сердечно-сосудистых заболеваний
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" №3
- Аннотация
- Статья
- Ссылки
За прошедшие несколько десятилетий в кардиологии произошли серьезные изменения, которые значительно обогатили арсенал имеющихся лечебно-профилактических методов.
![Таблица 1. Антиаритмическое действие карведилола в исследовании CAPRICORN (данные взяты из отчетов о нежелательных явлениях. По [51])](/upload/resize_cache/iblock/7fe/195_350_1/7fea1429ecd91cbd52b21c93b0a605b8.jpg)
Таблица 1. Антиаритмическое действие карведилола в исследовании CAPRICORN (данные взяты из отчетов о нежелательных явлениях. По [51])
![Таблица 2. Влияние терапии бета-блокаторами на метаболические факторы риска (по [54])](/upload/resize_cache/iblock/913/195_350_1/9139e53fcce93dd0a0e0ae7d6911d088.jpg)
Таблица 2. Влияние терапии бета-блокаторами на метаболические факторы риска (по [54])
![Таблица 3. Динамика биохимических показателей на фоне терапии у пациентов основной и контрольной групп в исследовании АККОРД (по [64])](/upload/resize_cache/iblock/6ef/195_350_1/6efe266ba146269d92c7015bdca21f90.jpg)
Таблица 3. Динамика биохимических показателей на фоне терапии у пациентов основной и контрольной групп в исследовании АККОРД (по [64])
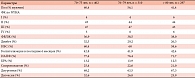
Таблица 4. Исходная характеристика трех групп в исследовании COLA II
Бета-адреноблокаторы – фармакологическая группа, показавшая свою несомненную эффективность на всех этапах сердечно-сосудистого континуума. Вместе с тем эта группа чрезвычайно разнородна, и отдельные ее представители значительно различаются между собой по безопасности и переносимости. Бета-блокатор третьего поколения карведилол является лекарственным средством с наилучшим клиническим профилем и дополнительными преимуществами, выделяющими его из всей группы.
Особенности фармакологического действия
Карведилол – конкурентный ингибитор бета1-адренорецепторов (константа диссоциации (КД) – 0,8 нмоль/л), бета2-адренорецепторов (КД – 1 нмоль/л), альфа1-адренорецепторов (КД – 11 нмоль/л) без внутренней симпатомиметической активности [1, 2]. Карведилол представляет собой рацемат двух энантиомеров (R+ и S- форм). Блокада альфа1-рецепторов является следствием действия обоих энантиомеров, блокада бета-рецепторов связана с эффектами S- формы [3]. Основные фармакодинамические эффекты карведилола:
адренергическая активность:
Хроническая сердечная недостаточность
В рамках US Carvedilol Heart Failure Program было проведено четыре двойных слепых рандомизированных плацебоконтролируемых исследования, в которые были включены пациенты с ХСН ишемической и неишемической патологии и различной тяжестью заболевания (II–IV функциональный класс (ФК) по NYHA). Комбинированный анализ этих исследований (всего 1094 пациента) [22] показал, что на фоне использования 12,5–100 мг карведилола в сутки общая смертность была достоверно ниже по сравнению с плацебо (3,2% и 7,8% соответственно, снижение относительного риска (ОР) 65%, p < 0,001). Одновременно в основной группе было выявлено достоверное снижение госпитализации по любой сердечно-сосудистой причине по сравнению с плацебо (снижение ОР 27%, р = 0,036). В двух исследованиях данной программы назначение карведилола также сопровождалось снижением ФК ХСН [23, 24]. В двойном слепом рандомизированном исследовании Australia/New Zealand Heart Failure Research Collaborative Group сравнивали карведилол (целевая доза 25 мг два раза в сутки) и плацебо у 415 пациентов с ХСН ишемической этиологии (I–III ФК по NYHA). Показано, что в основной группе отмечено достоверное снижение частоты наступления комбинированной конечной точки «смерть + госпитализация» (на 26%, р = 0,02) [8].
Неселективная блокада при использовании карведилола (целевая доза 25 мг два раза в сутки) была более эффективной по сравнению с селективной бета1-блокадой на фоне применения метопролола тартрата (целевая доза 50 мг два раза в сутки) у пациентов с умеренной и тяжелой ХСН (3029 человек) в двойном слепом рандомизированном многоцентровом исследовании Carvedilol Or Metoprolol European Trial (COMET) [25]. В группе карведилола общая смертность была достоверно ниже по сравнению с группой метопролола (34% и 40% соответственно, снижение ОР на 17%, р = 0,0017). Годичная смертность составляла 8,3% у пациентов, принимавших карведилол, и 10,0% у принимавших метопролола тартрат [25]. В метаанализе, изучавшем 15 сравнительных исследований карведилола или метопролола и плацебо, показано, что плацебо-корректированное повышение ФВЛЖ в группе карведилола составляет 6,5%, а в группе метопролола – 3,8% (р = 0,0002) [26]. В метаанализе, изучавшем четыре прямых сравнительных исследования карведилола и метопролола, также выявлено более выраженное повышение ФВЛЖ по сравнению с исходными значениями в группах карведилола (8,9% и 5,5% соответственно, р = 0,009) [3].
В исследовании COPERNICUS (Carvedilol Prospective Randomized Cumulative Survival) было продемонстрировано, что по сравнению с плацебо назначение карведилола в дозе 25 мг дважды в сутки вело к достоверному снижению риска общей смертности (на 35%, р = 0,0014) и частоты наступления комбинированной конечной точки «смерть + госпитализация по любой причине» (на 24%, р < 0,001) у пациентов с тяжелой ХСН (фракция выброса левого желудочка < 25%) [27]. В исследовании принимали участие 2289 пациентов. Благотворное действие карведилола было продемонстрировано в подгруппах пациентов с наивысшим риском (у пациентов с недавним или рецидивирующим ухудшением функции сердца, а также с наиболее тяжелой ХСН (ФВЛЖ ≤ 15%)). Более того, клиническая эффективность, выявленная в течение первых 8 недель исследования, сохранялась на протяжении всего наблюдения. Дополнительные анализы результатов исследования COPERNICUS выявили благоприятное действие карведилола на другие клинические конечные точки (комбинированная частота смерти и госпитализации по сердечно-сосудистым причинам, комбинированная частота смерти и госпитализации в связи с ХСН) у пациентов вне зависимости от расы, наличия сахарного диабета, сочетанного использования спиронолактона [28, 29].
Назначение карведилола (целевая доза 25 мг два раза в сутки) являлось клинически эффективным у пациентов с конечными стадиями ХСН, ожидающими пересадки сердца, в двойном слепом рандомизированном исследовании EFICAT (Ejection Fraction in Cardiac Transplant Candidates) [30]. На фоне назначения карведилола достоверно повышалась ФВЛЖ (p < 0,008) и снижалась общая смертность. Карведилол показал свою несомненную эффективность при использовании у пациентов с ХСН и идиопатической дилатационной кардиомиопатией. Так, карведилол по сравнению с плацебо вызывал достоверное снижение ФК по NYHA (p < 0,001), увеличение ФВЛЖ (p < 0,0001), а также повышение толерантности к физической нагрузке [31]. При сравнении с метопрололом отмечено достоверное снижение частоты нарушений ритма и улучшение показателя пикового потребления кислорода (р = 0,03) на фоне использования карведилола [32]. Использование карведилола является клинически эффективным также при ХСН на фоне алкогольной кардиомиопатии, что проявляется как улучшением функционального класса, так и благоприятным изменением эхокардиографических параметров пациентов на фоне одновременного отказа от потребления этанола [33].
В исследовании CAPRICORN при добавлении карведилола к стандартной терапии пациентам с дисфункцией левого желудочка после острого инфаркта миокарда отмечено более выраженное снижение смертности и ингибирование ремоделирования миокарда по сравнению с плацебо и стандартным лечением [34]. В двойное слепое рандомизированное исследование CAPRICORN было включено 1959 клинически стабильных пациентов, перенесших инфаркт миокарда за 3–21 день до включения. Общая смертность в группе карведилола (25 мг дважды в день) достоверно уменьшилась по сравнению с плацебо (12% и 15% соответственно, снижение ОР на 23%, р = 0,031). Не выявлено различий между группами по частоте общей смертности и госпитализаций по сердечно-сосудистым причинам. Карведилол по сравнению с плацебо вызывал достоверное снижение частоты сердечно-сосудистой смерти (снижение ОР на 25%, р = 0,024), рецидива инфаркта миокарда (снижение ОР на 41%, р = 0,014), а также комбинированной конечной точки «общая смертность + несмертельный инфаркт миокарда» (снижение ОР на 29%, р = 0,002). Кроме того, при дополнительном анализе результатов этого исследования получены данные о благоприятном влиянии карведилола на ряд вторичных конечных точек (наджелудочковые и желудочковые аритмии) [35]. Благоприятное влияние карведилола на постинфарктное ремоделирование продемонстрировано также в исследовании CHAPS (Carvedilol Heart Attack Pilot Study) [36].
В двойное слепое рандомизированное многоцентровое исследование Carvedilol Hibernating Reversible Ischaemia Trial; Marker of Success (CHRISTMAS) было включено 305 пациентов со стабильной ХСН ишемической этиологии (средняя фракция выброса левого желудочка (ФВЛЖ) 30%) [37]. В течение 6 месяцев пациенты получали карведилол или плацебо. В группе карведилола среднее плацебокорректированное повышение ФВЛЖ составило 3,6% (р = 0,0002 по сравнению с исходным) у пациентов с изначально гибернированным миокардом и 2,9% (р = 0,011 по сравнению с исходным) у лиц без первоначально выявляемой гибернации миокарда. Кроме того, в этом исследовании выявлено улучшение межвентрикулярной контрактильной синхронности между правым и левым желудочком, а также внутренней сократительной синхронности в левом желудочке [38].
- вазодилатация вследствие блокады альфа1-рецепторов (при длительной терапии выражена незначительно) [4];
- снижение уровня метаболизма норадреналина в тканях сердца [5];
- снижение потребности миокарда в кислороде вследствие блокады бета-адренорецепторов[4];
- достоверное повышение фракции выброса левого желудочка (ФВЛЖ) [6];
- достоверное снижение частоты сердечных сокращений (ЧСС) [7];
- достоверное снижение артериального давления (АД) и общего периферического сосудистого сопротивления (ОПСС) [8];
- достоверное повышение ударного объема (УО) без влияния на сердечный индекс (СИ) [9];
- достоверное уменьшение конечно-диастолического размера (КДР) и конечно-систолического размера КСР [10];
- достоверное уменьшение вариабельности ЧСС и интервала
- QT [11];
- антиоксидантное действие как у здоровых добровольцев [12], так и у пациентов с различными заболеваниями сердца и сосудов [13–15];
- антиапоптотическое действие in vitro и на экспериментальных моделях [16];
- антипролиферативное действие в отношении гладкомышечных клеток крупных артерий в исследованиях in vitro [17];
- достоверное улучшение почечного кровотока [18];
- достоверное улучшение функции эндотелия [19];
- достоверное повышение содержания в плазме сосудистого эндотелиального фактора роста (СЭФР) [20];
- достоверное уменьшение уровней интерлейкина-6 и фактора некроза опухоли-альфа (ФНО-альфа) [21].
Хроническая сердечная недостаточность
В рамках US Carvedilol Heart Failure Program было проведено четыре двойных слепых рандомизированных плацебоконтролируемых исследования, в которые были включены пациенты с ХСН ишемической и неишемической патологии и различной тяжестью заболевания (II–IV функциональный класс (ФК) по NYHA). Комбинированный анализ этих исследований (всего 1094 пациента) [22] показал, что на фоне использования 12,5–100 мг карведилола в сутки общая смертность была достоверно ниже по сравнению с плацебо (3,2% и 7,8% соответственно, снижение относительного риска (ОР) 65%, p < 0,001). Одновременно в основной группе было выявлено достоверное снижение госпитализации по любой сердечно-сосудистой причине по сравнению с плацебо (снижение ОР 27%, р = 0,036). В двух исследованиях данной программы назначение карведилола также сопровождалось снижением ФК ХСН [23, 24]. В двойном слепом рандомизированном исследовании Australia/New Zealand Heart Failure Research Collaborative Group сравнивали карведилол (целевая доза 25 мг два раза в сутки) и плацебо у 415 пациентов с ХСН ишемической этиологии (I–III ФК по NYHA). Показано, что в основной группе отмечено достоверное снижение частоты наступления комбинированной конечной точки «смерть + госпитализация» (на 26%, р = 0,02) [8].
Неселективная блокада при использовании карведилола (целевая доза 25 мг два раза в сутки) была более эффективной по сравнению с селективной бета1-блокадой на фоне применения метопролола тартрата (целевая доза 50 мг два раза в сутки) у пациентов с умеренной и тяжелой ХСН (3029 человек) в двойном слепом рандомизированном многоцентровом исследовании Carvedilol Or Metoprolol European Trial (COMET) [25]. В группе карведилола общая смертность была достоверно ниже по сравнению с группой метопролола (34% и 40% соответственно, снижение ОР на 17%, р = 0,0017). Годичная смертность составляла 8,3% у пациентов, принимавших карведилол, и 10,0% у принимавших метопролола тартрат [25]. В метаанализе, изучавшем 15 сравнительных исследований карведилола или метопролола и плацебо, показано, что плацебо-корректированное повышение ФВЛЖ в группе карведилола составляет 6,5%, а в группе метопролола – 3,8% (р = 0,0002) [26]. В метаанализе, изучавшем четыре прямых сравнительных исследования карведилола и метопролола, также выявлено более выраженное повышение ФВЛЖ по сравнению с исходными значениями в группах карведилола (8,9% и 5,5% соответственно, р = 0,009) [3].
В исследовании COPERNICUS (Carvedilol Prospective Randomized Cumulative Survival) было продемонстрировано, что по сравнению с плацебо назначение карведилола в дозе 25 мг дважды в сутки вело к достоверному снижению риска общей смертности (на 35%, р = 0,0014) и частоты наступления комбинированной конечной точки «смерть + госпитализация по любой причине» (на 24%, р < 0,001) у пациентов с тяжелой ХСН (фракция выброса левого желудочка < 25%) [27]. В исследовании принимали участие 2289 пациентов. Благотворное действие карведилола было продемонстрировано в подгруппах пациентов с наивысшим риском (у пациентов с недавним или рецидивирующим ухудшением функции сердца, а также с наиболее тяжелой ХСН (ФВЛЖ ≤ 15%)). Более того, клиническая эффективность, выявленная в течение первых 8 недель исследования, сохранялась на протяжении всего наблюдения. Дополнительные анализы результатов исследования COPERNICUS выявили благоприятное действие карведилола на другие клинические конечные точки (комбинированная частота смерти и госпитализации по сердечно-сосудистым причинам, комбинированная частота смерти и госпитализации в связи с ХСН) у пациентов вне зависимости от расы, наличия сахарного диабета, сочетанного использования спиронолактона [28, 29].
Назначение карведилола (целевая доза 25 мг два раза в сутки) являлось клинически эффективным у пациентов с конечными стадиями ХСН, ожидающими пересадки сердца, в двойном слепом рандомизированном исследовании EFICAT (Ejection Fraction in Cardiac Transplant Candidates) [30]. На фоне назначения карведилола достоверно повышалась ФВЛЖ (p < 0,008) и снижалась общая смертность. Карведилол показал свою несомненную эффективность при использовании у пациентов с ХСН и идиопатической дилатационной кардиомиопатией. Так, карведилол по сравнению с плацебо вызывал достоверное снижение ФК по NYHA (p < 0,001), увеличение ФВЛЖ (p < 0,0001), а также повышение толерантности к физической нагрузке [31]. При сравнении с метопрололом отмечено достоверное снижение частоты нарушений ритма и улучшение показателя пикового потребления кислорода (р = 0,03) на фоне использования карведилола [32]. Использование карведилола является клинически эффективным также при ХСН на фоне алкогольной кардиомиопатии, что проявляется как улучшением функционального класса, так и благоприятным изменением эхокардиографических параметров пациентов на фоне одновременного отказа от потребления этанола [33].
В исследовании CAPRICORN при добавлении карведилола к стандартной терапии пациентам с дисфункцией левого желудочка после острого инфаркта миокарда отмечено более выраженное снижение смертности и ингибирование ремоделирования миокарда по сравнению с плацебо и стандартным лечением [34]. В двойное слепое рандомизированное исследование CAPRICORN было включено 1959 клинически стабильных пациентов, перенесших инфаркт миокарда за 3–21 день до включения. Общая смертность в группе карведилола (25 мг дважды в день) достоверно уменьшилась по сравнению с плацебо (12% и 15% соответственно, снижение ОР на 23%, р = 0,031). Не выявлено различий между группами по частоте общей смертности и госпитализаций по сердечно-сосудистым причинам. Карведилол по сравнению с плацебо вызывал достоверное снижение частоты сердечно-сосудистой смерти (снижение ОР на 25%, р = 0,024), рецидива инфаркта миокарда (снижение ОР на 41%, р = 0,014), а также комбинированной конечной точки «общая смертность + несмертельный инфаркт миокарда» (снижение ОР на 29%, р = 0,002). Кроме того, при дополнительном анализе результатов этого исследования получены данные о благоприятном влиянии карведилола на ряд вторичных конечных точек (наджелудочковые и желудочковые аритмии) [35]. Благоприятное влияние карведилола на постинфарктное ремоделирование продемонстрировано также в исследовании CHAPS (Carvedilol Heart Attack Pilot Study) [36].
В двойное слепое рандомизированное многоцентровое исследование Carvedilol Hibernating Reversible Ischaemia Trial; Marker of Success (CHRISTMAS) было включено 305 пациентов со стабильной ХСН ишемической этиологии (средняя фракция выброса левого желудочка (ФВЛЖ) 30%) [37]. В течение 6 месяцев пациенты получали карведилол или плацебо. В группе карведилола среднее плацебокорректированное повышение ФВЛЖ составило 3,6% (р = 0,0002 по сравнению с исходным) у пациентов с изначально гибернированным миокардом и 2,9% (р = 0,011 по сравнению с исходным) у лиц без первоначально выявляемой гибернации миокарда. Кроме того, в этом исследовании выявлено улучшение межвентрикулярной контрактильной синхронности между правым и левым желудочком, а также внутренней сократительной синхронности в левом желудочке [38].
Карведилол показал свою несомненную эффективность при диастолической сердечной недостаточности. В исследование SWEDIC (Swedish Evaluation of Diastolic Dysfunction in CHF) было включено 113 пациентов с диастолической дисфункцией и ХСН (I–III ФК по NYHA). Показано, что по сравнению с плацебо карведилол в дозе 25–50 мг дважды в день через 6 месяцев терапии достоверно улучшал скорректированное по возрасту отношение E/A (p = 0,046) [39]. В исследовании CARMEN (Carvedilol ACE Inhibitor Remodelling Mild Heart Failure Evaluation) сравнивали эффективность монотерапии карведилолом, эналаприлом и комбинацию этих двух лекарственных средств (161, 158 и 160 пациентов в каждой группе соответственно) [40]. Показано, что улучшение индекса систолического диаметра левого желудочка отмечалось в группах карведилола и комбинированной терапии, но не в группе эналаприла [3]. Два метаанализа было проведено для изучения сравнительной эффективности различных бета-блокаторов при ХСН: на материале 24 рандомизированных исследований (3141 пациент) [41] и 18 двойных слепых рандомизированных плацебоконтролируемых исследований (3023 пациента) [42]. В одном из них были получены сведения о том, что степень уменьшения смертности на фоне применения неселективных бета-блокаторов (карведилол и буциндолол) выше по сравнению с селективной блокадой (метопролол, бисопролол, небиволол) (р = 0,049) [41].
Снижение стоимости госпитализации по поводу ХСН или любой другой сердечно-сосудистой причине на фоне приема карведилола отмечено в US Carvedilol Heart Failure Program. При использовании специальной модели показано, что комбинация карведилола, дигоксина, диуретиков и ингибиторов АПФ позволяет экономить 29 477 долл. США в год при лечении одного пациента с ХСН при сравнении с той же комбинацией, но без карведилола [43]. Анализ данных проекта COPERNICUS показал, что общая стоимость госпитализаций пациентов в группах карведилола и плацебо составила соответственно 3,49 и 4,24 млн фунтов стерлингов, а их амбулаторная терапия после выписки оценивалась в 479 200 и 548 300 фунтов стерлингов [44].
Нарушения сердечного ритма
Ретроспективный анализ результатов US Carvedilol Heart Failure Trials Program [45] был проведен для изучения эффективности карведилола у 136 пациентов с исходной фибрилляцией предсердий (ФП). У пациентов в группе карведилола по сравнению с плацебо наблюдали более выраженное улучшение следующих параметров: повышение ФВЛЖ (10% и 3% соответственно; р = 0,001), меньшая частота госпитализации или смерти в связи с ХСН, снижение ЧСС, систолического АД (различия по трем последним параметрам статистически недостоверны). В двойном слепом рандомизированном исследовании в параллельных группах Carvedilol in Atrial Fibrillation Evaluation (CAFE) сравнивали между собой монотерапию дигоксином или карведилолом и комбинированную терапию этими средствами у 47 пациентов с ХСН (средняя ФВЛЖ 24%) и ФП в течение не более чем 1 месяца [46]. В фазе 1 проводилось повышающее титрование карведилола, в фазу 2 происходила отмена дигоксина при достижении поддерживающей дозы карведилола, которая назначалась в течение дальнейших 6 месяцев. Доза дигоксина при необходимости повышалась до момента рандомизации с целью контроля ЧСС. Стартовая доза карведилола составляла 3,125 мг дважды в день и повышалась каждые 2 недели до достижения целевой дозы 25 мг дважды в день (в течение 2 месяцев) или 50 мг дважды в день у пациентов с массой тела более 85 кг. При комбинированной терапии дигоксином и карведилолом по сравнению с монотерапией дигоксином достигнуто достоверное снижение ЧСС (65 уд/мин и 75 уд/мин соответственно; р < 0,0001), а также увеличение ФВЛЖ (31% и 26%; р < 0,05). Исследователи заключают, что комбинация «дигоксин + карведилол» является более эффективной для лечения пациентов с ФП и ХСН по сравнению с монотерапией дигоксином [46].
У 49 пациентов с постоянной формой ФП (средняя длительность 30 ± 3,4 месяца) сравнивали эффективность карведилола и амиодарона в отношении восстановления и удержания синусового ритма [47]. Пациенты были рандомизированы в группу карведилола (12,5–50 мг/сут; n = 16), амиодарона (600 мг/сут однократно в течение 2 недель с последующим снижением дозы до 200 мг/сут; n = 17), а также в группу контроля (n = 13). Электрофизиологические параметры оценивали через 5 мин и 24 ч после проведения электроимпульсной терапии, рецидивы ФП определяли на 1-й и 7-й дни. Частота кардиоверсии составила 87% в группе карведилола, 94% в группе амиодарона, 69% в группе контроля (р = 0,05). Достоверных различий между карведилолом и амиодароном в отношении эффективности поддержания синусового ритма не выявлено. В другом исследовании изучалась комбинация карведилола (титровался до дозы 50 мг однократно в сутки) и низких доз амиодарона (1000 мг/неделю) у 109 пациентов с тяжелой сердечной недостаточностью, получающих ингибиторы АПФ, диуретики и сердечные гликозиды [48]. В группе комбинированной терапии отмечалась достоверно более низкая ЧСС в покое во всех временных точках в течение 1 года наблюдения (р < 0,001). Достоверно снижалась частота желудочковых экстрасистол по результатам холтеровского мониторирования (р < 0,01), ФВЛЖ повысилась с 26% до 32% через 3 месяца и до 39% через 1 год (р < 0,001). Кроме того, отмечали достоверное снижение функционального класса ХСН по NYHA с 3,17 до 1,80 (р < 0,001). Кроме того, на фоне данного лечения достоверно снижался риск общей смерти (р < 0,0001) и внезапной смерти (р < 0,01).
Katritsis и соавт. [49] провели двойное слепое клиническое исследование, в котором сравнивали карведилол и бисопролол в отношении их способности поддерживать синусовый ритм после успешной кардиоверсии у пациентов с ФП. 90 пациентов с ФВЛЖ < 30% после кардиоверсии по поводу ФП (> 7 суток) рандомизировались в группу карведилола (12,5–25 мг два раза в сутки, n = 43) или бисопролола (5–10 мг однократно в сутки, n = 47). Пациенты обследовались на 1, 3, 6 и 12-м месяце исследования. Рецидив ФП возник у 17 (32%) пациентов в группе карведилола и 23 (46%) в группе бисопролола. Хотя различия не являлись статистически достоверными, авторы пришли к заключению о необходимости проведения расширенного исследования по этому вопросу. При ретроспективном изучении 115 пациентов, получавших бета-блокаторы (карведилол, метопролол или атенолол) сразу после кардиохирургического вмешательства, самая низкая частота послеоперационной ФП отмечалась в группе карведилола (р < 0,05) [50]. Ослепленный дополнительный анализ аритмических событий был проведен по результатам исследования CAPRICORN (табл. 1). Кроме достоверного уменьшения количества наджелудочковых и желудочковых аритмических событий, карведилол достоверно увеличивал время до возникновения первого эпизода трепетания/фибрилляции предсердий и злокачественной желудочковой аритмии [51].
Назначение карведилола в дозе 50 мг дважды в день снижало частоту желудочковых аритмий у 168 пациентов с ХСН на фоне дилатационной кардиомиопатии, исходно получавших ингибиторы АПФ, диуретики и сердечные гликозиды. Через 6 месяцев терапии наблюдали достоверное уменьшение количества желудочковых экстрасистол, а также эпизодов желудочковой тахикардии (р < 0,05 для обоих параметров) [52]. Наконец, антиаритмическая эффективность карведилола также изучалась в смешанной популяции у 71 пациента с плохо контролируемой артериальной гипертонией, ХСН ишемической этиологии или стабильной стенокардией. Холтеровское мониторирование проводили исходно и через 4–8 недель после начала лечения карведилолом. Средняя частота желудочковых экстрасистол уменьшилась с 25,5 до 6 эпизодов в час (р < 0,0001) [53].
Метаболические нарушения
Известно, что терапия бета-блокаторами может вести к неблагоприятным метаболическим изменениям. Тем не менее эти эффекты значительно различаются в зависимости от дополнительных свойств конкретного препарата (табл. 2). Хотя известно, что диуретики и бета-блокаторы ухудшают компенсацию обмена веществ при диабете [55, 56], многие из проведенных ранее исследований не выявляли нарушения толерантности к глюкозе у лиц, не страдающих диабетом [57, 58], поскольку как гликемия натощак, так и гликемия после нагрузки, а также уровни гликированного гемоглобина (HbA1c) не изменялись. Однако есть данные, что до тех пор, пока бета-клетки способны адекватно компенсировать понижение чувствительности к инсулину, гиперинсулинемия будет «перекрывать» инсулинорезистентность, и толерантность к глюкозе будет оставаться нормальной даже при наличии выраженной резистентности к инсулину [54]. Таким образом, нормальные показатели гликемии (натощак или после нагрузки), а также HbA1c не позволяют исключить нарушение чувствительности к инсулину.
Метаболические нарушения
Известно, что терапия бета-блокаторами может вести к неблагоприятным метаболическим изменениям. Тем не менее эти эффекты значительно различаются в зависимости от дополнительных свойств конкретного препарата (табл. 2). Хотя известно, что диуретики и бета-блокаторы ухудшают компенсацию обмена веществ при диабете [55, 56], многие из проведенных ранее исследований не выявляли нарушения толерантности к глюкозе у лиц, не страдающих диабетом [57, 58], поскольку как гликемия натощак, так и гликемия после нагрузки, а также уровни гликированного гемоглобина (HbA1c) не изменялись. Однако есть данные, что до тех пор, пока бета-клетки способны адекватно компенсировать понижение чувствительности к инсулину, гиперинсулинемия будет «перекрывать» инсулинорезистентность, и толерантность к глюкозе будет оставаться нормальной даже при наличии выраженной резистентности к инсулину [54]. Таким образом, нормальные показатели гликемии (натощак или после нагрузки), а также HbA1c не позволяют исключить нарушение чувствительности к инсулину.
Для сравнения влияния бета-блокаторов на гликемический и метаболический контроль у пациентов с сахарным диабетом 2 типа и артериальной гипертензией, получающих ингибиторы АПФ или блокаторы рецепторов к ангиотензину II, было проведено рандомизированное двойное слепое исследование в параллельных группах GEMINI (Glycemic Effects in Diabetes Mellitus: Carvedilol-Metoprolol Comparison in Hypertensives) [59]. В исследование включили 1235 пациентов 36–85 лет с артериальной гипертонией (> 130/80 мм рт. ст.) и сахарным диабетом 2 типа (HbA1c 6,5–8,5%). Срок наблюдения составил 35 недель. Пациенты рандомизировались в группы карведилола (6,25–25 мг дважды в день, n = 498) или метопролола тартрата (50–200 мг дважды в день, n = 737). При необходимости достижения целевых значений артериального давления добавлялись гидрохлоротиазид или антагонисты кальция из группы дигидропиридинов. Основными исследуемыми параметрами считали различия между группами по средним изменениям исходного HbA1c после 5 месяцев поддерживающей терапии. Вторичными конечными точками определили изменения HbA1c в группах, влияние лечения на чувствительность к инсулину и микроальбуминурию.
Группы достоверно различались между собой по показателю изменения HbA1c от исходного (0,13%; 95% ДИ 0,04–0,22%; р = 0,004). Среднее значение HbA1c повышалось в группе метопролола (0,15%; p < 0,001), но не в группе карведилола (0,02%, р = 0,65). Чувствительность к инсулину улучшилась в группе карведилола (-9,1%; р = 0,004) и не изменилась в группе метопролола (-2,0%; р = 0,48). При этом между группами выявлены достоверные различия по этому показателю (р = 0,004). Степень снижения артериального давления не различалась в зависимости от применяемого бета-блокатора. Прогрессирование микроальбуминурии в группе карведилола было достоверно более медленным по сравнению с метопрололом (6,4% и 10,3% соответственно; отношение шансов 0,60; 95% ДИ 0,36–0,97; р = 0,04). Таким образом, использование карведилола по сравнению с метопрололом на фоне блокады системы «ренин – ангиотензин –альдостерон» не влияет на гликемический контроль, а также благоприятно изменяет метаболические показатели у пациентов с сахарным диабетом 2 типа и артериальной гипертонией.
Метаболическая нейтральность карведилола была также показана в российском многоцентровом рандомизированном исследовании АККОРД, в котором изучалась эффективность и безопасность карведилола в составе комбинированной терапии у пациентов с артериальной гипертонией и сахарным диабетом и/или ожирением [64]. В исследование было включено 592 пациента, у 194 диагностирован сахарный диабет 2 типа, у 398 – ожирение. Пациенты, рандомизированные в основную группу (n = 291), получали карведилол (Акридилол, ОАО «АКРИХИН», Россия) в дополнение к основной терапии, пациенты контрольной группы (n = 301) карведилол не получали. Продолжительность исследования составила 24 недели. На фоне терапии достоверно снизились уровни общего холестерина и глюкозы, показатели гликированного гемоглобина и ХСЛПВП практически не изменились (табл. 3). Таким образом, длительная терапия карведилолом артериальной гипертензии у пациентов с сахарным диабетом 2 типа и/или ожирением не оказывает негативного влияния на метаболические показатели.
Известны данные о том, что карведилол благотворно влияет на липидный профиль пациентов с сердечно-сосудистыми заболеваниями. Hauf-Zachariou и соавт. [60] провели двойное слепое контролируемое многоцентровое исследование с параллельными группами у 250 больных с мягкой и умеренной эссенциальной гипертонией (диастолическое артериальное давление 95–114 мм рт. ст.) и дислипидемией (холестерин липопротеинов высокой плотности (ХСЛПВП) ниже 1,03 ммоль/л, общий холестерин 5,17–9,05 ммоль/л, триглицериды 2,26–5,64 ммоль/л). Пациенты получали модифицированное по содержанию жиров питание. После 4-недельного вводного периода на плацебо больные были рандомизированы в группы карведилола в дозе 25–50 мг один раз в сутки (n = 116) или каптоприла в дозе 25–50 мг два раза в сутки (n = 117) в течение 6 месяцев. В обеих группах отмечены положительные эффекты на липиды сыворотки. Относительная динамика (медианы) в группах карведилола и каптоприла была следующей: увеличение ХСЛПВП на 11% и 8% соответственно (p < 0,05), снижение общего холестерина на 11% и 10%, холестерина липопротеинов низкой плотности – на 16% и 12%, триглицеридов – на 13% и 14%. Снижение артериального давления в двух группах было сопоставимым (карведилол: 23/19 мм рт. ст., каптоприл: 20/18 мм рт. ст.). Авторы считают, что улучшение обмена липидов у больных, получающих лечение карведилолом, происходит за счет его альфа1-блокирующих свойств [60].
Переносимость
Карведилол отличался хорошей переносимостью во всех двойных слепых рандомизированных клинических исследованиях. В рамках US Carvedilol Heart Failure Program только 0,4–0,9% пациентов прекращали лечение из-за появления побочных эффектов [22]. В исследовании COPERNICUS только 4,4% пациентов прекратили терапию из-за появления нежелательных явлений (исключая смерть) [27]. В ретроспективном исследовании Carvedilol Open-Label Assessment (COLA) изучали исходные предикторы переносимости у 808 пациентов с ХСН, получающих карведилол (средняя доза 19 мг дважды в день) [61]. Удовлетворительная переносимость наблюдалась у 88% пациентов. Одиночный регрессионный анализ показал, что предикторами непереносимости являются пожилой возраст (ОР 1,01; 95% ДИ 1,0–1,3), низкое диастолическое АД (ОР 1,04; 95% ДИ 1,02–1,08), высокая концентрация мочевины в плазме (ОР 1,04; 95% ДИ 1,02–1,05). При множественном регрессионном анализе не выявлено никаких факторов, предрасполагающих к непереносимости карведилола.
Переносимость
Карведилол отличался хорошей переносимостью во всех двойных слепых рандомизированных клинических исследованиях. В рамках US Carvedilol Heart Failure Program только 0,4–0,9% пациентов прекращали лечение из-за появления побочных эффектов [22]. В исследовании COPERNICUS только 4,4% пациентов прекратили терапию из-за появления нежелательных явлений (исключая смерть) [27]. В ретроспективном исследовании Carvedilol Open-Label Assessment (COLA) изучали исходные предикторы переносимости у 808 пациентов с ХСН, получающих карведилол (средняя доза 19 мг дважды в день) [61]. Удовлетворительная переносимость наблюдалась у 88% пациентов. Одиночный регрессионный анализ показал, что предикторами непереносимости являются пожилой возраст (ОР 1,01; 95% ДИ 1,0–1,3), низкое диастолическое АД (ОР 1,04; 95% ДИ 1,02–1,08), высокая концентрация мочевины в плазме (ОР 1,04; 95% ДИ 1,02–1,05). При множественном регрессионном анализе не выявлено никаких факторов, предрасполагающих к непереносимости карведилола.
Вследствие того, что значительная часть пациентов с сердечно-сосудистой патологией являются пожилыми субъектами, для определения переносимости карведилола в данной подгруппе больных было инициировано исследование COLA II [62]. В него были включены 1030 пациентов с ХСН > 70 лет, разделенных на три группы в зависимости от возраста. Краткая исходная характеристика участников приведена в таблице 4. Пациенты наблюдались в течение 6 месяцев после назначения карведилола. Хорошей переносимостью считали возможность использования минимум 6,25 мг карведилола дважды в день в течение более чем 3 месяцев. Общая переносимость составила 80%, в группе 70–75 лет – 84,3%, 76–80 лет – 76,8%, > 80 лет – 76,8%. Средняя достигнутая доза карведилола – 31,2 мг. При множественном анализе показано, что на переносимость влияют возраст, низкое диастолическое АД, ФВЛЖ, наличие сахарного диабета и хронической обструктивной болезни легких. Авторы делают вывод о том, что возраст не является критерием отмены карведилола у пациентов с ХСН [62]. Интерес представляют результаты исследования, свидетельствующие о том, что уровень мозгового натрийуретического пептида является предсказательным фактором в отношении переносимости карведилола у больных с ХСН.
При изучении 70 пациентов с тяжелой ХСН показано, что концентрация данного вещества 600 нг/л является пороговым значением. При уровнях мозгового натрийуретического пептида выше 600 нг/л переносимость карведилола достоверно хуже (p < 0,0005) [63]. Таким образом, использование карведилола является несомненно клинически эффективным и безопасным у пациентов с сердечно-сосудистыми заболеваниями, включая особые подгруппы: больные сахарным диабетом 2 типа, лица пожилого и старческого возраста. Вследствие своих уникальных фармакодинамических характеристик карведилол позволяет решать задачи, недоступные для других бета-адреноблокаторов, воздействуя одновременно на несколько целевых параметров. Использование карведилола является не только клинически, но и экономически выгодным, что обязательно следует учитывать в ситуации, с которой сталкивается современное российское здравоохранение.
1. Ruffolo R., Gellai M, Hieble J. et al. The pharmacology of carvedilol // Eur J Clin Pharmacol. 1990; 38(Suppl 2): S82–S88.
2. Morgan T. Clinical pharmacokinetics and pharmacodynamics of carvedilol // Clin Pharmacokinet. 1994; 26 (5): 335–46.
3. Keating G., Jarvis B. Carvedilol. A review of its use in chronic heart failure // Drugs. 2003; 63 (16): 1697–741.
4. Kubo T., Azevedo E., Newton G. et al. Lack of evidence for peripherical alpha1-adrenoceptor blockade during long-term treatment of heart failure with carvedilol // J Am Coll Cardiol. 2001; 38(5): 1463–69.
5. Gilbert E., Abraham W., Olsen S. et al. Comparative hemodynamic, left ventricular functional and antiadrenergic effects of chronic treatment with metoprolol versus carvedilol in the failing heart // Circulation. 1996; 94(11): 2817–2825.
6. Packer M., Colucci W., Sackner-Bernstein J. et al. Duble blind, placebo-controlled study of the effects of carvedilol in patients with moderate to severe heart failure: the PRECISE trial // Circulation. 1996; 94(11): 2793–2799.
7. Cohn J., Fowler M., Bristow M. et al. Safety and efficacy of carvedilol in severe heart failure. US Carvedilol Heart Failure Study Group // J Card Fail. 1997; 3: 173–179.
8. Australia/New Zealand Heart Failure Research Collaborative Group. Randomized, placebo-controlled trial of carvedilol in patients with congestive heart failure due to ischemic heart disease // Lancet. 1997; 349: 375–80.
9. Krum H., Sackner-Bernstein J., Goldsmith R. et al. Double-blind, placebo-controlled study of the long-term efficacy of carvedilol in patients with severe chronic heart failure // Circulation. 1995; 92(6): 1499–1506.
10. Doughty R., Whalley G., Walsh H. et al. Effects of carvedilol on left ventricular remodeling in patients following acute myocardial infarction: the CAPRICORN echo substudy // Circulation. 2001; 104 (17 Suppl): 517.
11. Ridha M., Makikallio T., Lopera G. et al. Effects of carvedilol on heart rate dynamics in patients with congestive heart failure. Ann Noninvasive Electrocardiol. 2002; 7(2): 133–138.
12. Dandona P., Karne R., Ghanim H. et al. Carvedilol inhibits reactive oxygen species generation by leukocytes and oxidative damage to aminoacids // Circulation. 2000; 101: 122–24.
13. Maggi E., Marchesi E., Covini D. Et al. Protective effects of carvedilol, a vasodilating beta-adrenoceptor blocker, against in vivo low density lipoprotein oxidation in essential hypertension // J Cardiovasc Pharmacol. 1996; 27(4): 532–538.
14. Giugliano D., Acampora R., Marfella R. et al. Metabolic and cardiovascular effects of carvedilol and atenolol in non-insulin-dependent diabetes mellitus and hypertension: a randomized control trial // Ann Intern Med. 1997; 126(12): 955–959.
15. Nakamura K., Kusano K., Nakamura Y. et al. Carvedilol decreases elevated oxidative stress in human failing myocardium // Circulation. 2002; 105(24): 2867–71.
16. Rossig L., Haendeler J., Mallat Z. et al. Congestive heart failure induces endothelial cell apoptosis: protective role of carvedilol // J Am Coll Cardiol. 2000; 36(7): 2081–89.
17. Patel M., Chan P., Betteridge L. Inhibition of human vascular smooth muscle cell proliferation. J Cardiovasc Pharmacol. 1995; 25(4): 652–7.
18. Heitmann M., Davidsen U., Stokholm K. Et al. Renal and cardiac function during alpha1-beta-blockade in congestive heart failure. Scand J Clin Lab Invest. 2002; 62(2): 97–104.
19. Refsgaard J., Andreasen F., Goetzsche O. Improvement of endothelial dysfunction in patients with chronic heart failure during treatment with carvedilol // Eur Heart J. 1999; 20 Suppl: 375.
20. de Boer R., Siebelink H., Tio R. et al. Carvedilol increases plasma vascular endothelial growth factor (VEGF) in patients with chronic heart failure // Eur J Heart Fail. 2001; 3: 343–349.
21. Ohtsuka T., Hamada M., Saeki H. et al. Comparison of effects of carvedilol versus metoprolol on cytokine levels in patients with idiopathic dilated cardiomyopathy // Am J Cardiol. 2002; 89(8): 996–9.
22. Packer M., Bristow M., Cohn J. et al. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure // N Engl J Med. 1996; 334(21): 1349–55.
23. Colucci W., Packer M., Bristow M. et al. Carvedilol inhibits clinical progression in patients with mild symptoms of heart failure // Circulation. 1996; 94: 2800–2806.
24. Packer M., Colucci W., Sackner-Bernstein J. et al. Double-blind, placebo-controlled study of the effects of carvedilol in patients with moderate to severe heart failure: the PRECISE trial // Circulation. 1996; 94: 2793–2799.
25. Poole-Wilson P., Swedberg K., Cleland J. et al. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomized controlled trial // Lancet. 2003; 362: 7–13.
26. Packer M., Antonopolous G., Berlin J. et al. Comparative effects of carvedilol and metoprolol on left ventricular ejection fraction in heart failure: results of a meta-analysis // Am Heart J. 2001; 141: 899–907.
27. Packer M., Coats A., Fowler M. et al. Effect of carvedilol on survival in severe chronic heart failure // N Engl J Med. 2001; 344(22): 1651–1658.
28. Mohasci P., Fowler M., Krum H. et al. Should physician avoid the use of beta-blockers in patients with heart failure who have diabetes? Results of the COPERNICUS study // Circulation 2001; 104 (Suppl. 2): 754.
29. Krum H., Roecker E., Mohasci P. et al. Effects of initiating carvedilol in patients with severe chronic heart failure: results from the COPERNICUS study // JAMA. 2003; 289(6): 712–8.
30. Angermann C., Costard-Jaeckle A., Deng M. et al. Is carvedilol safe and efficacious in severe heart failure patients accepted for heart transplantation // J Heart Lung Transplant. 2001; 20(2): 250–251.
31. Metra M., Nardi M., Giubbini R. Effects of short- and long-term carvedilol administration on rest and exercise hemodynamic variables, exercise capacity and clinical conditions in patients with idiopathic dilated cardiomyopathy // J Am Coll Cardiol. 1994; 24(7): 1678–1687.
32. Di Lenarda A., Sabbadini G., Salvatore L. et al. Long-term effects of carvedilol in idiopathic dilated cardiomyopathy wit persistent left ventricular dysfunction despite chronic metoprolol // J Am Coll Cardiol. 1999; 33(7): 1926–1934.
33. Piano M. Alcoholic cardiomyopathy. Incidence, clinical characteristics and pathophysiology. Chest. 2002; 121: 1638–50.
34. The CAPRICORN Investigators. Effect of carvedilol on outcome after myocardial infarction in patients with left-ventricular dysfunction: the CAPRICORN randomized trial // Lancet. 2001; 357: 1385–1390.
35. McMurray J., Dargie H., Ford I. et al. Carvedilol reduces supraventricular and ventricular arrhythmias after myocardial infarction: evidence from the CAPRICORN study // Circulation. 2001; 104 (Suppl. 2): 343.
36. Senior R., Basu S., Kinsey C. et al. Carvedilol prevents remodeling in patients with left ventricular dysfunction after acute myocardial infarction // Am Heart J. 1999; 137(4): 646–652.
37. Cleland J., Pennel D., Ray S. et al. Myocardial viability as a determinant of the ejection fraction response to carvedilol in patients with heart failure (CHRISTMAS): randomized controlled trial // Lancet. 2003; 362: 14–21.
38. Dalle Mule J., Cleland J., Pennel D. et al. Effect of carvedilol to correct interventricular dyssynchrony in patients with chronic heart failure due to iscemic left ventricular systolic dysfunction: results of the CHRISTMAS study. 52nd Annual Scientific Session of the American College of Cardiology; 2003 Mar 30 – Apr 2. Chicago (IL).
39. Bergstroem A., Andersson B., Edner M. et al. Carvedilol improves diastolic function in patients with diastolic heart failure. For the SWEDIC Investigators // Circulation. 2001; 104: 718.
40. Remme W. The Carvedilol and ACE-Inhibitor Remodelling Mild Heart Failure Evaluation Trial (CARMEN): rationale and design. CARMEN Steering Committee // Cardiovasc Drugs Ther. 2001; 15: 69–77.
41. Doughty R., Rodgers A., Sharpe N. et al. Effects of beta-blockers therapy on mortality in patients with heart failure: a systematic overview of randomized controlled trials // Eur Heart J. 1997; 18(4): 560–5.
42. Lechat P., Packer M., Chalon S. et al. Clinical effects of beta-adrenergic blockade in chronic heart failure: a meta-analysis of double-blind, placebo-controlled randomized trials // Circulation. 1998; 98: 1184–91.
43. Delea T., Vera-Llonch M., Richner R. et al. Cost effectiveness of carvedilol for heart failure // Am J Cardiol. 1999; 83: 890–6.
44. Stewart S., McMurray J., Hebborn A. et al. Carvedilol reduces the costs of medical care in severe heart failure: an economic analysis of the COPERNICUS study applied to the United Kingdom // Eur Heart J. 2002; 23 Suppl: 136.
45. Joglar J., Acusta A., Shusterman N. et al. Effect of carvedilol on survival and hemodynamics in patients with atrial fibrillation and left ventricular dysfunction: Retrospective analysis of the US Carvedilol Heart Failure Trials Program // Am Heart J. 2001; 142: 498–501.
46. Khand A., Rankin A., Martin W. et al. Carvedilol alone or in combination with digoxin for the management of atrial fibrillation in patients with heart failure? // J Am Coll Cardiol. 2003; 42: 1944–51.
47. Kanoupakis E., Manios E., Mavkaris H. et al. Comparative effects of carvedilol and amiodarone on conversion and recurrence rates of persistent atrial fibrillation // Am J Cardiol. 2004; 94: 659–62.
48. Nagele H., Bohlmann M., Eck U. et al. Combination therapy with carvedilol and amiodarone in patients with severe heart failure // Eur J Heart Fail. 2000; 2: 71–79.
49. Katritsis D., Panagiotakos D., Karvouni E. et al. Comparison of effectiveness of carvedilol versus bisoprolol for maintenance of sinus rhythm after cardioversion of persistent atrial fibrillation // Am J Cardiol. 2003; 92: 1116–9.
50. Merritt J., Niebaur M., Tarakji K. et al. Comparison of effectiveness of carvedilol versus metoprolol or atenolol for atrial fibrillation appearing after coronary artery bypass grafting or cardiac valve operation // Am J Cardiol. 2003; 92: 735–6.
51. McMurray J., Kober L., Robertson M. et al. Antiarrhythmic effect of carvedilol after acute myocardial infarction Results of the Carvedilol Post-Infarct Survival Control in Left Ventricular Dysfunction (CAPRICORN) trial // J Am Coll Cardiol. 2005; 45: 525–30.
52. Cice G., Tagliamonte E., Ferrara L. et al. Efficacy of carvedilol on complex ventricular arrhythmias in dilated cardiomyopathy: Double-blind, randomized, placebo-controlled study // Eur Heart J. 2000; 21: 1259–1264.
53. Senior R., Muller-Beckmann B., DasGupta P. et al. Effects of carvedilol on ventricular arrhythmias // J Cardiovasc Pharmacol. 1992; 19(Suppl 1): S117–S121.
54. Jacob S., Rett K., Henriksen E. Antihypertensive therapy and sensitivity with insulin: should we revise the role of beta-blockers? // Am J. Hypertens. 1998; 11: 1258–65.
55. Dornhorst A., Powell S., Pensky J. Aggravation by propranolol of hyperglycaemic effect of hydrochlorothiazide in type II diabetics without alteration of insulin secretion // Lancet. 1985; 1: 123–126.
56. Holzgreve H., Nakov R., Beck K. et al. Antihypertensive therapy with verapamil SR plus trandolapril versus atenolol plus chlorthalidone on glycemic control // Am J Hypertens. 2003; 16: 381–6.
57. Hansson L., Lindholm L., Ekbom T. et al. Randomised trial of old and new antihypertensive drugs in elderly patients: cardiovascular mortality and morbidity the Swedish Trial in Old Patients with Hypertension-2 study // Lancet. 1999; 354: 1751–56.
58. Khaw K., Wareham N., Luben R. et al. Glycated haemoglobin, diabetes, and mortality in men in Norfolk cohort of European Prospective Investigation of Cancer and Nutrition (EPIC-Norfolk) // BMJ. 2001; 322: 15–18
59. Bakris G., Fonseca V., Katholi R. et al. Metabolic Effects of Carvedilol vs Metoprolol in Patients With Type 2 Diabetes Mellitus and Hypertension. A Randomized Controlled Trial // JAMA. 2004; 292: 2227–36
60. Hauf-Zachariou U., Widmann L., Zulsdorf B. et al. Double blind controlled study of efficacy carvedilol and captopril to lipid profile in patients with mild and moderate arterial hypertension and dyslipidemia // Eur J Clin Pharmacol. 1993; 45: 95–100.
61. Krum H., Ninio D., MacDonald P. Baseline predictors of tolerability to carvedilol in patients with chronic heart failure // Heart. 2000; 84: 615–619.
62. Krum H., Hill J., Fruhwald F. et al. Tolerability of beta-blockers in elderly patients with chronic heart failure: The COLA II study. www.cipladoc.com/publications/Bscope/Bscope_Issue3.htm
63. Matsuda N., Endo Y., Uchida Y. et al. Plasma brain natriuretic peptide levels predict tolerance to carvedilol in patients with severe heart failure. Circulation 2000; 102 (18 Suppl 2); 627-628.
64. Лукина Ю.В., Марцевич С.Ю., Деев А.Д., Шальнова С.А. Сравнительное контролируемое исследование антигипертензивной эффективности и безопасности карведилолом у больных артериальной гипертонией и ожирением или сахарным диабетом 2 типа (по результатам многоцентрового исследования АККОРД) // Рациональная фармакотерапия в кардиологии. 2009; №3: 19–24.
Новости на тему
13.02.2025
14.05.2024
05.02.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
За прошедшие несколько десятилетий в кардиологии произошли серьезные изменения, которые значительно обогатили арсенал имеющихся лечебно-профилактических методов.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
