Взаимообусловленность нарушений нервной и иммунной систем при хронической обструктивной болезни легких и неврологической патологии у лиц пожилого и старческого возраста
- Аннотация
- Статья
- Ссылки
- English
Цель – выявить наиболее информативные и взаимосвязанные биомаркеры, характеризующие дисфункции иммунной и нервной систем у пациентов пожилого и старческого возраста с ХОБЛ и неврологической патологией.
Материал и методы. Исследованы 44 пациента обоего пола в возрасте 60–78 лет, а также 10 условно здоровых добровольцев соответствующего пола и возраста. Были сформированы три клинические группы исследования (ГИ): ГИ1 – 16 пациентов с неврологической патологией, ГИ2 – 15 пациентов с обострением ХОБЛ, осложненной дыхательной недостаточностью первой и второй степени, ГИ3 – 13 пациентов с обострением ХОБЛ, осложненной дыхательной недостаточностью первой и второй степени, и неврологической патологией. Проводились общеклиническое обследование пациентов, оценка лимфоцитарного звена иммунной системы, исследование эффекторных функций и субпопуляций нейтрофильных гранулоцитов, экспрессирующих рецепторы CD63, CD16, CD62L, CD11b, а также определение сывороточной концентрации маркерных нейропептидов.
Результаты. Выявлены дисфункция лимфоцитарного звена иммунной системы, нарушение эффекторных функций нейтрофильных гранулоцитов в виде снижения способности к захвату и киллингу патогена, а также перераспределение поверхностных мембранных рецепторов на нейтрофильных гранулоцитах, характеризующее их переориентацию на дегрануляцию. Кроме того, отмечаются повышение концентрации нейропептидов, отражающих гибель нейронов, наиболее выраженное у пациентов с неврологической и сочетанной патологией, и снижение концентрации нейропептидов, характеризующих нейротрофические процессы, наиболее выраженное у пациентов с ХОБЛ.
Заключение. Проведенный корреляционный анализ позволил установить взаимосвязь дисфункции нервной и иммунной систем, что указывает на их тесную интеграцию и необходимость совместной оценки функционирования данных систем, для чего возможно использование выявленных биомаркеров.
Цель – выявить наиболее информативные и взаимосвязанные биомаркеры, характеризующие дисфункции иммунной и нервной систем у пациентов пожилого и старческого возраста с ХОБЛ и неврологической патологией.
Материал и методы. Исследованы 44 пациента обоего пола в возрасте 60–78 лет, а также 10 условно здоровых добровольцев соответствующего пола и возраста. Были сформированы три клинические группы исследования (ГИ): ГИ1 – 16 пациентов с неврологической патологией, ГИ2 – 15 пациентов с обострением ХОБЛ, осложненной дыхательной недостаточностью первой и второй степени, ГИ3 – 13 пациентов с обострением ХОБЛ, осложненной дыхательной недостаточностью первой и второй степени, и неврологической патологией. Проводились общеклиническое обследование пациентов, оценка лимфоцитарного звена иммунной системы, исследование эффекторных функций и субпопуляций нейтрофильных гранулоцитов, экспрессирующих рецепторы CD63, CD16, CD62L, CD11b, а также определение сывороточной концентрации маркерных нейропептидов.
Результаты. Выявлены дисфункция лимфоцитарного звена иммунной системы, нарушение эффекторных функций нейтрофильных гранулоцитов в виде снижения способности к захвату и киллингу патогена, а также перераспределение поверхностных мембранных рецепторов на нейтрофильных гранулоцитах, характеризующее их переориентацию на дегрануляцию. Кроме того, отмечаются повышение концентрации нейропептидов, отражающих гибель нейронов, наиболее выраженное у пациентов с неврологической и сочетанной патологией, и снижение концентрации нейропептидов, характеризующих нейротрофические процессы, наиболее выраженное у пациентов с ХОБЛ.
Заключение. Проведенный корреляционный анализ позволил установить взаимосвязь дисфункции нервной и иммунной систем, что указывает на их тесную интеграцию и необходимость совместной оценки функционирования данных систем, для чего возможно использование выявленных биомаркеров.


Введение
В настоящее время большую озабоченность у Всемирной организации здравоохранения и правительств разных стран вызывает рост количества людей пожилого и старческого возраста, страдающих различными возраст-ассоциированными заболеваниями. С одной стороны, это является позитивным моментом, поскольку во многом обусловлено хорошим уровнем жизни, доступностью медицинской помощи, что обеспечивает увеличение продолжительности жизни. С другой стороны, рост количества лиц пожилого и старческого возраста с различными возраст-ассоциированными заболеваниями становится тяжелым бременем, поскольку сопряжен с большими финансовыми затратами. В связи с этим особую актуальность представляет поиск новых междисциплинарных подходов к лечению данной когорты пациентов с учетом возрастных особенностей работы разных систем организма. Кроме того, увеличение продолжительности жизни не всегда сопровождается сохранением удовлетворительного качества жизни. Регистрируемые возраст-ассоциированные заболевания и гериатрические синдромы у лиц пожилого и старческого возраста существенно ограничивают их функциональные возможности, приводят к утрате способности к самообслуживанию, а также к прогрессивному возрастанию нагрузки на здравоохранение, что требует увеличения финансовых, человеческих и временных затрат на оказание медицинской помощи таким пациентам [1]. Негативно влияют на качество жизни пациентов многочисленные инфекции, с которыми угасающая иммунная система не способна справиться, что индуцирует формирование вторичного иммунодефицита (ВИД). В частности, на фоне как физиологического иммунодефицита, так и ВИД возникающие респираторные инфекции, в том числе часто повторяющиеся, в сочетании с другими факторами могут привести к развитию и/или обострению хронической обструктивной болезни легких (ХОБЛ) [2]. В свою очередь, частые обострения ХОБЛ сопровождаются респираторными инфекциями различной этиологии, что в совокупности негативно сказывается на функционировании различных органов и систем, в том числе нервной и иммунной. Известно также, что функционирование иммунной системы значительно влияет на частоту и тяжесть обострений ХОБЛ, которые нередко сопровождаются гипоксическим поражением нервной системы [3].
Известно, что функционирование организма, поддержание гомеостаза и адаптация к условиям внешней среды регулируются взаимосвязанной работой нервной, иммунной и эндокринной систем, причем нарушение функций одной из данных систем закономерно вызывает дисфункцию других, что приводит к полиморбидности, утяжеляет течение заболеваний. Так, различные возраст-ассоциированные заболевания, гериатрические синдромы, ВИД, развивающиеся на фоне дисбаланса иммунной системы, зачастую сопровождаются нарушением функционирования нервной и эндокринной систем [4]. Нарушение работы иммунной системы в свою очередь приводит к нарушению нейроэндокринной регуляции гомеостаза.
Интеграция иммунной, нервной и эндокринной систем, обусловленная способностью клеток продуцировать сходный спектр биологически активных молекул (нейромедиаторов, цитокинов), а также способность иммунной системы продуцировать гормоны (катехоламины) и нейропептиды (эндорфины) обязывают современного специалиста учитывать их взаимное влияние при формировании патологических процессов для более совершенного подхода к диагностике и подбора комплексной терапии расстройств, затрагивающих нервную, эндокринную и иммунную функции [5].
Представляется интересным и перспективным исследование нейроиммунных взаимодействий при респираторной патологии, в частности при ХОБЛ, так как данное заболевание является одним из наиболее распространенных в структуре заболеваемости лиц пожилого и старческого возраста, приводит к значительному снижению качества их жизни, вызывает инвалидизацию [6]. Различными авторами показана неоднозначная связь между ХОБЛ и когнитивными нарушениями. Так, одними исследователями была выявлена ассоциация между ранним началом ХОБЛ и формированием когнитивных нарушений и деменции [7]. Однако другими исследователями не установлено связи между тяжестью течения ХОБЛ и когнитивными нарушениями [8]. В связи с этим особенно актуальным представляется поиск лабораторных маркеров повреждения нервной системы у пациентов с ХОБЛ.
С целью оценки повреждения нервной системы различного генеза используется определение концентрации основных маркерных нейропептидов, к которым среди прочих относятся нейронспецифическая енолаза (neuron specific enolase, NSE), белок S100B, основной белок миелина (myelin basic protein, MBP), фактор роста нервов (nerve growth factor, NGF), мозговой нейротрофический фактор (brain-derived neurotrophic factor, BDNF).
NSE – фермент, катализирующий превращение 2-фосфоглицерата в фосфоенолпируват в ходе гликолиза, находящийся в цитоплазме нейронов и нейроэндокринных клеток. Концентрация данного фермента в сыворотке крови повышается при различных состояниях, сопровождающихся гибелью нейронов (ишемический инсульт, внутричерепное кровоизлияние, травма спинного мозга), причем концентрация NSE коррелирует со степенью тяжести поражения нервной системы [9].
Белок S100B – кальцийсвязывающий белок, преимущественно секретируемый астроцитами и при нормальных условиях не проникающий через гематоэнцефалический барьер, но диффундирующий в системное кровообращение при повреждении нейронов центральной нервной системы [10]. На концентрацию белка S100B в сыворотке крови не оказывает влияния гемолиз эритроцитов, что делает его ценным диагностическим маркером повреждения нейронов [11].
MBP – белок, играющий основополагающую роль в формировании миелиновой оболочки нейронов, использующийся также в качестве лабораторного маркера повреждения нервной ткани различного генеза (травматического, метастатического) [12].
NGF – белок, относящийся к семейству нейротрофинов и способствующий выживанию, росту и регенерации нервной ткани [13]. Было выявлено, что снижение сывороточного уровня данного белка коррелирует с когнитивной дисфункцией при нейродегенеративных заболеваниях [14]. Кроме того, известно, что рецепторы к NGF экспрессируются различными клетками легких, включая эпителиальные и гладкомышечные клетки, фибробласты и сосудистый эндотелий, а B- и T-лимфоциты, дендритные клетки, моноциты, тучные клетки и макрофаги секретируют высокие уровни NGF. Базальные уровни NGF обнаруживаются в бронхоальвеолярной лаважной жидкости здоровых людей, что свидетельствует о присутствии данного белка в легочной ткани [3].
BDNF также относится к семейству нейротрофинов. Были получены данные о снижении уровня данного белка при нейродегенеративных заболеваниях (болезни Альцгеймера, болезни Паркинсона), а также при рекуррентном депрессивном расстройстве [15, 16].
Поиск маркеров нейроиммуноэндокринной дисфункции при различных заболеваниях позволит определить оптимальные мишени для проведения терапии и разработки комплексных подходов к ведению пациентов пожилого и старческого возраста, а также для мониторинга и контроля эффективности лечения, что является чрезвычайно актуальным.
Цель исследования
Целью настоящего исследования стало выявление наиболее информативных и взаимосвязанных биомаркеров, характеризующих дисфункции иммунной и нервной систем у пациентов пожилого и старческого возраста с ХОБЛ и неврологической патологией.
Материал и методы
Под нашим наблюдением находилось 44 пациента пожилого и старческого возраста (60–78 лет) обоего пола, госпитализированных в пульмонологическое и неврологическое отделения, и 10 условно здоровых добровольцев соответствующего пола и возраста, проходивших плановую диспансеризацию в ГБУЗ «Клинический госпиталь для ветеранов войн» (Краснодар). Последние составили группу сравнения (ГС).
Были сформированы три клинические группы исследования (ГИ): ГИ1 – 16 пациентов с неврологической патологией, ГИ2 – 15 пациентов с обострением ХОБЛ, осложненной дыхательной недостаточностью (ДН) первой и второй степени, ГИ3 – 13 пациентов с обострением ХОБЛ, осложненной ДН первой и второй степени, и неврологической патологией.
При проведении обследования использовались клинические методы определения общего и локального статуса: опрос и осмотр пациента с применением стандартной методики и необходимого набора инструментов в соответствии с медицинской картой стационарного больного (форма № 003/у, утвержденная приказом Минздрава СССР от 04.10.1980 № 1030).
Лица, участвующие в исследовании, подписали добровольное письменное информированное согласие на участие в нем.
При поступлении в стационар до проведения лечебных мероприятий всем пациентам было проведено исследование иммунной системы методом проточной цитометрии на Сytomics FC500 (Веckman Coulter, США) с использованием моноклональных антител (Веckman Coulter, США). Определяли содержание Т-лимфоцитов (CD3+CD19-, CD3+CD4+, CD3+CD8+, иммунорегуляторный индекс (ИРИ) (CD3+CD4+/CD3+CD8+)), В-лимфоцитов (CD3-CD19+), естественных киллерных клеток (ЕКК) (CD3-CD16+CD56+). Кроме того, исследовалось содержание субпопуляций CD63-CD16+CD62L+CD11b+ («основная функциональная» субпопуляция, которая преобладает у 98–99% условно здоровых людей) и CD63+CD16+CD62L+CD11b+ («малая цитотоксическая» субпопуляция нейтрофильных гранулоцитов (НГ), которая в малых количествах является сигнальной, а в больших количествах – способной повреждать окружающие ткани в результате дегрануляции и встречается у 0,5–1,0% условно здоровых лиц). Оценка фагоцитарной активности НГ проводилась по количеству активно фагоцитирующих НГ (%ФАН) с учетом процессов захвата (фагоцитарное число (ФЧ), фагоцитарный индекс (ФИ)) и киллинговой активности (процент переваривания (%П), индекс переваривания (ИП)) по отношению к Staphylococcus aureus (штамм № 209). NADPH-оксидазную активность оценивали в спонтанном и стимулированном NBT-тесте путем подсчета активированных клеток на 100 НГ.
Для установления повреждения нервной системы методом твердофазного иммуноферментного анализа (Thermo Fisher Scientific Multiskan FC, Китай) были использованы общепринятые лабораторные сывороточные маркеры: NSE, белок S100B, MBP, NGF, BDNF.
Статистическая обработка полученных результатов осуществлялась с помощью компьютерной программы Microsoft Excel 2016, а также среды Python с использованием библиотек SciPy, Matplotlib, Seaborn, Pandas. Полученные количественные данные проверялись на нормальность распределения с помощью критерия Шапиро – Уилка. Так как наблюдаемые распределения отличались от нормального, для последующей обработки данных были использованы методы непараметрической статистики. Для установления статистической значимости различий нескольких несвязанных выборок применялся критерий Краскела – Уоллиса. При выявлении статистической значимости различий проводились попарные апостериорные сравнения с помощью U-критерия Манна – Уитни, а значение p корректировалось с учетом множественных сравнений по методу Бенджамини – Хохберга. Кроме того, оценивался характер связи исследуемых количественных показателей путем расчета коэффициента ранговой корреляции Спирмена. При его абсолютном значении, равном нулю, констатировалось отсутствие связи, при значениях от 0,10 до 0,29 связь оценивалась как слабая, при значениях от 0,3 до 0,69 – как средняя, свыше 0,70 – как сильная. При значениях коэффициента ранговой корреляции Спирмена больше нуля связь считалась положительной, при значениях меньше нуля – отрицательной.
Различия считали статистически значимыми при p < 0,05.
Результаты представляли в виде медианы, а также верхнего и нижнего квартилей (Me (Q1; Q3)).
Результаты и их обсуждение
У пациентов ГИ1 была установлена неврологическая патология, представленная дисциркуляторной энцефалопатией (ДЭП) смешанного генеза (гипертонического, атеросклеротического), деструктивно-дегенеративными заболеваниями позвоночника (ДДЗП), хроническим болевым синдромом различной степени выраженности, астеническим синдромом с последствиями ранее перенесенного острого нарушения мозгового кровообращения (ОНМК) (спастический гемипарез, пирамидная недостаточность, гемипарестезия).
У пациентов ГИ2 диагностировано обострение ХОБЛ, осложненной ДН первой и второй степени.
В ГИ3 у пациентов наблюдалась сочетанная патология: неврологическая – ДЭП смешанного генеза (гипертонического, атеросклеротического), ДДЗП, хронический болевой синдром различной степени выраженности, астенический синдром, последствия ранее перенесенного ОНМК; респираторная – обострение ХОБЛ, осложненной ДН первой и второй степени.
Клиническая картина ХОБЛ в ГИ2 и ГИ3 характеризовалась преобладанием бронхитического и смешанного фенотипов над эмфизематозным, а также частыми (два-три раза в год) и затяжными обострениями ХОБЛ, частым (5,40 ± 1,17 раза в год) развитием острых респираторных вирусных инфекций длительностью 7,90 ± 3,14 дня, требовавших проведения антибактериальной терапии в 2,70 ± 0,82 случая.
Все пациенты трех групп исследования жаловались на нарушение когнитивных функций (снижение памяти, внимания, способности к обучению, работоспособности).
Пациенты с установленной неврологической патологией (ГИ1 и ГИ3) перед поступлением в стационар получали курсами терапию ноотропными препаратами.
В лечении пациентов с ХОБЛ (ГИ2 и ГИ3) в качестве базисной терапии применялись комбинированные препараты – ингаляционные глюкокортикостероиды и длительно действующие β2-агонисты, ингаляционные M-холинолитики, а также в режиме «по требованию» или в период обострения ХОБЛ – коротко действующие β2-агонисты.
На основании клинического, лабораторного и иммунологического обследования пациентов выявлены нарушения функционирования иммунной системы.
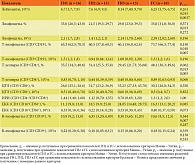
При оценке общего анализа крови показатели общего количества лейкоцитов и субпопуляций лимфоцитов в ГИ1 не отличались от таковых в ГС (p1–4 > 0,05). У пациентов ГИ2 и ГИ3 выявлено увеличение уровня лейкоцитов – 7,6 (6,9; 9,5) и 8,14 (7,40; 9,70) против 6,25 (5,75; 6,75) × 109/л в ГС (р1 = 0,015, р2 = 0,0037). В ГИ2 и ГИ3 установлено также снижение содержания лимфоцитов – 21,5 (19,3; 29,7) и 29,0 (23,0; 39,5) против 35,0 (31,0; 36,0)% в ГС (р1 = 0,013, р2 = 0,272) (табл. 1).
При исследовании ГИ2 и ГИ3 выявлено снижение в 1,2 раза относительного содержания Т-лимфоцитов (СD3+CD19-) по сравнению с ГС (р1 = 0,010, p2 = 0,005). Отмечалось снижение в 1,6 раза количества Т-хелперов (СD3+СD4+) в ГИ2 и ГИ3 против показателей ГС (р1 = 0,013, p2 = 0,005). В то же время обнаружена тенденция к повышению содержания цитотоксических Т-лимфоцитов (ЦТЛ) (СD3+СD8+) в ГИ2 и ГИ3 по сравнению с ГС (р = 0,550), что отразилось на показателях иммунорегуляторного индекса, свидетельствующих о нарушении соотношения лимфоцитов с хелперной и цитотоксической активностью. Кроме того, выявлено уменьшение количества B-лимфоцитов (СD3-CD19+) в ГИ2 (p = 0,007) и ГИ3 (p = 0,287) по сравнению с ГС. Помимо этого обнаружена тенденция к увеличению содержания ЕКK (CD3-СD16+СD56+) в ГИ2 и ГИ3 в отличие от ГС (p = 0,085). При исследовании лимфоцитарного звена в ГИ у пациентов пожилого и старческого возраста при наличии ХОБЛ и сочетанной респираторной (ХОБЛ) и неврологической патологии отмечались более выраженные изменения в виде дисбаланса Т-клеточного звена иммунной системы, снижения уровня B-лимфоцитов и увеличения уровня ЕКК, тогда как при наличии только неврологической патологии данных нарушений не было выявлено.
Более выраженные дефекты функционирования иммунной системы были определены при анализе функциональной активности НГ.
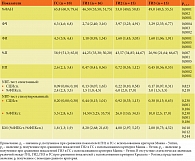
Оценка количественных и функциональных показателей эффекторной фагоцитарной функции НГ показала снижение %ФАН в ГИ1 (p = 0,0001), ГИ2 (p = 0,002), ГИ3 (p = 0,0001); ФЧ в ГИ1 (p = 0,0004), ГИ2 (p = 0,003), ГИ3 (p = 0,0002); ФИ в ГИ1 (p = 0,0001), ГИ2 (p = 0,0005), ГИ3 (p = 0,0001) против ГС. Установлено также статистически значимое снижение процессов киллинга и переваривания бактериального антигена за счет снижения %П в ГИ1 в 1,3 раза (p = 0,007), в ГИ2 в 1,4 раза (p = 0,001), в ГИ3 в 2,2 раза (p = 0,0005) по сравнению с ГС, что свидетельствует о неадекватном ответе иммунной системы на инфекционный процесс. На этом фоне отмечалось отсутствие статистически значимых изменений активности NADPH-оксидаз в спонтанном (процент формазан-позитивных клеток (%ФПКсп.), средний цитохимический индекс (СЦИсп.)) NBT-тесте (p%ФПКсп. = 0,218, pСЦИсп. = 0,823). В стимулированном (%ФПКст., СЦИст.) NBT-тесте в ГИ2 наблюдалось статистически значимое повышение NADPH-оксидазной активности по сравнению с ГС (p = 0,001). При этом отсутствовали статистически значимые различия в ГИ1 (p = 0,230) и ГИ3 (p = 0,186) по сравнению с ГС. Кроме того, отмечено сохранение резервного микробицидного потенциала, о чем свидетельствует статистически значимое повышение коэффициента мобилизации (КМ) в ГИ1 (p = 0,018) и ГИ2 (p = 0,012) по сравнению с ГС. В ГИ3 значения КМ статистически значимо не отличались от значений в ГС (p = 0,244).
Сравнительный анализ эффекторных функций НГ выявил наиболее выраженные нарушения: в ГИ1 – нарушение процессов захвата бактериального антигена (%ФАН), в ГИ3 – снижение киллинговой и переваривающей активности (табл. 2).
Изменения функционирования НГ связаны с перераспределением плотности экспрессии поверхностных мембранных рецепторов CD63, CD16, CD11b на субпопуляциях НГ CD63-CD16+CD62L+CD11b+ и CD63+CD16+CD62L+CD11b+, совместное действие которых обеспечивает реализацию их цитотоксичности. Соотношение и количественное содержание в периферической крови субпопуляций CD63-CD16+CD62L+CD11b+ НГ
и CD63+CD16+CD62L+CD11b+ НГ не имело статистически значимых различий во всех ГИ по сравнению с ГС. Так, уровень субпопуляции CD63-CD16+CD62L+CD11b+ НГ составил 97,39 (94,13; 97,83)% в ГИ1, 96,39 (89,16; 98,99)% в ГИ2, 95,26 (86,25; 96,28)% в ГИ3 против 98,19 (98,165; 98,19)% в ГС (p = 0,177), уровень субпопуляции CD63+CD16+CD62L+CD11b+ НГ – 1,09 (0,43; 1,78)% в ГИ1, 0,35 (0,12; 10,81)% в ГИ2, 0,86 (0,11; 6,15)% в ГИ3 против 0,24 (0,16; 0,27)% в ГС (p = 0,434).
При этом обращало на себя внимание то, что в ГС обе субпопуляции НГ имели одинаковую плотность экспрессии рецепторов CD16, CD62L, CD11b, определяемой по средней интенсивности флуоресценции (mean fluorescent intensity, MFI). В ГИ1, ГИ2 и ГИ3 в субпопуляции CD63+CD16+CD62L+CD11b+ НГ регистрировались в два раза более высокие значения экспрессии CD16 (рис. 1).
Кроме того, наблюдалась более высокая плотность экспрессии CD63 на НГ субпопуляции CD63+CD16+CD62L+CD11b+ по отношению к ГС: в ГИ1 в 2 раза (p = 0,009), в ГИ2 в 2,3 раза (p = 0,009), в ГИ3 в 2,5 раза (p = 0,010). Плотность экспрессии CD16 не менялась в ГИ1, ГИ2 и ГИ3 по сравнению с ГС (p = 0,428). Отмечалось также статистически значимое снижение MFI CD11b в ГИ3 (p = 0,006) и ГИ1 (p = 0,023), а в ГИ2 значения не отличались от значений в ГС (p = 0,075) (см. рис. 1).
В преобладающей субпопуляции CD63-CD16+CD62L+CD11b+ НГ выявлено статистически значимое снижение плотности экспрессии CD16 – в ГИ1 в 2,7 раза (p = 0,009), в ГИ3 в 1,7 раза (p = 0,015), в ГИ2 в 3 раза (p = 0,009), что является неблагоприятным прогностическим признаком течения заболевания.
Регистрировалось статистически значимое снижение MFI CD62L в ГИ1 по сравнению с ГС (p = 0,036), а также отсутствие статистически значимых различий между ГИ2 (p = 0,183) и ГИ3 (p = 0,419) по сравнению с ГС. Кроме того, зафиксирована статистически незначимая тенденция к снижению MFI CD11b в ГИ1 (p = 0,547), ГИ2 (p = 0,063) и ГИ3 (p = 0,079) по отношению к ГС (см. рис. 1).
Выявленные изменения свидетельствуют о переориентировании НГ на процессы дегрануляции и/или формирования нейтрофильных экстрацеллюлярных сетей (neutrophil extracellular traps, NETs) у пациентов не только с ХОБЛ (ГИ2), но и с изолированной неврологической патологией (ГИ1), а также с сочетанной патологией (ГИ3), что может являться одним из патогенетических механизмов повреждения нервной системы. Подтверждением тому служит изменение концентрации маркерных нейропептидов дисфункции нервной системы. Так, обнаружено повышение концентрации NSE: 142,95 (69,26; 164,32) нг/мл в ГИ1, 64,17 (36,66; 98,33) нг/мл в ГИ2, 57,39 (41,98; 65,81) нг/мл в ГИ3 против 20,36 (18,75; 25,54) нг/мл в ГС. При последующем попарном сравнении концентрация NSE оказалась статистически значимо выше в ГИ1 (p = 0,044) и ГИ3 (p = 0,044) по сравнению с концентрацией в ГС, что указывает на повреждение нервной ткани, сопровождающееся гибелью нейронов, у пациентов с неврологической патологией. Однако не установлено статистически значимых различий между ГИ2 и ГС (p = 0,097), ГИ1 и ГИ2 (p = 0,210), ГИ1 и ГИ3 (p = 0,123), ГИ2 и ГИ3 (p = 0,601).
Принимая во внимание, что концентрация данного фермента в сыворотке крови повышается при различных состояниях, сопровождающихся гибелью нейронов, и коррелирует со степенью тяжести поражения нервной системы, можно утверждать, что полученные данные подтверждают повреждение нервной ткани в ГИ1, ГИ2 и ГИ3 [13]. NSE, обеспечивая энергетический потенциал клеток и играя существенную роль в прогрессировании воспалительных процессов за счет поддержания перехода на анаэробный тип метаболизма, стимулирует синтез провоспалительных цитокинов, тем самым поддерживая хроническое воспаление как в легочной, так и в нервной ткани.
Белок S100B определялся на более высоком уровне в ГИ1 (135,92 (118,28; 342,17) пг/мл (p = 0,003)) и ГИ3 (122,13 (110,13; 133,10) пг/мл (p = 0,003)). Уровень белка S100B в ГИ2 составил 126,14 (105,98; 145,99) пг/мл и не отличался от значений в ГС (102,51 (99,99; 104,51) пг/мл) (p = 0,077). При этом различия между ГИ1 и ГИ2 (p = 0,388), ГИ1 и ГИ3 (p = 0,388), ГИ2 и ГИ3 (p = 1,00) оказались статистически незначимыми. Повышение уровня белка S100B в ГИ1 и ГИ3 демонстрирует не только повреждение нейронов центральной нервной системы, но и повышение проницаемости гематоэнцефалического барьера.
При определении концентрации MBP не выявлено статистически значимых различий между ГИ2 и ГС (p = 0,266), ГИ3 и ГС (p = 0,804), ГИ1 и ГИ2 (p = 0,093), ГИ1 и ГИ3 (p = 0,119), ГИ2 и ГИ3 (p = 0,804). Концентрация MBP составила 0,633 (0,573; 2,618) нг/мл в ГИ1, 0,559 (0,522; 0,586) нг/мл в ГИ2, 0,542 (0,488; 0,648) нг/мл в ГИ3, 0,551 (0,520; 0,555) нг/мл в ГС. При этом в ГИ1 концентрация MBP была статистически значимо выше, чем в ГС (p = 0,030), что может свидетельствовать о разрушении миелиновой оболочки нейронов с вероятностью развития демиелинизирующего процесса, поскольку MBP играет основополагающую роль в формировании миелиновой оболочки нейронов и повышение его уровня в сыворотке крови ассоциируется с повреждением нервной ткани различного генеза [12].
В ГИ2 и ГИ3 отмечались уровни NGF, сопоставимые с показателями в ГС: 74,186 (67,057; 85,758) пг/мл в ГИ2 (p = 0,168), 72,842 (71,396; 76,149) пг/мл в ГИ3 (p = 0,216) против 71,835 (57,500; 67,500) пг/мл в ГС.
Концентрация NGF статистически значимо была выше в ГИ1, чем в ГС, в ГИ1 статистически значимо выше, чем в ГИ3 (p = 0,0053). Не выявлено статистически значимых различий показателя между ГИ1 и ГИ2 (p = 0,067), ГИ2 и ГИ3 (p = 0,789). В то же время в нашем исследовании установлено, что концентрация NGF значимо повышалась лишь в ГИ1 (p = 0,005) – до 126,881 (81,264; 355,328) пг/мл, что, по-видимому, связано с нарушениями эндотелия сосудов предположительно головного мозга, а не легочной ткани.
Концентрация BDNF, относящегося к семейству нейротрофинов и отвечающего за выживаемость нейронов, их регенерацию, нейропластичность и способность к обучению, определялась на более низком уровне во всех исследуемых группах: в ГИ1 – 8460,544 (6583,237; 9201,663) пг/мл (p = 0,0018), в ГИ2 – 4547,324 (4051,322; 6208,352) пг/мл (p = 0,0048), в ГИ3 – 5276,906 (3157,366; 5357,652) пг/мл (p = 0,0011) по сравнению с ГС – 18 723,735 (18 723,735; 21 050,179) пг/мл. Таким образом, данные о снижении уровня BDNF в группах исследования свидетельствуют о наличии нейродегенеративных процессов у пациентов ГИ1, ГИ2 и ГИ3.
Полученные результаты указывают на нарушение выживания и регенерации нейронов не только у пациентов с неврологической патологией (ГИ1), но и у пациентов, имеющих ХОБЛ и ВИД (ГИ2 и ГИ3). Важно отметить, что у пациентов с ХОБЛ как в ГИ2, так и в ГИ3 данный процесс был более выражен, чем у пациентов только с неврологической патологией (ГИ1). Не получено статистически значимых различий между ГИ2 и ГИ3 (p = 0,896).
В результате корреляционного анализа установлена связь между полученными количественными данными изучаемых параметров иммунной системы и нейромедиаторов (рис. 2). Матрицы корреляции представлены в виде тепловых карт, на которых цветом показана величина коэффициента ранговой корреляции Спирмена для каждой пары оцененных параметров в группах исследования.
У пациентов с неврологической патологией (ГИ1) отмечалась статистически значимая сильная положительная связь между уровнями NSE и NGF (ρ = 0,883; p = 0,001), а также между уровнями белка S100B и MBP (ρ = 0,883; p = 0,001), что свидетельствует о едином патогенетическом континууме поражения нервной системы, опосредованном данными нейропептидами, и комплексном характере ее поражения в ГИ1. Напротив, в ГИ2 не выявлено корреляции между уровнями нейропептидов, что указывает на иной генез повреждения центральной нервной системы по сравнению с таковым в ГИ1. В ГИ3 установлена статистически значимая сильная положительная связь между уровнями белка S100B и MBP (ρ = 0,723; p = 0,005), NGF и MBP (ρ = 0,770; p = 0,002) и средняя положительная связь между уровнями белка S100B и NGF (ρ = 0,666; p = 0,012), что так же, как в ГИ1, указывает на комплексный характер поражения нервной системы и взаимообусловленность повышения концентрации данных нейропептидов.
Нами была также исследована корреляция между уровнями нейропептидов и параметрами, характеризующими функции НГ, дефекты которых были выявлены и преобладали во всех ГИ.
Для ГИ2 была определена статистически значимая сильная положительная связь между уровнем белка S100B и плотностью экспрессии CD63 на НГ субпопуляции CD63+CD16+CD62L+CD11b+ (ρ = 0,821; p = 0,023). Поскольку известно, что плотность экспрессии CD63 отражает способность НГ к дегрануляции и повреждению тканей активными формами кислорода и протеолитическими ферментами, есть основание полагать, что цитотоксическая субпопуляция НГ, содержание которой, по данным литературы, возрастает в пожилом и старческом возрасте, индуцирует свободнорадикальное повреждение нейронов, что и приводит к нарушению когнитивных функций у пациентов пожилого и старческого возраста с ХОБЛ [17]. Между уровнем BDNF, белка семейства нейротрофинов, и плотностью экспрессии CD63 на НГ субпопуляции CD63+CD16+CD62L+CD11b+, напротив, существует статистически значимая сильная отрицательная связь (ρ = -0,883; p = 0,001), что указывает на нарушение нейротрофических процессов при цитотоксическом воздействии НГ на нейроны. Выявлена также статистически значимая сильная отрицательная связь между плотностью экспрессии CD16 на НГ субпопуляции CD63-CD16+CD62L+CD11b+ и уровнем MBP (ρ = -0,816; p = 0,007), а также между плотностью экспрессии CD62L на НГ субпопуляции CD63-CD16+CD62L+CD11b+ и уровнем MBP (ρ = -0,833; p = 0,005). Согласно данным литературы, фенотип CD16dimCD62Ldim характерен для НГ в состоянии апоптоза, что может указывать на связь гибели НГ с повреждением миелиновой оболочки нейронов, природа которой, однако, остается невыясненной [18].
В ГИ1 отмечена статистически значимая сильная положительная связь между уровнем MBP и плотностью экспрессии CD11b как на НГ субпопуляции CD63-CD16+CD62L+CD11b+ (ρ = 0,940; p = 0,0048), так и на НГ субпопуляции CD63+CD16+CD62L+CD11b+ (ρ = 0,940; p = 0,0048). Учитывая, что плотность экспрессии CD11b отражает степень активации НГ, можно предположить, что гиперактивированные НГ у пациентов данной клинической группы могут участвовать в повреждении миелиновой оболочки нейронов, что является одним из факторов развития энцефалопатии и нарушения когнитивных функций [19]. В то же время плотность экспрессии CD11b на НГ повышается в пожилом и старческом возрасте в результате развития хронического неразрешающегося воспаления низкой степени активности (inflammaging) под действием провоспалительных цитокинов (особенно фактора некроза опухоли α), что, учитывая выявленную взаимосвязь, позволяет предположить, что повышение концентрации MBP в ГИ1 также связано с inflammaging и развивающимся нейровоспалением [20].
Кроме того, в ГИ1 отмечена положительная связь средней силы между концентрацией NSE и содержанием субпопуляции НГ CD63+CD16+CD62L+CD11b+ (ρ = 0,383; p = 0,308), между концентрацией MBP и содержанием субпопуляции НГ CD63+CD16+CD62L+CD11b+ (ρ = 0,350; p = 0,357), концентрацией NGF и содержанием субпопуляции НГ CD63+CD16+CD62L+CD11b+ (ρ = 0,533; p = 0,139), а также отрицательная связь средней силы между концентрацией BDNF и содержанием субпопуляции НГ CD63+CD16+CD62L+CD11b+ (ρ = -0,366; p = 0,332), что указывает на связь между количеством НГ, поляризованных к дегрануляции и образованию NETs, и повреждением нейронов, сочетающимся с недостаточностью их регенерации.
В ГИ3 выявлена статистически значимая сильная отрицательная связь между плотностью экспрессии CD62L на НГ субпопуляции CD63+CD16+CD62L+CD11b+ и уровнем MBP (ρ = -0,725; p = 0,005), средняя отрицательная связь между плотностью экспрессии CD62L на НГ субпопуляции CD63+CD16+CD62L+CD11b+ и уровнем белка S100B (ρ = -0,685; p = 0,009), средняя отрицательная связь между плотностью экспрессии CD62L на НГ субпопуляции CD63+CD16+CD62L+CD11b+ и уровнем NGF (ρ = -0,646; p = 0,016). Учитывая, что при активации НГ происходит шеддинг CD62L с их поверхности, что приводит к уменьшению плотности экспрессии данного белка, выявленная закономерность указывает на зависимость уровней нейропептидов, отражающих гибель нейронов, от степени активации НГ и снижения их миграционной способности. В ГИ3 также отмечена статистически значимая сильная отрицательная связь между концентрацией MBP и плотностью экспрессии CD11b как на НГ субпопуляции CD63+CD16+CD62L+CD11b+ (ρ = -0,854; p = 0,0016), так и на НГ субпопуляции CD63-CD16+CD62L+CD11b+ (ρ = -0,890; p = 0,0005), а также статистически значимая отрицательная связь средней силы между уровнем NGF и MFI CD11b на субпопуляции НГ CD63-CD16+CD62L+CD11b+ (ρ = -0,698; p = 0,0425). Кроме того, установлена отрицательная связь средней силы между концентрацией BDNF и содержанием субпопуляции НГ CD63+CD16+CD62L+CD11b+, что указывает на снижение репаративных процессов в нервной системе при увеличении субпопуляции НГ с цитотоксическими свойствами. Таким образом, для пациентов ГИ3 наиболее вероятно повреждение нервной системы в результате цитотоксического действия НГ на нейроны.
Заключение
В результате проведенного исследования у пациентов как с ХОБЛ, так и с неврологической патологией были выявлены дисфункции иммунной системы с преобладающими нарушениями функций НГ (рецепторной, фагоцитарной, NADPH-оксидазной активности). Помимо этого, в исследуемых группах установлены дисфункции нервной системы, ассоциированные с когнитивными нарушениями, дисбалансом нейропептидов и нейротрофинов, свидетельствующим о повреждении нейронов и их миелиновых оболочек. Проведенный корреляционный анализ доказывает тесную связь между функционированием нервной и иммунной систем.
Одним из важных моментов данного исследования стало установление факта повреждения нервной системы вследствие длительно существующего системного хронического воспаления в респираторном тракте, сопровождающегося дисциркуляторными нарушениями церебральной гемодинамики, гиперкапнией и гипоксией головного мозга, что подтверждается данными, полученными ранее другими исследователями [21].
Одним из возможных механизмов повреждения нервной системы у пациентов с неврологической патологией, ХОБЛ и их сочетанием является переориентация НГ для осуществления эффекторных функций, реализующихся за счет их цитотоксического потенциала, – увеличение плотности экспрессии CD63 на НГ субпопуляции CD63+CD16+CD62L+CD11b+, что способствует повышению NADPH-оксидазной активности и образованию NETs.
Сравнительный анализ маркеров повреждения нервной и иммунной систем позволил обнаружить связь между дисфункцией иммунной системы, в частности между системой НГ и формированием неврологических расстройств при ХОБЛ. Не менее важно и то, что у пациентов с сочетанной патологией нервной системы и респираторного тракта (ГИ3), получавших регулярную курсовую терапию, направленную на нормализацию неврологического статуса, уровни нейропептидов, свидетельствующих о повреждении нервной системы, а также изменения в иммунной системе были менее выраженными, чем у пациентов с ХОБЛ (ГИ2), предъявлявших жалобы на умеренные когнитивные нарушения, но не имевших установленного неврологического диагноза и, соответственно, не получавших адекватной фармакологической поддержки нервной системы. При этом коррекция неврологических нарушений ноотропными препаратами у пациентов с сочетанной патологией респираторного тракта и нервной системы (ГИ3) позитивно сказывалась и на состоянии иммунной системы, тогда как при отсутствии неврологической поддержки у пациентов с ХОБЛ (ГИ2) выявлялись более глубокие нарушения как в иммунной, так и в нервной системе. Полученные данные убедительно доказывают, что очевидна необходимость отнесения пациентов с ХОБЛ к группе риска по развитию неврологической патологии для более раннего выявления клинических признаков и наиболее значимых установленных лабораторных маркеров неврологических и иммунных нарушений и своевременной их коррекции. Обнаруженные корреляционные связи в работе нервной и иммунной систем, подкрепленные формированием соответствующего клинико-иммунологического синдрома, сочетающего ХОБЛ, когнитивные нарушения и дефекты работы иммунной системы, в частности НГ, раскрывают концепцию применения междисциплинарного подхода к лечению коморбидного пациента с использованием адекватной базисной терапии ХОБЛ, неврологической поддержки и иммуномодулирующей терапии, позволяющих через разные точки приложения позитивно воздействовать на нарушенный нейроиммунный комплекс, тем самым увеличивая продолжительность и улучшая качество жизни пациентов пожилого и старческого возраста. Разработка и применение эффективных комплексных персонифицированных программ иммуномодулирующей терапии в сочетании с коррекцией когнитивных нарушений в реабилитации больных с ХОБЛ будут являться весьма существенным фактором профилактики раннего возникновения и прогрессирования неврологических расстройств и дисфункции иммунной системы.
I.V. Nesterova, MD, PhD, Prof., S.V. Kovaleva, MD, PhD, Prof., G.A. Chudilova, DBS, Prof., E.A. Poezzhaev, A.I. Pirogova, V.N. Chapurina, PhD, L.V. Lomtatidze, PhD
Kuban State Medical University
Peoples' Friendship University named after Patrice Lumumba
Contact person: Irina V. Nesterova, inesterova1@yandex.ru
The rapidly increasing proportion of elderly and senile individuals in the human population makes the problem of age-associated diseases increasingly relevant, necessitating the search for new interdisciplinary approaches to treating this patient group. Chronic obstructive pulmonary disease (COPD) is one of the most common and socially significant diseases in the elderly, with disorders in both the immune and nervous systems playing a role in its development and exacerbation. Therefore, identifying potential laboratory markers of neuroimmune dysfunction in COPD is promising, enabling personalized diagnostic and treatment interventions that will contribute to increasing the life expectancy and quality of life in the elderly.
Objective – to identify the most informative and interrelated biomarkers characterizing immune and nervous system dysfunction in elderly and senile patients with COPD and neurological pathology.
Material and methods. The study included 44 patients of both sexes aged 60–78 years, as well as 10 conditionally healthy volunteers of the corresponding age and sex. Three clinical study groups (SGs) were formed: SG1 – 16 patients with neurological pathology, SG2 – 15 patients with exacerbation of COPD complicated by respiratory failure of grades I and II, SG3 – 13 patients with exacerbation of COPD complicated by respiratory failure of grades I and II, and neurological pathology. A general clinical examination of patients, assessment of the lymphocytic arm of the immune system, study of effector functions and subsets of neutrophil granulocytes expressing receptors CD63, CD16, CD62L, CD11b, and determination of serum concentration of marker neuropeptides were performed.
Results. Dysfunction of the lymphocyte arm of the immune system, impaired effector functions of neutrophil granulocytes (decreased ability to capture and kill pathogens), and redistribution of surface membrane receptors on neutrophil granulocytes, characterizing their reorientation toward degranulation, were identified. Furthermore, increased concentrations of neuropeptides reflecting neuronal death were observed, most pronounced in patients with neurological and combined pathology, while decreased concentrations of neuropeptides characterizing neurotrophic processes were observed, most pronounced in patients with COPD.
Conclusion. Correlation analysis revealed a relationship between dysfunction of the nervous and immune systems, indicating their close integration and the need for a joint assessment of their functioning, which can be achieved using the identified biomarkers.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.